
中文题目:来自原代供体匹配组织来源的马间充质基质细胞的单细胞RNA测序揭示了免疫调节和细胞运动的功能异质性
英文题目:Single-cell RNA sequencing of equine mesenchymal stromal cells from primary donor-matched tissue sources reveals functional heterogeneity in immune modulation and cell motility
发表杂志:Stem Cell Research & Therapy
影响因子:6.832
发表日期:2020.12
发表单位:美国康奈尔大学兽医学院贝克动物健康研究所
研究背景
几十年来,利用间充质基质细胞(MSCs)的组织工程和再生医学被认为在各种疾病的临床应用前景广阔,然而,大量的表型和功能的批次之间的差异阻碍了基础研究和临床应用的效率和可重复性(Arezoo et al., 2017,Arezoo et al., 2018,Wei et al., 2018)。MSC治疗的疗效被认为取决于从不同组织来源分离的MSC培养物和从同一组织来源分离的MSC的异质性,MSC异质性通常通过形态学、表面标记物的表达、细胞动力学、分化潜能和选择基因表达模式来评估(Ho et al., 2008,Meirav et al., 2011)。单细胞RNA测序(scRNA-seq)是一种用于解剖细胞异质性的强大工具(Barrett et al., 2019),但是到目前为止,还没有关于供体匹配的组织来源的小鼠间充质基质细胞的scRNA-seq数据的报道(Zhou et al., 2019),为了克服从不同组织来源收集供者匹配的间充质基质细胞的实际障碍,马是很好的模型。
美国康奈尔大学兽医学院贝克动物健康研究所Van de Walle研究团队于2020年12月4日在Stem Cell Research & Therapy上发表了解析MSC异质性的研究进展。文章利用了scRNA-seq等技术探索三个不同组织来源(AT、BM、PB)的原代马间充质基质细胞的源间和源内异质性,并确定了检测到的转录差异与细胞运动和免疫调节功能的表型变异相对应,这将提高MSC 治疗潜力,加速其从实验室到临床的过渡。
研究方法
在本研究中,作者从健康成年温血母马的脂肪组织(AT)、骨髓(BM)和外周血(PB)3种组织中分离出MSCs,基于scRNA-seq检测到的转录差异,进行了功能实验以检查不同MSC群体的运动和免疫调节功能。
研究结论
来自三个不同组织来源的MSC培养物之间连接粘附分子2(JAM2)的差异表达转化为BM来源的MSC的细胞运动性改变 ;
来自相同组织来源的克隆MSC系中CXCL6表达的差异与PB衍生的MSCs的化学吸引能力相关。
实验材料
材料:从健康成年温血母马的脂肪组织(AT)、骨髓(BM)和外周血(PB)3种组织中收集初生马间充质基质细胞(MSCs ),无生物学重复,共计3个样本。
方法:scRNA-seq,siRNA敲除,RT-PCR,Western blotting,细胞增殖、粘附测定,细胞侵袭和迁移实验,细胞克隆和细胞趋化实验
研究结果
1. scRNA-seq数据揭示了从供体匹配的组织来源分离的MSCs的来源间变异
从健康成年温血母马的脂肪组织(AT)、骨髓(BM)和外周血(PB)3种组织中收集初生马间充质基质细胞(MSCs ),共3个样本,并根据它们分化成脂肪细胞、软骨细胞和骨细胞的潜力以及细胞蛋白的表达模式进行表征实验,几乎没有观察到MSCs的源间或源内变化(Fig. 1a(i))。对来自骨髓,脂肪和外周血组织的MSCS进行流式细胞仪检测, 结果显示MSC标记基因ITGB1、CD44、THY、ENG和B2M基因在每个组织中都有大多数细胞表达(Fig. 1a(ii))。基于10x genomic平台进行了scRNA-seq分析,scRNA-seq数据进一步证实了流式细胞仪结果(Fig. 1b)。为了进一步揭示了MSCs的来源间变异,作者分析了三种组织来源的所有scRNA-seq数据,采用无监督聚类将细胞划分为3个细胞亚群。聚类结果显示细胞主要是通过来源组织聚集在一起的,将不同样本用不同颜色标出恰好得到每个cluster几乎完全对应着一个样本(Fig. 2a)。热图显示三个不同组织之间显著差异表达基因(DEGs)(Fig. 2b),分别在AT、BM和PB来源的骨髓间充质基质细胞中检测到37、35和20个DEGs。对每个组织来源分离的MSC中前5个DEGs表达水平进行小提琴图展示(Fig. 2c)。
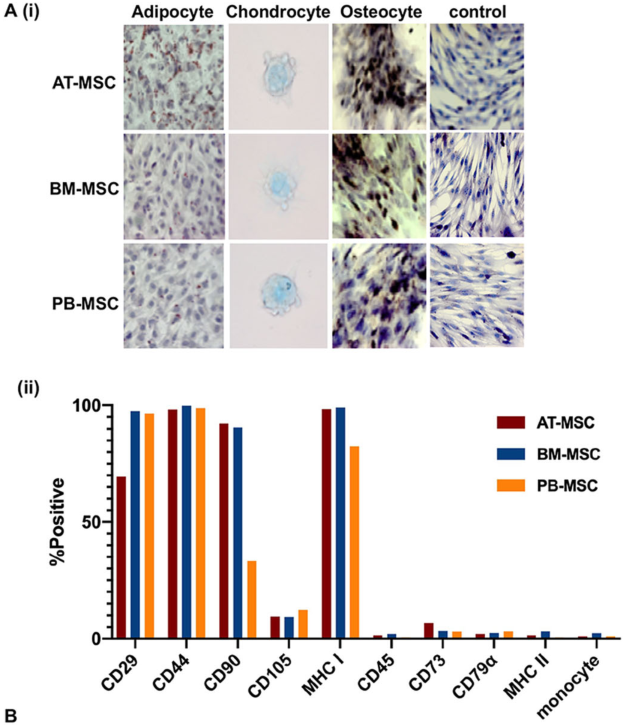
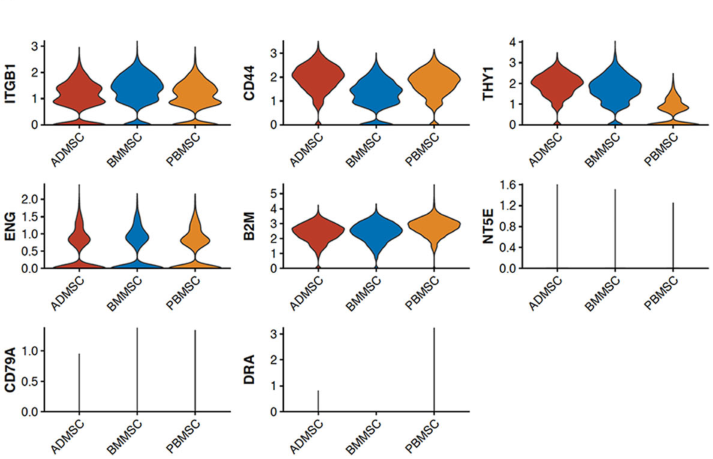
图1从3个供者匹配的组织来源分离的马间充质基质细胞(MSCs)的表征
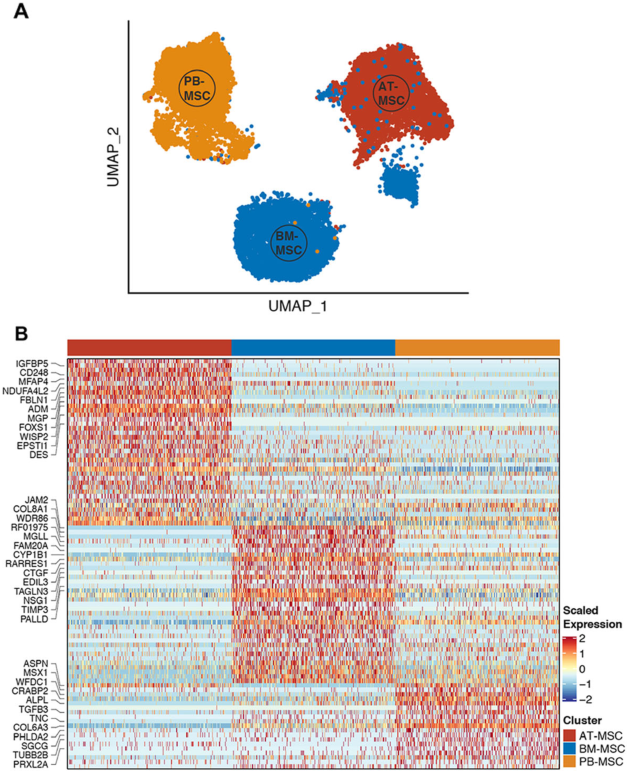
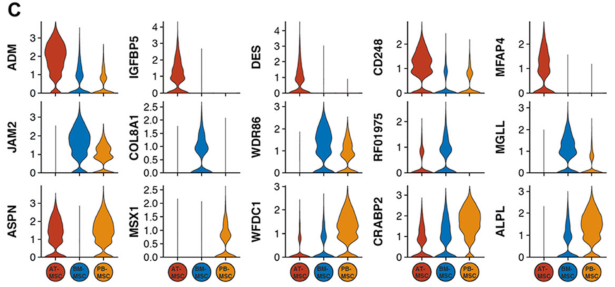
图2单细胞RNA测序(sc RNAseq)数据揭示了马间充质基质细胞(MSCs)的源间变异
2. 连接粘附分子2(JAM2)调节骨髓间充质基质细胞的细胞运动表型
scRNA-seq结果发现,JAM2相对于PB衍生的MSCs和AT衍生的MSCs,在BM衍生的MSCs中的表达水平显着更高(Fig. 2c),作者在组间显著差异表达的基因里边挑选出了连接粘附分子2(JAM2),JAM2基因编码JAM-2/JAM-B蛋白,有研究表明JAM-2在扩散、粘附、迁移和入侵的各种过程中发挥作用,作者通过RT-PCR验证了来自这三种不同组织来源的MSCs中JAM2的表达模式。为了探索JAM2在MSC生物学中的作用,作者首先测定来自供体匹配脂肪组织(AT)、骨髓(BM)和外周血(PB)的MSCs中细胞增殖率的基线测量(Fig. 3a(i)),细胞粘附力(Fig. 3a(ii)),细胞入侵能力(Fig. 3a(iii)),以及细胞迁移能力(Fig.3a(iv))。然后作者使用RNA干扰(RNAi)来降低BM衍生的MSCs中JAM2的表达并做对比实验,结果发现敲除JAM2对BM来源的MSCs增殖没有显著影响(Fig. 3b(i)),它也没有改变粘附强度(Fig. 3b(ii)),但JAM2的敲除导致入侵能力增强(Fig. 3b(iii)),BM来源的MSCs迁移减少(Fig.3b(iv)),表明JAM-2调节BM来源的MSCs的细胞运动表型。总的来说,这些结果表明JAM2参与了BM衍生的MSCs的细胞侵袭和迁移。除了差异基因表达外,作者表明MSCs的源间异质性转化为生物学相关的MSC功能,例如与细胞运动相关的功能。
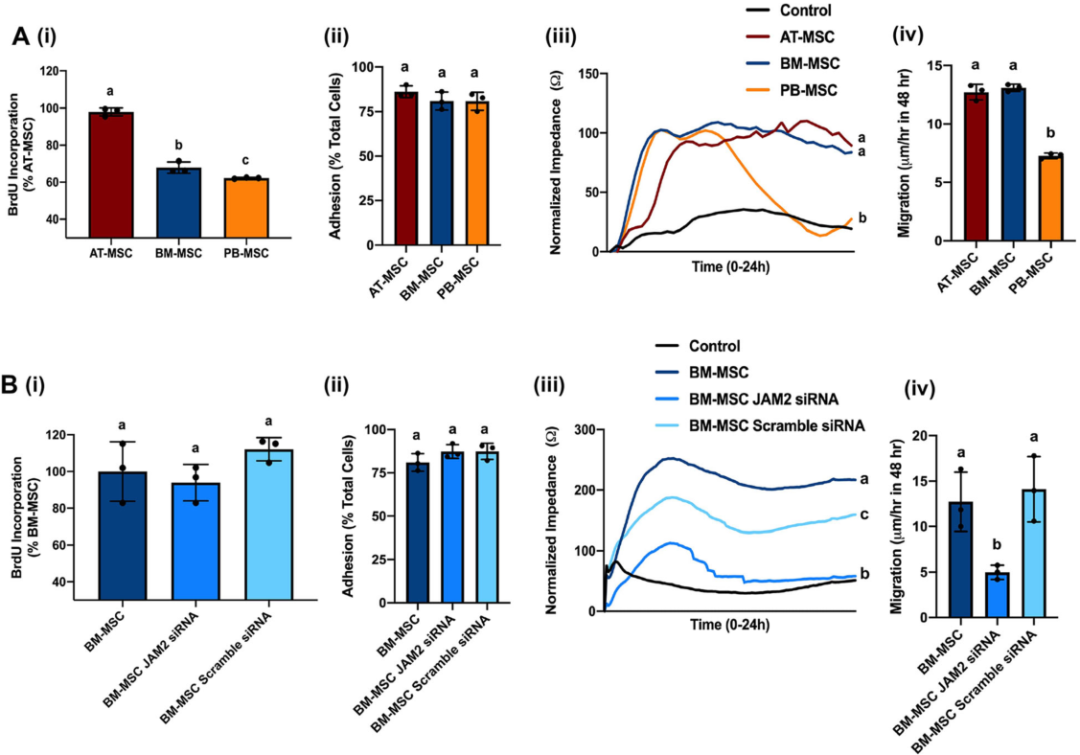
图3敲除骨髓间充质基质细胞(MSCs)的连接粘附分子2(JAM2)可改变细胞的运动性
3. scRNA-seq数据揭示了从供体匹配组织来源分离的马骨髓间充质基质细胞的来源内变异
无监督聚类分别将AT来源的MSCs、BM来源的MSCs和PBM来源的MSCs聚类为7,7,10个clusters(Fig. 4a)。根据作者最初的分析中,细胞周期相关基因的表达对聚类有很大的影响(Kowalczyk et al., 2015)。在本研究中作者也观察到一些明显由与增殖一致的基因表达模式定义的簇(Fig. 4b),因此,作者进一步分析了G1 clusters和G2M/S clusters,以确定不同细胞周期分类的簇间差异基因表达模式。在这种分组策略下,差异基因表达测试显示来自AT、BM和PB衍生的MSCs中存在明显的源内转录异质性,尽管在AT来源的MSCs中差异较小,差异表达基因 (DEGs) 以热图的形式进行展示 (Fig. 5)。为了检查检测到的clusters的假定生物学功能,作者对每个组织中的每个cluster进行了GO功能富集分析,其中BM来源的MSCs中排名最靠前的是cluster2的细胞迁移和cluster3中的慢性炎症反应,PB来源的MSCs中排名靠前的是cluster4的蛋白组折叠和cluster6中的趋化性调节,AT来源的MSCs没有检测到任何显著富集的GO terms,表明检测到的clusters之间的转录差异极小。
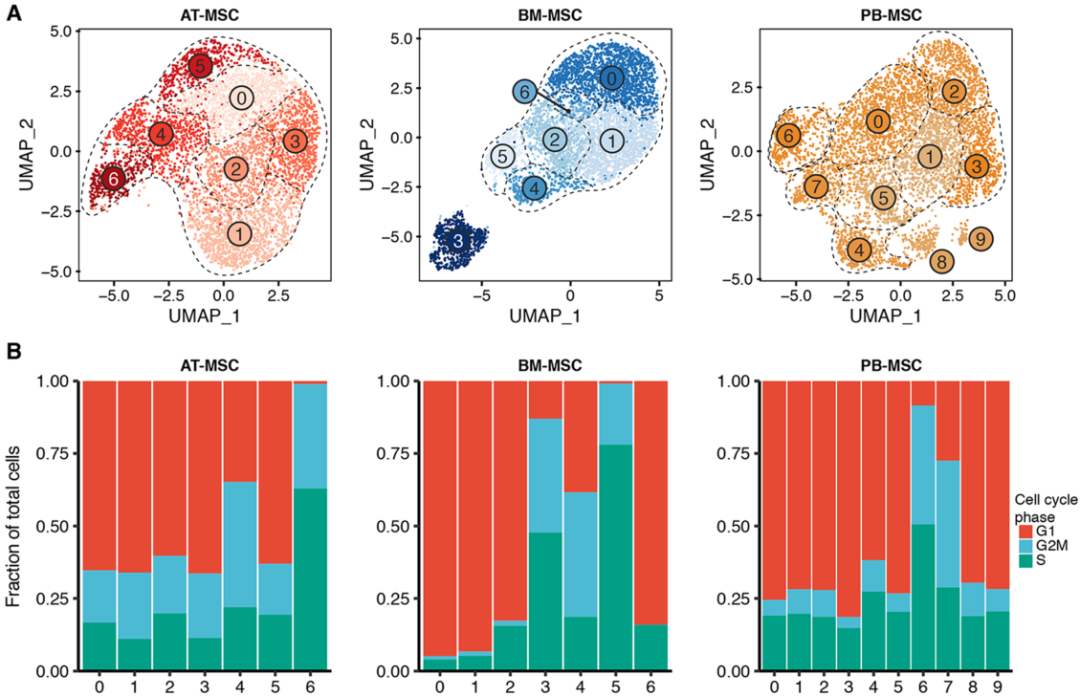
图4单细胞RNA测序(sc RNAseq)数据揭示了马间充质基质细胞(MSCs)的源内变异
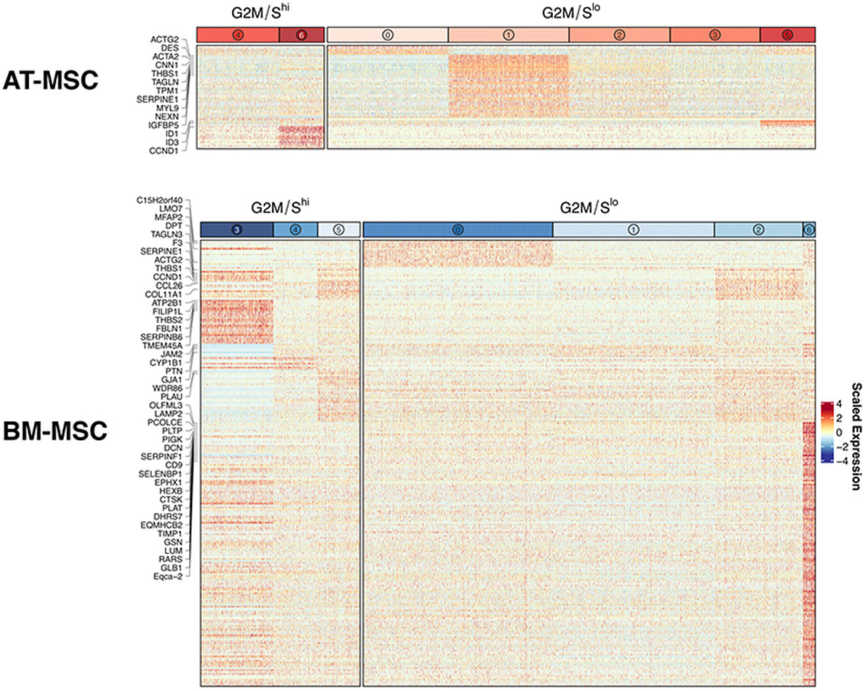
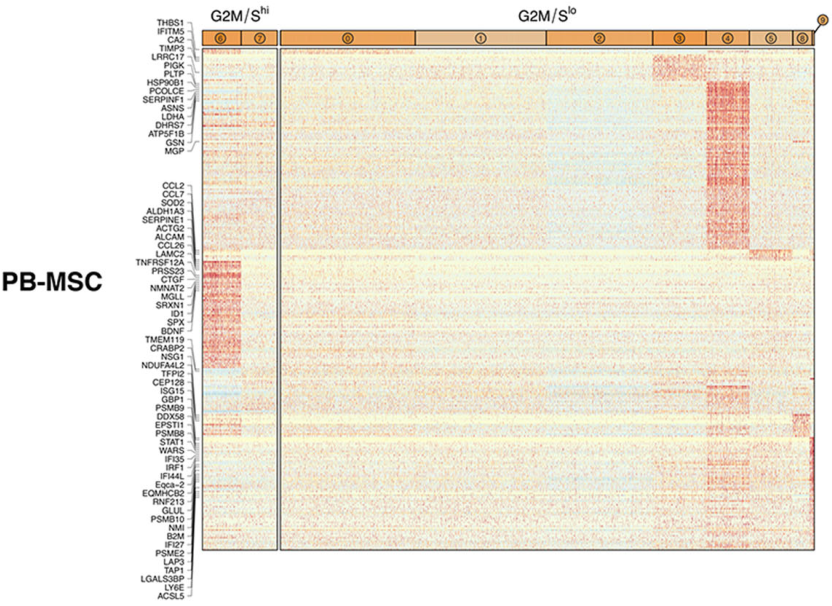
图5从3个供体匹配组织来源分离的马间充质基质细胞(MSCs)表现出源内转录异质性
4. PB衍生MSC的克隆异质性揭示了趋化能力的功能差异
在PB-MSC和BM-MSC分析中显著富集的GO terms中,作者注意到与细胞迁移和趋化性相关的功能。作者使用体外限制性稀释细胞克隆试验来产生克隆的PB衍生MSC系,用于下游功能性趋化性试验,探索MSC趋化活性可能的功能源内变异。根据scRNA-seq分析结果,从单个PB来源的MSCs中产生14个克隆细胞系,并通过RT-PCR评估各种趋化相关基因的表达。作者发现 C-X-C 基序趋化因子配体 6 (CXCL6),一种参与粒细胞募集的分子,相对于其他克隆,在克隆 5 中的表达水平显着更高(Fig. 6a),这与scRNA-Seq检测PB-MSC群体中少数细胞中CXCL6的表达一致(Fig. 6b-d)。将骨髓间充质基质细胞添加到带有3μm孔插入物的transwell板的下孔中,该孔插入物接种有马中性粒细胞。作者观察到,与CXCL6 low MSCs相比,CXCL6 hi MSCs刺激中性粒细胞迁移到显著更高的水平,而大量原始MSC培养刺激中性粒细胞迁移到中等水平(Fig. 6e)。当使用从 CXCL6hi MSC 收集的条件培养基(CM)进行这些实验时,观察到了类似的结果(Fig. 6f),表明骨髓间充质基质细胞对趋化性的影响不需要直接接触细胞。
这些结果表明,MSCs中的CXCL6表达水平与体外增加的中性粒细胞迁移相关,并提供了概念验证,即PB衍生的MSCs中的源内异质性转化为生物学相关功能,例如与免疫调节相关的功能。
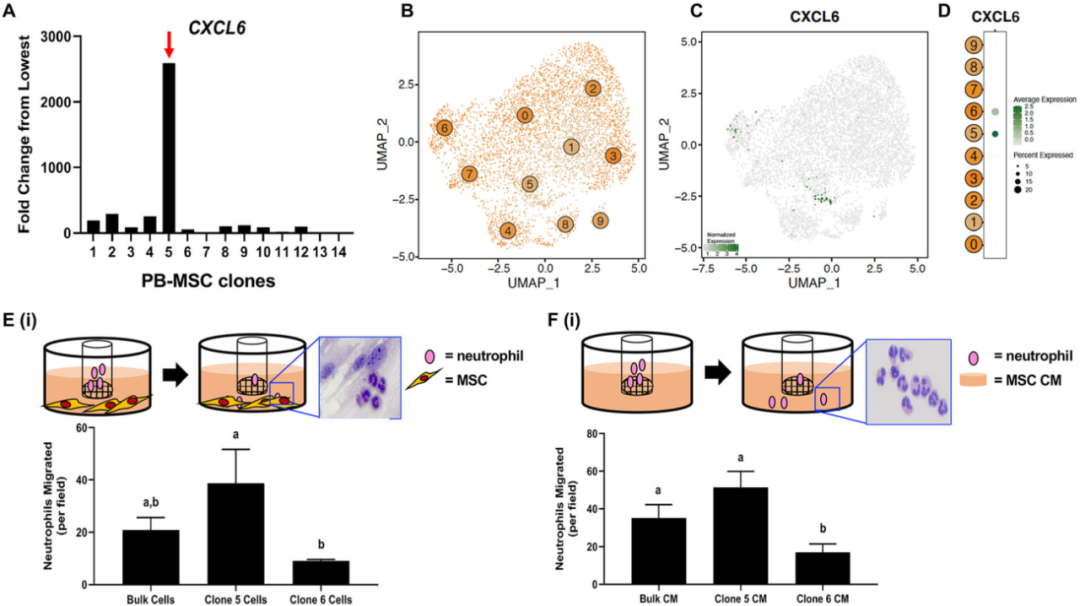
图6外周血(PB)来源的间充质基质细胞(MSCs)来源内的异质性转化为不同的化学吸引能力
总结
本研究首次使用scRNA-seq技术来比较从单个供体的3个不同组织来源分离的间充质基质细胞 (MSCs) 的表达谱,单细胞分辨率下的基因表达谱表明,来自不同组织来源的MSCs在转录上是不同的,来自同一组织来源的MSCs也表现出基因表达的差异。来自三个供体匹配组织来源的MSC培养物之间JAM2的差异表达转化为BM衍生的MSCs的细胞运动性改变,证明JAM2调节BM来源的MSCs的细胞运动表型。此外,来自相同组织来源的克隆MSC系中CXCL6表达的差异与PB衍生的MSCs的免疫调节功能相关。综上,单细胞转录组学数据可以为功能研究提供理论基础,更好地了解赋予MSC特定治疗有益特性的细胞异质性以及开发捕获和扩展具有这些特性的特定MSCs的方法。这些进展将加速MSC治疗从基础医学的工作台转移至临床。
如果您对该研究思路感兴趣,欢迎点击下方按钮联系我们。
参考文献:
Harman RM, Patel RS, Fan JC, Park JE, Rosenberg BR, Van de Walle GR. Single-cell RNA sequencing of equine mesenchymal stromal cells from primary donor-matched tissue sources reveals functional heterogeneity in immune modulation and cell motility. Stem Cell Res Ther. 2020 Dec 4;11(1):524.
doi: 10.1186/s13287-020-02043-5.
PMID: 33276815;
PMCID: PMC7716481.









 京公网安备 11011302003368号
京公网安备 11011302003368号