
研究背景
下丘脑在调节机体基本稳态和行为方面具有关键作用,包括进食、日常节律、繁殖、压力反应等。下丘脑神经元多样化的特点是经典神经递质(氨基丁酸 [GABA]、谷氨酸、乙酰胆碱、多巴胺或组胺)和不同神经肽或激素的联合表达,这是构成下丘脑功能复杂性的基本因素。神经元亚群的发育异常会诱发下丘脑功能障碍相关疾病,如肥胖、能量失衡和睡眠障碍。对啮齿动物的研究揭示了胎儿和成人下丘脑在细胞和分子水平上的特性,并提供了对下丘脑复杂细胞层次和功能的详细了解。然而,关于人类下丘脑胶质细胞和神经元发育的时空分子特征知之甚少。
研究材料
材料:人类下丘脑的采样时间范围从妊娠周(GW)7到20(具体为GW7、GW8、GW10、GW12、GW15、GW18、GW20),其中GW12和GW18分别两个生物学重复;GW15到GW20(GW15、GW18_1、GW20),沿前后轴大致分为三组,大致对应于前、结节/内侧和后域
方法:单细胞转录组测序、免疫荧光
研究成果
1、人类下丘脑发育的分子多样性
本研究利用scRNA-seq检测了112,376个人类下丘脑细胞,分别为GW7-20(图 1A)。聚类分析确定了主要细胞群(图 1B),通过marker基因来鉴定已知细胞类型,包括神经上皮细胞(NE)、NP、神经元、星形胶质细胞、OL前体细胞(OPC)、OL谱系细胞、小胶质细胞等(图 1C,1D)。基于细胞类型和分子功能,将下丘脑发育的进程分为四个阶段:GW7、GW8-10、GW12-15和GW18-20(图 1E,1F)。通过免疫荧光也观察到GW15下丘脑后部区域的神经胶质细胞比例低于前部/内侧区域(图 1G,1H),表明胶质细胞的在不同空间区域的发育是不同步的。
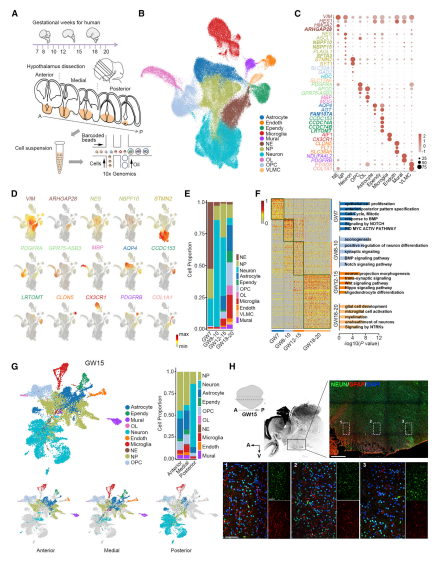
图1 人类发育中的下丘脑细胞类型的分子表达谱
2、早期下丘脑NE和祖细胞的异质性
根据细胞群间的差异基因确定细胞类型,包括NE、NP、神经元和一些间充质脑膜样成纤维细胞(图 2A)。免疫染色显示了GW8中不同类型细胞的基因表达和位置(图 2B,2C),同时发现LUM、COL3A1和FOXC1在脑膜细胞中高度表达(图 2D)。排除脑膜样成纤维细胞簇,构建了GW7其余细胞的发育轨迹(19,916 个细胞;图 2E),发现从NE到NP的细胞发育谱系,通过对DEG的GO分析,确定了从NE到早期祖细胞(图 2F)谱系转变的关键信号通路。此外,还展示了从NE到NP关键TF的表达模式(图 2G)。通过亚群分析,确定了7个NE亚型和8个NP亚型(图 2H)。此外,评估了早期NE和NP亚群之间的潜在关系(图 2I,2H)。这些结果表明,不同下丘脑位置的早期NPs显示出分子异质性。
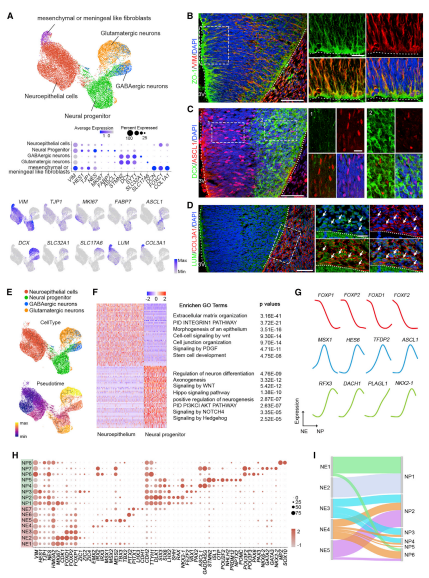
图2 早期下丘脑NE和祖细胞的分子异质性
3、由调节基因控制的不同祖细胞分化命运
NP被进一步细分为25种细胞类型(图 3A),使用SCENIC算法进行了“调节子”分析,发现胶质细胞谱系富含参与神经胶质的多个已知调节子,包括OLIG1/2、SOX8和几个早期基因相关的调节子(图 3B,3C)以调节细胞周期进程。基于基因网络和富集分析(图 3D,3E),发现在结节NP亚型中表达的OTP和PRDM12调节子可以调节不同的ARC神经元命运,这与它们在控制ARC分化中的作用一致。这些数据表明,NPs的细胞命运确定发生在下丘脑发育的早期阶段,并且细胞分化由多个关键TF的组合决定。
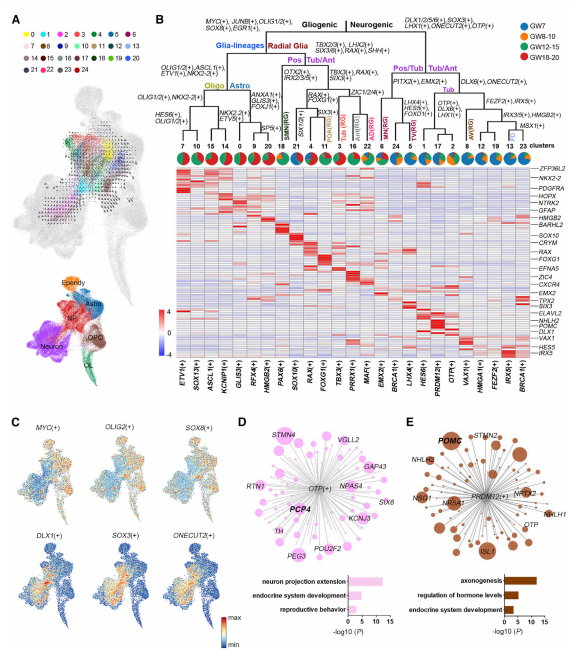
图3 由调节子调节的下丘脑祖细胞的发育多样化
4、下丘脑神经元的时空组成
将神经元(n=32,811个细胞)细分为50个簇,包括GABA能、谷氨酸能和组胺能(HDC)神经元(图 4A)。几种亚型的空间特征由其特定神经肽的表达明确定义(图 4B)。通过对几个代表性核的相关分布研究,发现前/结节区域的核生成出现在早期(GW7-8),而后部区域的核生成发生在GW10之后(图 4C)。表明人类下丘脑中的不同细胞核是在不同的时间窗中形成的,遵循前后和内外空间排序。
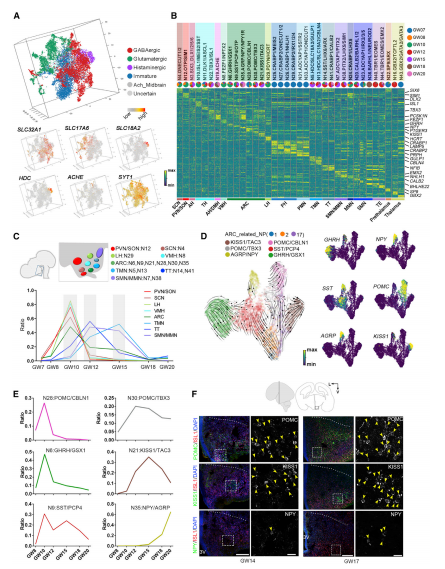
图4 转录不同的神经元亚群
5、ARC神经元亚群的不同谱系轨迹
本研究共收集3,628个ARC,确定了六种ARC亚型,包括KISS1+TAC3+、GHRH+GSX1+、SST+PCP4+、AGRP+NPY+、POMC+CBLN1+和POMC+TBX3+簇(图 4B)。通过整合和预测分析确定了有助于ARC形成的NP,从NP1、NP2和NP17中提取了与ARC相关的祖细胞,并在ARC中绘制了这些祖细胞和神经元亚型,以使用velocyto进行拟时序分析(图 4D),发现人类ARC中的神经元亚群在转录上出现在不同的时间点(图 4E)。利用免疫染色来验证神经元亚型marker的表达,观察到POMC表达,并且KISS1+细胞显著存在于外侧ARC中,但在GW17仅观察到少数表达NPY的细胞(图 4F)。这些结果揭示了ARC神经元亚群的分子多样性,并且它们发育的时间不同。
6、OL的分子表达异质性
本研究确定了EGFR+ pre-OPC、PDGFRA+ OPC(OPCs)和OL(BCAS1+ 和 MBP+)(图 5A),然后将OPC分为四个亚型,OL分为六个亚型(图 5B)。使用velocyto对OPC和未成熟OL亚群进行轨迹分析,确定了人类下丘脑OL谱系的不同分化路径(图 5C)。根据不同妊娠期OL谱系亚群的比例,发现从OPC2到OL1和从OPC1到OL2的两条OL早期路径分别代表GW12和GW18/20的峰值(图 5D)。对人类下丘脑中的PDGFRA、MBP和OLIG2进行免疫染色,发现PDGFRA+ OPCs少量存在于GW10地幔区,并从GW12到GW17逐渐增加(图 5E)。对EGFR、PDGFRA和MBP进行了免疫染色,分别在三个时间阶段(GW12、GW14、GW17)的前部、内侧和后部区域显示preOPCs、OPCs和OLs特征。这些OL谱系细胞在人类下丘脑发育中沿前后轴显示出空间发育不同步性(图 5F-5J)。Cell Chat细胞通讯分析,确定了早期特异性信号,包括WNT、Hippo和相关的粘附分子,如整合膜蛋白通路(图 5K和5L),明确了它们在GW12的早期胶质生成过程中介导胶质-神经元相互作用。
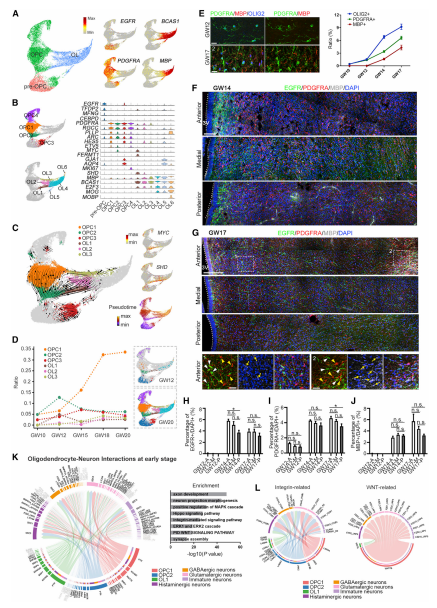
图5 OL成熟过程中的转录动力学
7、哺乳动物下丘脑胶质细胞的不同转录模式
对3,500个高度可变的基因进行scCoGAPS分析,发现了137个富集模式,主要的人类下丘脑细胞类型被映射到小鼠RNA-seq数据集中(图 6A),发现大量人类特异性基因在下丘脑的主要细胞类型中特异性富集(图 6B)。接下来,关注富含神经元的高表达人类特异性基因,并进一步明确这些基因在不同神经元亚型中的表达(图 6C)。DIRAS3在ARC的NPY+神经元中表现出特异性表达,并在GW15后逐渐增加,这与NPY的时间表达模式相似(图 6E)。
与小鼠相比,神经胶质细胞显示出人类基因表达模式(图6F),这种模式中的marker基因已在人类下丘脑的早期OPCs或OLs中特异性表达(图 6G)。通过人类OL和神经元细胞的互作分析,发现人类模式107中的子集基因参与早期OL-神经元通信(图 6H)。人类星形胶质细胞的发育从GW15开始,但在小鼠出生后2天开始(P2)(图 6I),证明下丘脑星形胶质细胞形成的物种差异。为进一步验证,在人类(GW17)和小鼠(P2)下丘脑中对HOPX和GFAP进行了联合染色,结果发现HOPX+GFAP+星形胶质细胞亚型主要存在于人类中(图 6K),表明不同星形胶质细胞亚型具有物种特异性。
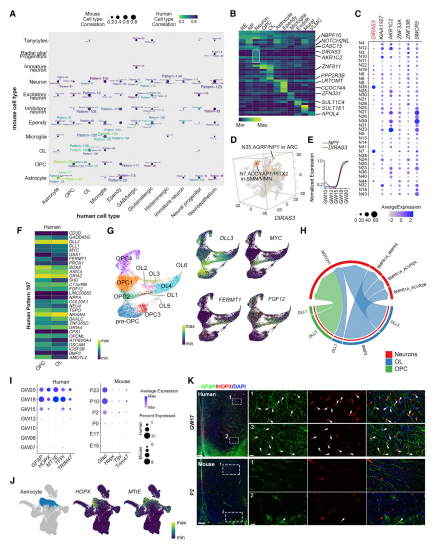
图6 人和小鼠下丘脑细胞的分子差异
研究结论
本研究分析了下丘脑主要细胞类型及其差异表达基因,还确定了编码NP的重要调节因子。此外,也定义了在下丘脑神经发生过程中占据特定细胞核的不同神经元亚群的时空转录模式。并与小鼠OLs相比,确定了人类OLs相关的基因表达模式。此外,早期OL神经元相互作用可能通过多种信号通路影响神经元分化。综上,本研究以单细胞分辨率提供了人类下丘脑发育中神经元和神经胶质细胞的全面分子图谱,并阐明了人类下丘脑的时空组织和下丘脑核形成的关键调节因子。
点击下方按钮,我们将为您免费进行文章思路方案设计。
文献引用:
Deciphering the spatial-temporal transcriptional landscape of human hypothalamus development








 京公网安备 11011302003368号
京公网安备 11011302003368号