研究背景
中枢神经系统(CNS)无论是急性(例如创伤性损伤)还是慢性(例如神经退行性疾病)的损伤,都会导致不可逆转的神经元损害甚至死亡,而那些存活下来的神经元有的能长出新的轴突并重新建立突触连接。该研究通过单细胞转录组揭示了与视神经挤压 (ONC)后小鼠视网膜神经节细胞(RGC)的选择性恢复能力相关的差异表达程序。
实验方法
材料:成年小鼠(n=10)眼球中分离的视网膜神经节细胞(RGC)
方法:单细胞转录组测序、免疫组化、FISH、转录组测序
研究结果
1、视网膜神经节细胞(RGC)类型分析
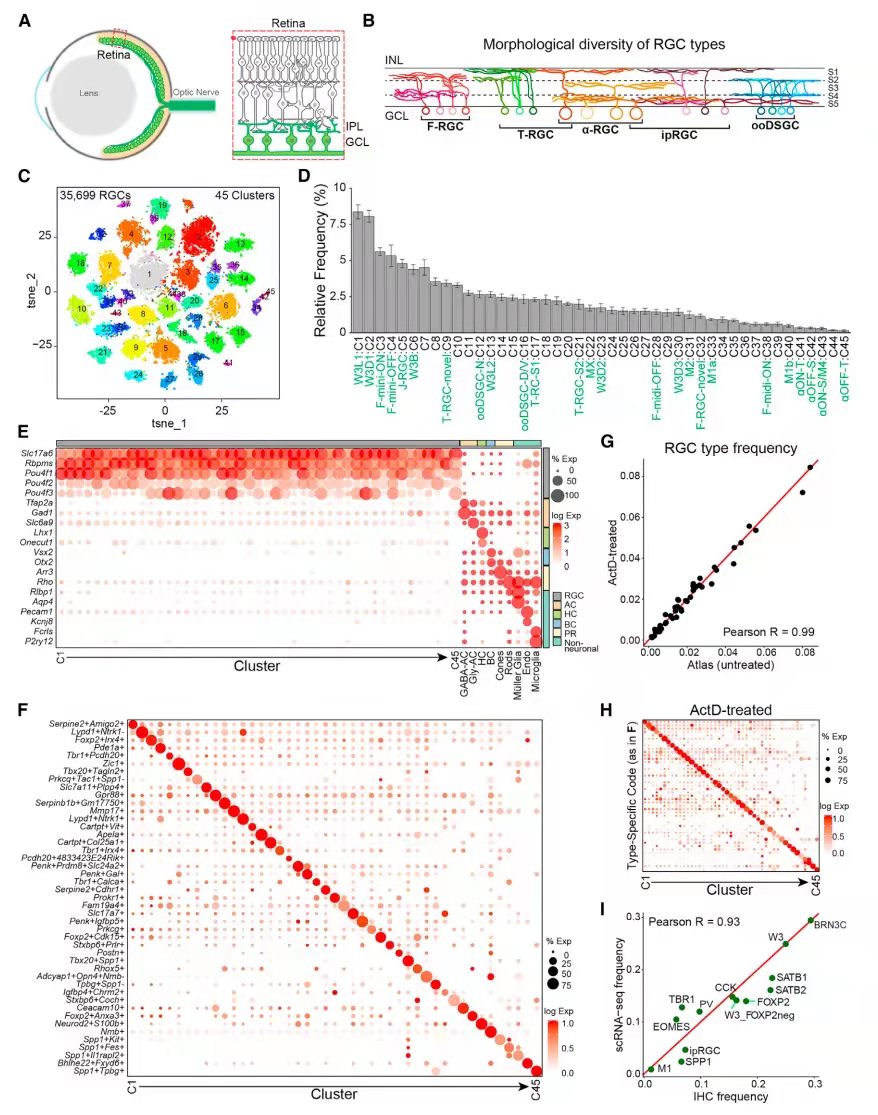
通过荧光分选(FACS)从成年(产后56天)小鼠眼、球中分离出RGC,进行scRNA-seq分析(图 1A),共获得35,699个细胞,分为45个cluster(图 1C),45个cluster的相对丰度从0.15%到8.4%不等(图 1D)。45个cluster都表达泛RGC标记,例如Slc17a6、Rbpms和Pou4中的至少一个(图 1E),45个cluster top2差异基因(DE)如图1F所示。
图1 scRNA-seq揭示成年小鼠45种不同的RGC类型
2、结合scRNA-seq和形态学共同定义RGC类型
利用FISH和IHC技术对视网膜中RGC进行标记和定位,发现不同的视网膜层具有不同的视网膜细胞,例如特异性表达Gpr88和Fam19a4的C10和C24在内丛状层(IPL)的S2和S4中,而表达Slc17a7的C25仅在S5中(图 2A)。
通过scRNA-seq和形态学对视网膜进行双重验证。结果发现aRGC为C41-43、45这4个cluster(图 2B);之前的研究仅确定了4个T-RGC和4个F-RGC类型,但单细胞揭示了每个亚类中的第5种类型(分别为C9和C32;图 2C和2D);同时ipRGC也发现了M1(C33和40)、M2(C31)和 M4(C43)类型的标记(图 2E);ooDSGC中大部分是Cartpt+,通过Mmp17的表达确定了N-ooDSGC;C16表达的Col25a1,是D-和V-ooDSGC的marker。最后CALB1+细胞是D-ooDSGCs ,CALB2高表达细胞是V-ooDSGC(图 2F-2H)。已知RGC子类与cluster存在部分重合,每种cluster不超过两个子类。子类与cluster重合表达的基因如图2J,如:4/5 T-RGCs (Tbr1+)、4/5 F-RGCs (Foxp2+)、5/9 T5-RGCs (Tusc5+)、4/5 ipRGCs(Opn4+)和3/4 aRGC(Spp1+)。另外还鉴定到了新的子类:如8个表达转录因子Neurod2和Satb2的cluster被化为N-RGC等。其余11/45类型未分配到子类,但它们确实表现出与其他类型的相关性。
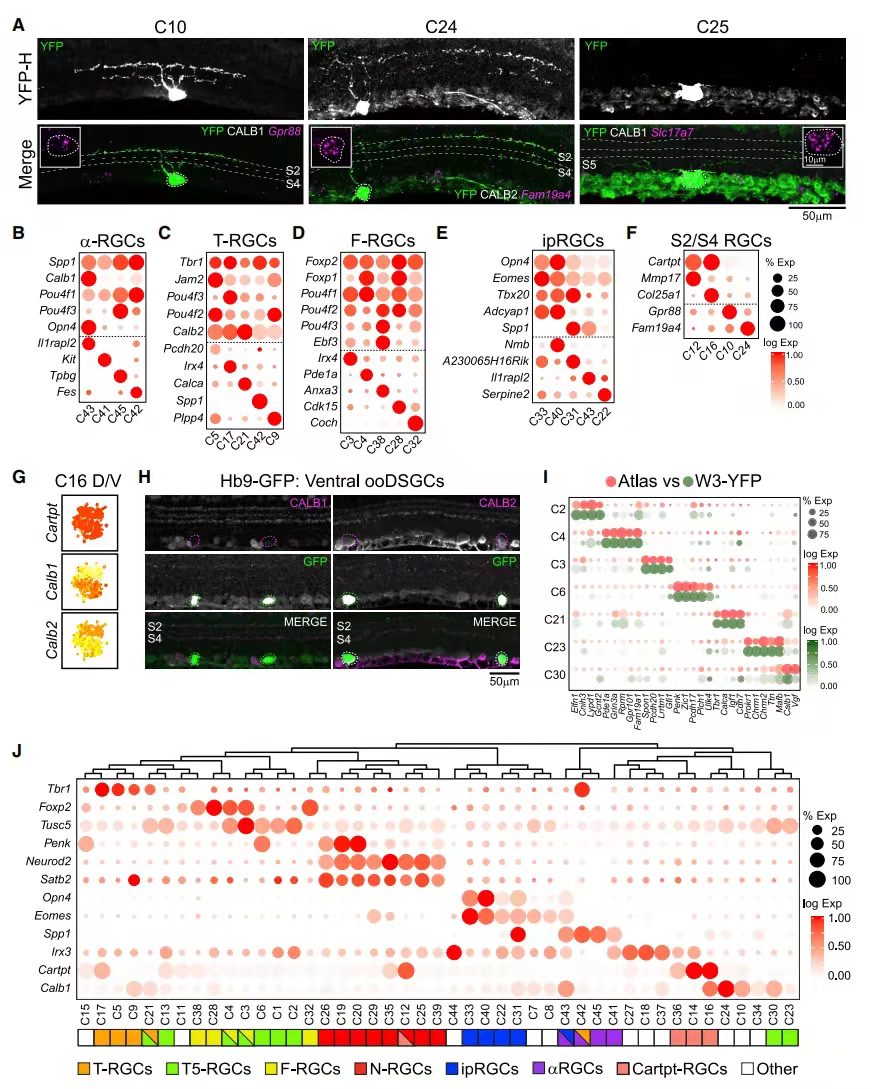
图2 scRNA-seq簇与RGC形态学类型的对应关系
3、不同RGC类型对ONC的敏感性差异很大
以RGC图谱为基础,评估了不同细胞类型对ONC的弹性(图 3A)。在ONC后14天对~8,500个RGC进行分析,此时~80% RGC已经死亡(图 3C),该研究使用iGraphBoost对细胞进行分群(图 3B),iGraphBoost可以将89%损伤的RGC分配到各个cluster中(图 3C)。损伤后第14天所有cluster表达的marker基因同1F(图3D)。与对照相比,将14dpc不同RGC类型的存活率按从高到低排列(图 3E),不同RGC类型在14dpc时表现出不同的存活率,范围从1%到98%不等。比较转录组测序和IHC对细胞活率的结果,结果高度一致(Pearson r = 0.97)(图 3H)。这些数据表明不同RGC对伤害的不同反应。所有ipRGC(Opn4+)都是有弹性的,所有N-RGC类型都是易受影响的(图 3F)。之前被定性为弹性子类的aRGC中,C42,43具有很高的弹性,但C41,45相对容易受到影响(图 3F)。同样,稀有和丰富的类型都可能具有弹性或脆弱性(图 3G)。因此,基因表达或RGC子类都不是判断细胞是否是弹性的完美因子。
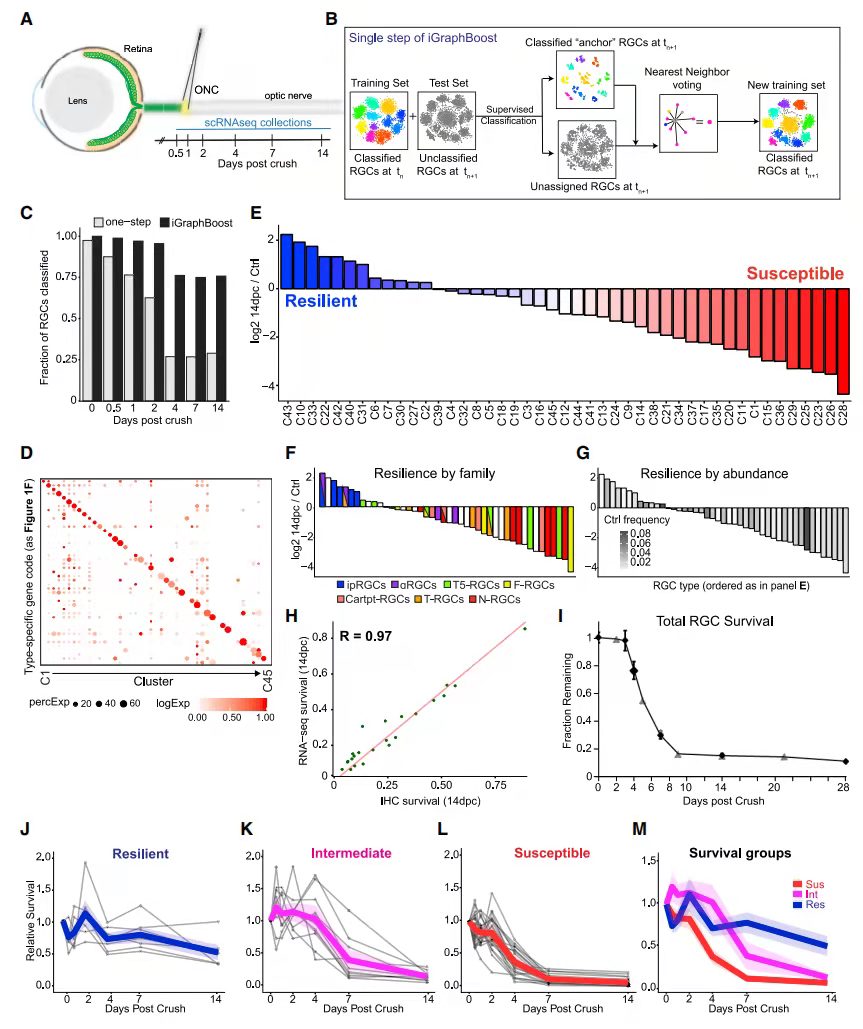
图3 损伤后RGC的scRNA-seq分析
4、损伤后RGC的存活率定义了三个生存组
在ONC后的前3天内,很少有RGC死亡,在接下来的5天内死亡约70%,28dpc时逐渐下降到约10%(图 3I)。根据它们的损失动力学,将RGC类型分为三组:7个cluster是有弹性的类型,在14dpc时达到约50%的存活率;11个cluster是“中间”类型,在4到7dpc之间表现出显著下降;27个cluster是脆弱类型,4dpc时显著减少(图 3J-3M)。因此,中间和脆弱RGC(分别为intRGC和susRGC)的存活率在4dpc时显著不同(susRGC:39%±21%;intRGC:95%±25%)。
5、ONC后的基因表达谱
为了研究RGC中激活损伤反应,对ONC后的RGC进行基因表达谱分析,确定了771个在不同类型之间的DE基因,通过k均值聚类(图 4A)划分为8个模块(Mod1-8),识别具有不同时间动态的基因集,这些基因集富集在不同的GO功能中,例如在0.5dpc开始下降的模块1(Mod1)中的基因富集在健康神经元相关的GO功能中,如动作电位、突触囊泡胞外/内吞作用和逆行轴突运输(图 4B)。相比之下,在Mod5和Mod6中的基因与细胞凋亡和应激途径相关(图 4C)。DE基因几乎没有表现出强烈的类型特异性差异,但ipRGC类型除外,Mod5、6和7中C22、C31、C33和C40中的基因的上调明显低于其他类型(图 4D和4E)。
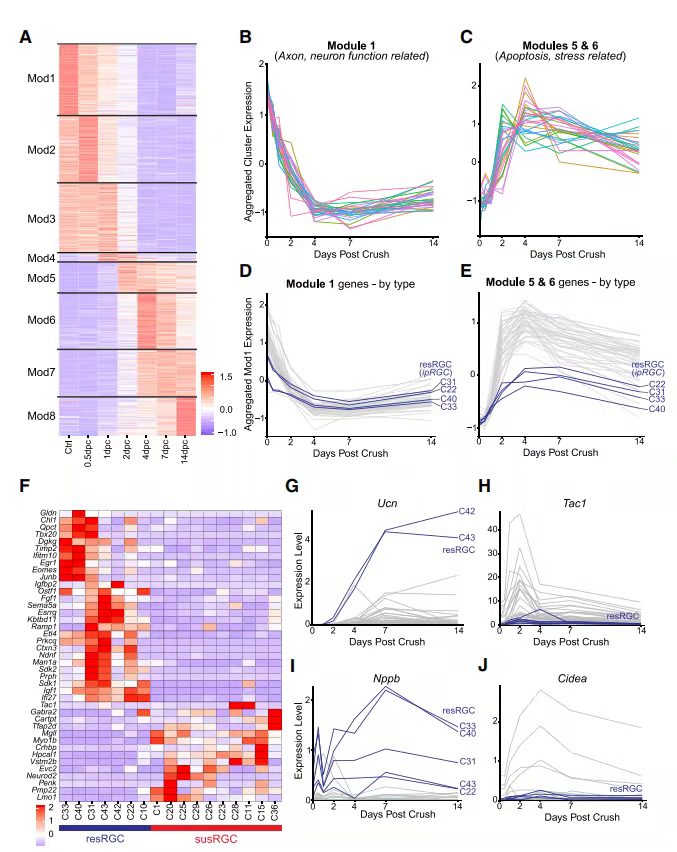
图4 scRNA-seq揭示促进RGC神经保护的衍生候选物
6、单细胞技术确定与神经保护相关的基因
尿皮质素(Ucn),它编码来自促肾上腺皮质激素释放因子家族的肽;促肾上腺皮质激素释放激素结合蛋白(Crhbp)。ONC后Ucn仅在aRGC中上调,而Crhbp在ONC前后susRGC中表达(图 5A和5B)。过表达Ucn,注射Ucn重组蛋白,通过CRISPR和两种不同的sgRNA敲除Crhbp,结果发现四种方式都显著增加RGC的存活率(图 5C和5J)。随后又验证了几对基因的表达和功能富集情况,结果与Ucn和Crhbp类似。说明可以通过对基因的干预来保护部分脆弱的RGC类型。
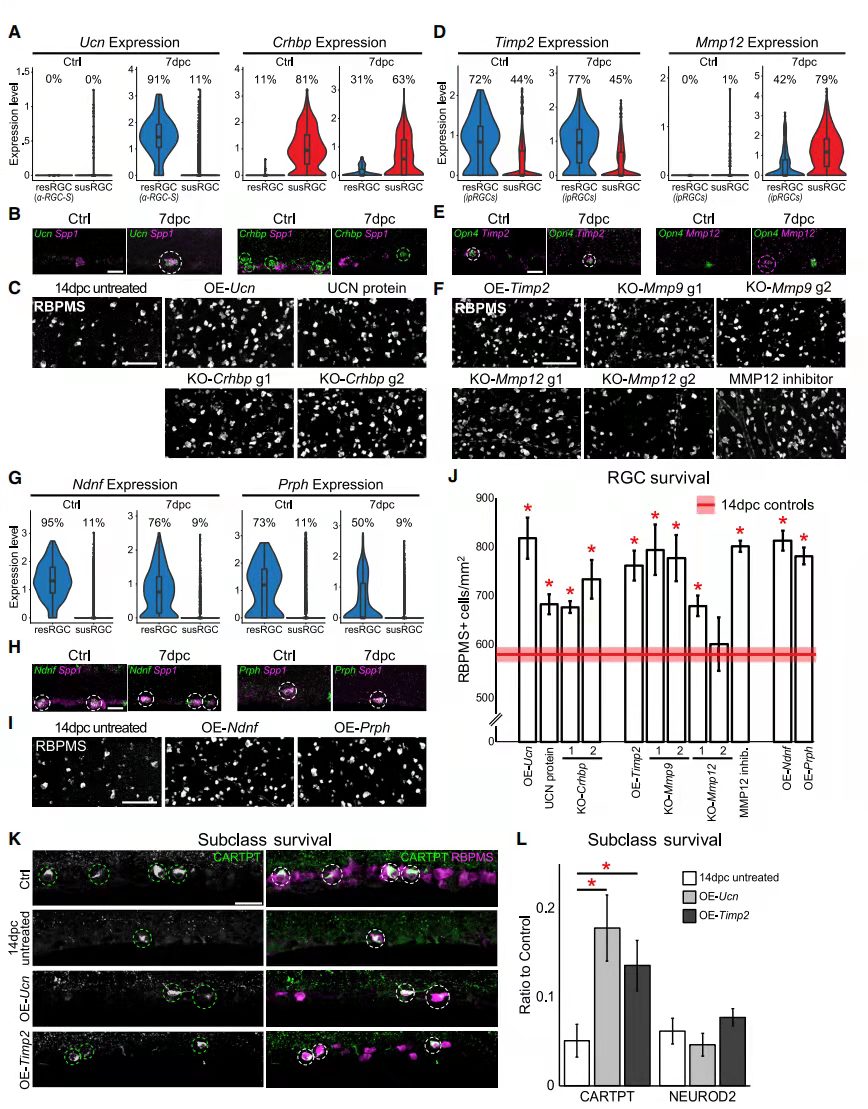
图5 影响RGC生存的基因
总结
该研究分析发现不同类型的视网膜神经节细胞(RGC)对轴突损伤的耐受性不同,一些基因可改善视神经挤压(ONC)后神经元存活和轴突再生。这项研究提供了分析损伤类型特异性反应的实例,并证明了差异基因表达可用于揭示干预的分子靶标,本文方法还可用于鉴定新的神经保护机制。
百迈客单细胞转录组产品介绍
百迈客单细胞转录组测序产品基于10x Genomics系统利用微流体系统和油滴包裹技术,在单细胞水平进行高通量基因表达谱检测,对复杂细胞群深入分析,表征单个细胞的表达谱,避免单个细胞的异质性生物学信息被大量细胞的均质化覆盖。通过单细胞转录组,可鉴定细胞群、细胞亚群、筛选细胞群特有marker基因,并完成对细胞分化轨迹的追踪,从而解析细胞异质性和发育轨迹。








 京公网安备 11011302003368号
京公网安备 11011302003368号