近年来,各种组学研究产品层出不穷,助力科学研究的蓬勃发展,然而,当您面对大量积累的高通量测序大数据的时候,是不是也会满脸愁容?因为没有服务器,我们无法随时随地的分析自己的数据?想多次测试删除样本、变换分组、联合分析?想做个性化数据分析,但公司收费昂贵?想学生物信息学分析,但没有免费的课程?百迈客生物云平台为您“量身定做”,只为科研提效。云平台支持测序数据+公共数据双类型分析,简单几步即可完成任务投递,更有丰富的个性化分析和小工具辅助数据深度挖掘,不需要自主搭建分析平台投入的人力、财力及硬软件设施,只需要一台电脑,即可玩转组学数据。
使用百迈客云平台优势在于:
1. 45款研究APP,原始数据简单几步完成任务投递,即可得标准分析结题报告,15+个性化分析模板和上100款小工具辅助深度数据挖掘,交互的个性化分析让数据分析更简单。
2. 8大数据库,轻松引用。
3. 百迈客云课程,教您如何分析数据,让生信分析更简单。
4. 完善的售后服务系统:百迈客配备了完善的售后服务系统,包括专业售后技术团队,智能科研助手Prof.X、在线直播交流等。涉及您的全部售后问题,项目分析再无后顾之忧。

下面给大家分享一篇2021年12月在线发表的转录组+百迈客云平台产出的文章,希望给您的科研减压。
中文题目:转录组和脂质组学联合分析揭示小麦蜡质调控机制
英文题目:Analysis of Wheat Wax Regulation Mechanism by Liposome and Transcriptome
期刊:frontiers in Genetics
影响因子:IF 4.599
研究背景介绍
表皮蜡作为植物的第一道屏障,在抵抗生物和非生物胁迫方面发挥着重要作用,它可以限制非气孔水分的损失,提高植物的抗旱性,帮助植物减少机械损伤、植物病虫害,保护植物免受高温和强紫外线辐射。表皮蜡是由超长链脂肪酸(VLCFA)及其衍生物组成的复杂脂质混合物。现有研究表明,表皮蜡的生物合成始于质体表皮细胞外膜上由超长链脂肪酸C16或C18转化的蜡质前驱体,然后长链脂肪酸通过酰基还原和脱羰基化合成不同的蜡状化合物。在拟南芥和水稻中发现了许多参与蜡合成和调控的基因,如拟南芥中的转录因子WIN1/SHN1上调表皮蜡合成基因CER1、CER2、CER4、KCS、CYP86A7、CYP86A4、GPAT4、LACS2和HTH的表达,以诱导表皮蜡积累,在小麦中,由于基因组信息量巨大,对小麦表皮蜡生物合成的分子调控机制研究较少。为了研究小麦表皮蜡的调控机制,本研究以甲基磺酸乙酯(EMS)诱变22号冀麦获得的低蜡突变体和多蜡突变体为材料,通过对非靶向脂质组学和转录组的相互验证和联合分析,确定了小麦表皮蜡的主要成分,并挖掘出与表皮蜡代谢相关的新基因。
实验方法与材料
材料:EMS诱变22号高产品种冀麦,分离出蜡质(waxy)和无蜡质突变体(waxyless),种植至抽穗期取叶片组织。
测序策略:转录组测序用Illumina测序平台,非靶向脂质组采用液相色谱-串联质谱(LC-MS)检测,每组3个生物学重复。
分析策略:百迈客云平台真核有参转录组APP,测序数据一键式投递,云上个性化协助分析。

主要研究结果
1. 本研究对冀麦22号低蜡突变体和多蜡突变体的叶表皮蜡进行了非靶向脂质体检测和转录组分析。共鉴定出31个脂类亚类和1,367个脂类分子。
2. 小麦叶蜡的主要脂质成分为WE 、DG 、TG、MG和OAHFA 。DG, MG, OAH FA首次在小麦叶片表皮蜡质中进行了研究。
3. 与蜡质突变体相比,无蜡质突变体共检测到6840个DEGs,其中上调3181个DEGs,下调3659个DEGs。
4. 根据KEGG代谢途径构建小麦表皮主要蜡质组分的代谢模式,筛选出KSC、TER、FAR、WSDCER1、MAH1、ALDH7A1、CYP704B1、ACOT1_2_4、CYP86等46个相关基因。
主要研究内容
一、叶表皮脂质成分的鉴定与分析
通过UPLC分析,在两个突变体的叶表皮中鉴定出31个脂质亚类和1367个脂质分子(图1A)。具有大量脂质种类的脂质为三酰甘油(TG)、神经酰胺(Cer)、二酰甘油(DG)、蜡酯(WE)、(O-酰基)-1-羟基脂肪酸(OAHFA)、单半乳糖基二酰甘油(MGDG)、磷脂酰乙醇胺(PE)、磷脂酰甘油(PG)、胆固醇(ChE)、心磷脂(CL)、磷脂酰肌醇(PI),磷脂酰丝氨酸(PS)。其中,TG、Cer、DG、WE和OAHFA占分子总数的83%(图1B)。此外,还发现小麦叶表皮的主要脂质成分为TG、Cer、DG、WE和OAHFA。
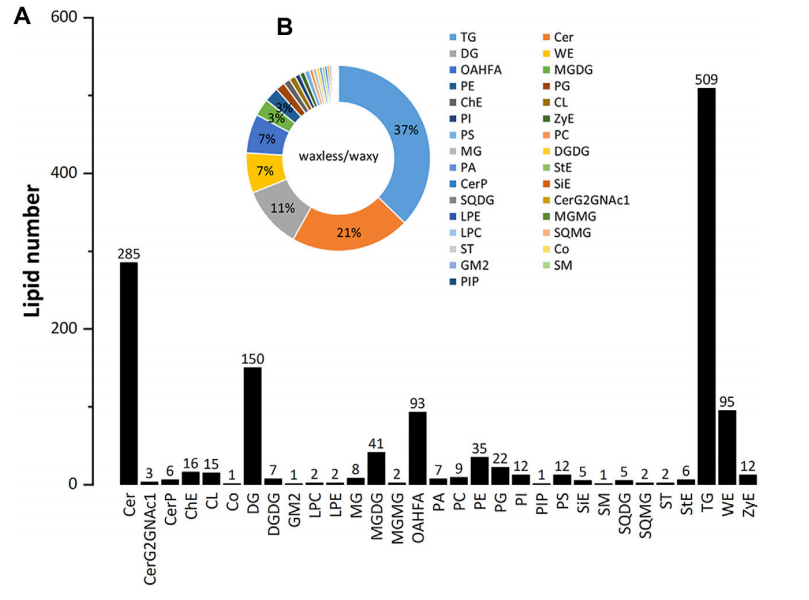
图1.小麦叶片脂质亚类数量统计图
二、叶表皮蜡相关脂质亚类的分析
通过比较抽穗期低蜡突变体和多蜡突变体的类脂亚类含量,筛选出类脂含量的显著差异。在两个突变体之间有11种脂类物质存在显著差异(VIP>1,p<0.05)。在低蜡突变体中,有六个高脂含量的脂质亚类,即Cer、ZyE、PE、MGDG、CL和二半乳糖基二酰甘油(DGDG)。另一方面,在多蜡突变体中,发现五种脂质类别为DG、ChE、OAHFA、WE和单酰甘油(MG)(VIP>1,p<0.05)。我们推断,与无蜡小麦相比,蜡质小麦具有更丰富和不同的脂质作为小麦表皮蜡的主要成分。也就是说,抽穗期小麦叶表皮的主要脂质成分是DG、ChE、OAHFA、WE和MG。
三、差异表达基因分析
通过对抽穗期低蜡突变体和多蜡突变体叶片转录组的分析,不同生物重复样本之间的相关系数为0.890 ~ 0.926(图2A)。与蜡质突变体相比,无蜡突变体共检测到6840个DEGs,其中3181个基因上调,3659个基因下调(Fold Change≥2,FDR <0.01)(图2B)。对低蜡突变体和多蜡突变体的基因进行了GO富集分析,发现生物过程中主要富集在代谢过程(28.89%)、细胞过程(24.73%)、单生物过程(14.96%)、生物
节(8.35%)和刺激反应(6.46%)。这些基因主要分布在膜、膜部分、细胞、组成细胞部分和细胞器中。
此外,我们注释了3659个DGE的脂质功能,筛选了343个DGE,并使用KEGG富集分析对其进行富集(图2C,D)。研究发现,这些基因主要集中在甘油磷脂代谢、角质层、亚油酸和蜡的生物合成、甘油脂代谢、鞘脂代谢、萜类主干生物合成、脂肪酸降解和脂肪酸伸长途径中,这与该研究中控制小麦叶片光泽表型的主要脂质组分一致。
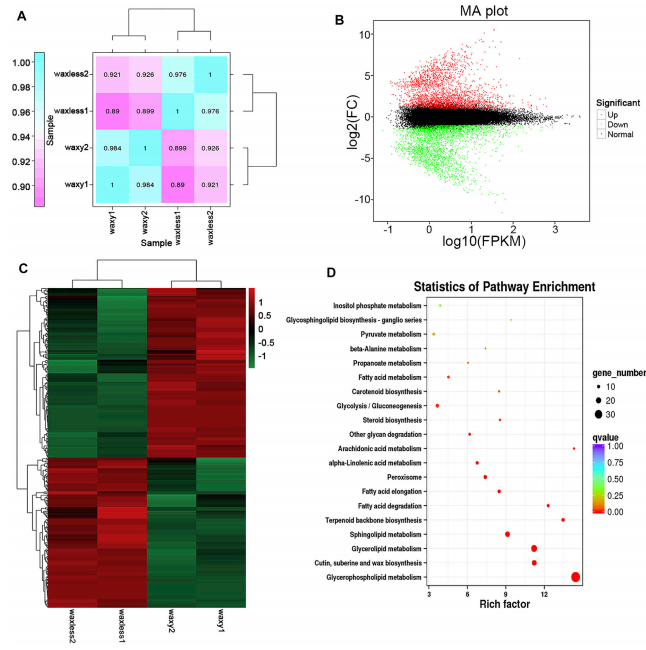
图2 转录组数据分析
四、蜡质和差异表达基因的联合分析
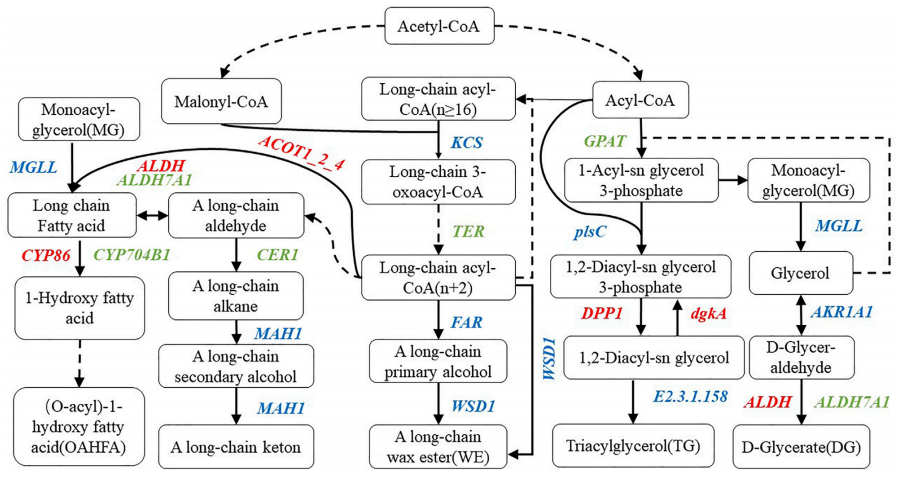
结合脂质组分鉴定结果,在相应的途径上标记注释基因,根据KEGG代谢途径构建小麦表皮主要脂质组分的代谢模型(图3),并筛选出46个相关基因。此外,与多蜡突变体相比,低蜡突变体中注释到蜡酯合成(WE)的基因为3-酮酰基-CoA合酶基因(KCS),极长链烯醇基辅酶A还原酶基因(TER)、醇形成脂肪酰辅酶A还原酶基因(FAR)、蜡酯合酶基因(WSD1)、醛脱羧酶基因(CER1)和中链烷烃羟化酶基因(MAH1)。TER的下调抑制长链3氧酰基辅酶A向长链酰基辅酶A(N2)的转化,CER1的下调抑制上游长链醛向长链烷烃的转化,KCS、FAR、WSD1和MAH1相关的表达基因均上调和下调。
在OAHFA合成过程中,酰基辅酶A硫代酯酶1/2/4基因(ACOT1_2_4)的上调表达促进长链脂肪酸的合成,而酰基甘油脂肪酶基因(MGLL)的表达水平在单酰基甘油转化为长链脂肪酸的过程中上调和下调。醛脱氢酶家族7个成员A1基因(ALDH7A1)表达下调抑制了A长链醛与长链脂肪酸之间的过渡,醛脱氢酶基因(ALDH)则上调了A长链醛与长链脂肪酸之间的过渡。在长链脂肪酸转化为ω-羟基脂肪酸的过程中,长链脂肪酸ω-单加氧酶基因(CYP704B1)的表达下调,而突变无蜡脂肪酸ω-羟化酶基因(CYP86)的表达上调。甘油-3磷酸酰基转移酶基因(GPAT)和ALDH7A1在DG、MG和TG的甘油酯代谢过程中下调。在无蜡情况下,葡萄糖的表达下调抑制了1-酰基-sn甘油3-磷酸的合成,从而减少了镁的合成。ALDH7A1在低蜡突变体中的下调表达降低了DG的合成。上调基因为ALDH、二酰甘油二磷酸磷酸酶基因(DPP1)和二酰甘油激酶基因(dgkA),而1-酰基-SN-甘油-3-磷酸酰基转移酶基因(plsC)的表达为磷脂:酰甘油酰基转移酶基因(E2.3.1.158)、MGLL和酒精脱氢酶基因(AKR1AI)均上调和下调。这些基因共同作用降低低蜡突变无蜡细胞中TG的含量。








 京公网安备 11011302003368号
京公网安备 11011302003368号