单细胞多组学已经广泛应用于肿瘤研究,但是单细胞技术在肿瘤治疗前后取材,特别是治疗后很多临床样本无法精准取到相应靶组织,今天给大家推荐的一篇文章,可以给我们带来单细胞技术在三阴性乳腺癌单抗免疫治疗以及单抗联合紫杉醇化疗的应用,全面揭示在三阴性乳腺癌(TNBC)中,联合化疗和检查点抑制剂(免疫检查点阻断ICB)单细胞水平的机制,以及取材指导。
百迈客提供全面的单细胞空间转录组系列检测服务,包括单细胞(核)转录组、空间转录组、单细胞免疫组库、单细胞ATAC-seq、单细胞ATAC&GEX、单细胞全长转录组,年底活动更是优惠多多,详情可见:享年末,抄底价,丰富好礼超乎你想象!

英文题目:Single-cell analyses reveal key immune cell subsets associated with response to PD-L1 blockade in triple-negative breast cancer
发表杂志:Cancer Cell
影响因子:31.7
发表日期:20211013
发表单位:中国医学科学院肿瘤医院 北京大学生物医学前沿创新中心
研究背景
免疫检查点封锁(ICB)靶向免疫调节通路,如PD -1/ PD-L1信号通路,在部分癌症患者中实现了硬脑膜反应,尽管有了很好的临床进展,但ICB耐药的基本机制仍不清楚。单细胞技术的发展使全面表征肿瘤浸润免疫细胞的基本特性成为可能,在肿瘤微环境(TME)中已经鉴定出广泛的T细胞亚群。
三阴性乳腺癌(TNBC)是一种侵袭性乳腺癌(BC)亚型,治疗选择有限。尽管ICB在TNBC治疗中显示出了希望,但临床研究观察到了适度的反应,促进了ICB联合化疗的探索。在三阴性乳腺癌(TNBC)中,联合化疗和检查点抑制剂(免疫检查点阻断ICB)的好处还不是很清楚。尽管ICB在TNBC治疗中显示出希望,但临床研究观察到保守的反应促进了ICB联合化疗的探索。
2021年10月14日,中国医学科学院肿瘤医院联合北京大学生物医学前沿创新中心在国际期刊Cancer Cell上在线发表了题为“Single-cell analyses reveal key immune cell subsets associated with response to PD-L1 blockade in triple negative breast cancer”的研究论文,该团队结合单细胞RNA- seq、TCR-seq和ATAC-seq等技术,研究紫杉醇(paclitaxel,化疗)联合anti-PD-L1抗体阿替利珠单抗(atezolizumab 免疫治疗)治疗TNBC(三阴性乳腺癌)患者肿瘤微环境和外周血中的免疫细胞动力学,揭示应答者和无应答者的免疫特征,紫杉醇化疗联合阿替利珠单抗免疫治疗在TNBC治疗中的机制和相互作用。
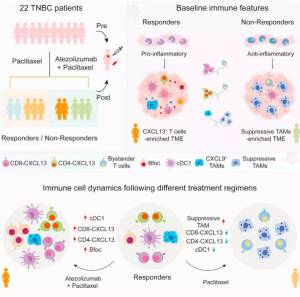
图1. 文章思路和结论导图
研究方法
在该课题的研究人员收集了来自22例TNBC患者(11例接受阿替利珠单抗联合紫杉醇化疗,11例接受紫杉醇单药化疗)治疗前和治疗后的78例配对样本,通过整合单细胞转录组测序、T细胞受体序列测序和染色质可及性测序,构建了TNBC患者肿瘤微环境和外周血来源免疫细胞的高分辨率转录组和表观组动态图谱。该研究在单细胞水平上对来自接受两种治疗方案的TNBC病人的肿瘤组织和外周血的免疫细胞动态分析,系统比较了应答患者和非应答患者的肿瘤微环境及外周血免疫特征,阐明了免疫细胞在不同治疗方案下的动态变化,揭示了anti-PD-L1免疫治疗联合紫杉醇化疗在TNBC中的作用机制。
研究结论
● 在抗PD- L1免疫治疗后TNBC中发现动态免疫细胞改变;
● CD8-CXCL13和CD4-CXCL13 T细胞预测PD-L1阻断有效反应;
● 表达CXCL9的促炎巨噬细胞与CXCL13+T细胞相关;
● 紫杉醇损害由阿特珠单抗引起的应答免疫细胞的扩张;
● 突出了CXCL13+T细胞在有效应对抗PD-L1疗法方面的重要性,并表明通过紫杉醇疗法减少这些细胞可能会损害伴随阿特珠单抗 (Atezolizumab)进行TNBC治疗的临床结果。
实验材料
材料:22例TNBC患者(11例接受阿替利珠单抗联合紫杉醇化疗,11例接受紫杉醇单药化疗),一共78例样本:治疗前15例组织样本、21例血液样本;治疗后13例组织样本、20例血液样本;治疗进展期2例组织,7例血液样本。
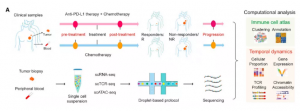
图2. 实验材料与方法
方法:scRNA-seq(10x Genomics)、scTCR-seq、scATAC-seq等
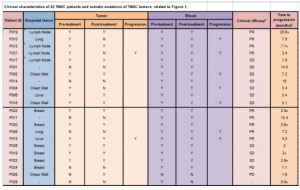 图3. 实验患者取材以及预后信息
图3. 实验患者取材以及预后信息
本研究通过两种治疗手段(阿替利珠单抗联合紫杉醇化疗,紫杉醇化疗),在基线、治疗开始后4周和疾病进展时共采集了78例肿瘤活检和血液样本。经过高质量的筛选,共获得了489,490个高质量免疫细胞的单细胞转录组数据,包括髓系细胞、固有淋巴细胞、T细胞和B细胞。
研究结果
1. 晚期TNBC患者的免疫细胞动力学
本研究纳入了22例晚期TNBC患者,其中一半采用紫杉醇单药治疗,另一半采用紫杉醇加阿替利珠单抗作为一线治疗。根据有无乳房肿瘤或转移性肿瘤进行收集样本。肿瘤浸润淋巴细胞(TILs)和PD-L1已经在紫杉醇加atezolizumab治疗的肿瘤中进行了评估,因为它们在预测免疫治疗反应方面很重要。尽管有反应者表现出较高水平的TILs和PD-L1,但并非所有具有这些特征的患者对抗PD-L1治疗均有反应。作者团队利用单细胞测序技术来表征具有不同临床表现的TNBC患者的免疫特征和动力学,在基线、治疗开始后4周和疾病进展时,共采集78例肿瘤活检和血样。对活检样本进行外显子组测序,发现它们的基因组与癌症基因组图谱(TCGA)中常见的人类乳腺肿瘤基因一致。经过质量筛选,获得了489,490个高质量免疫细胞的单细胞转录组数据,包括髓系细胞、先天淋巴样细胞(ILCs)、T细胞和B细胞。有趣的是,B细胞主要富集于有反应性的肿瘤中,而髓细胞富集于联合治疗组无反应性的肿瘤中。治疗后主要免疫细胞类型的动态变化,在两组有效治疗反应中B细胞减少,T细胞增加。
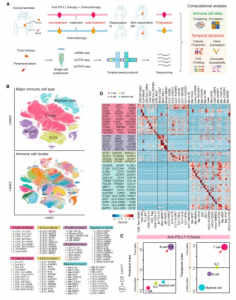 图4. 晚期TNBC患者不同治疗方案的免疫细胞动力学
图4. 晚期TNBC患者不同治疗方案的免疫细胞动力学
基于Pi分析,发现B细胞是最显著的免疫细胞类型,可以预测对两种治疗方案的良好反应,这与最近关于B细胞对ICB反应的预测作用的发现相一致。在Ti分析中,与化疗相比,T细胞在联合治疗中明显表现出Ti阳性,这表明阿特珠单抗可能通过提高T细胞水平来促进有效反应。
建立了两个指标,预测指数(Pi)和治疗指数(Ti),以系统地研究不同的免疫细胞类型与临床反应的关系。Pi测量基线细胞比例与肿瘤大小变化之间的相关性,Ti测量细胞比例动态与肿瘤大小变化之间的相关性。Pi或Ti的阳性代表较高的基线水平或相应免疫细胞亚型细胞比例的增加与治疗后肿瘤大小的降低水平较高相关,从而分别预测或介导良好的反应。阴性Pi或阴性Ti分别表示相应的免疫细胞亚型预测或介导不利反应。基于Pi分析和在Ti分析中显示,发现B细胞是最显著的免疫细胞类型,可以预测对两种治疗方案的良好反应。
2. CD8-CXCL13和CD4-CXCL13在联合治疗的TNBC肿瘤中扩增
上述分析表明,T细胞可能在PD-L1阻断治疗中发挥中心作用。基于在 TNBC 肿瘤中的高分辨率 T 细胞图谱,确定了两个高表达PDCD1和CXCL13 的T 细胞簇(CD8-CXCL13、CD4-CXCL13);三个 T 细胞群,包括幼稚 (Tn)、活化 (Tact) 和增殖 (Tprf) 亚群,其中包含 CD8 + 和 CD4 +T 细胞;和几个典型的 CD8+ 或 CD4+T 细胞簇,包括调节性 (Treg)、中央记忆 (Tcm)、效应器 (Teff)、效应器记忆 (Tem)、组织驻留记忆 (Trm) 和粘膜相关不变 T (MAIT) ) 细胞子集。除了富含淋巴结 (LN) 的 Tn 和富含肝脏转移部位的 MAIT外,这些 T 细胞亚群没有表现出特别的组织偏好。值得注意的是,CD8-CXCL13 表达TIGIT、CTLA4和LAG3 的T 细胞耗竭相关基因,类似于之前研究中鉴定的 CD8-LAYN,而 CD4-CXCL13 不仅通过表达BHLHE40、TOX2和CXCR5表现出 1 型辅助性 T (Th1) 细胞和滤泡辅助性 ( Tfh ) 细胞的特征,但也表达了耗竭标记。CD8-CXCL13 和 CD4-CXCL13 的耗竭特征暗示了它们的肿瘤反应性,因为之前的研究表明,肿瘤反应性 T 细胞由于持续的肿瘤抗原刺激而表现出耗竭表型。此外,这两个亚群连同T 调节细胞(Treg),基于匹配的 T 细胞受体 (TCR) 数据显示出显着的克隆扩增,进一步表明它们的抗原特异性。
为了破译治疗后的免疫细胞动力学,本文首先研究了紫杉醇对不同 T 细胞亚群的调节。与无反应者相比,有反应者表现出 CD8-CXCL13、CD4-CXCL13 和 Tregs 水平降低,伴随着紫杉醇治疗后 CD8 + Tem、Teff 和 CD4 + Tcm 细胞水平升高。有趣的是,CD8-CXCL13 和 CD4-CXCL13 在紫杉醇联合阿替利珠单抗治疗后有反应的患者中均扩增,导致联合治疗组中它们的分数高于治疗后单独紫杉醇。类似地,Ti分析还显示在应答患者中,CD8-CXCL13和CD4-CXCL13细胞群联合治疗后出现克隆型扩增,在应答患者中紫杉醇治疗后减少。这些观察结果暗示了 CXCL13 +T 细胞与 PD-L1 阻断的相关性。进一步利用单细胞免疫组库测序(scTCR-seq)追踪对联合治疗有反应的肿瘤中CXCL13 +T细胞的谱系起源,发现它们的扩增既包含已存在的克隆,也包含新浸润的克隆。事实上,考虑克隆TCRs(克隆大小≥2)时,已有克隆的数量大于新渗透克隆。因此,在治疗后,大量已经存在的克隆有助于CXCL13 +T细胞的扩增。在BC小鼠模型中,ICB治疗后CD8 + PD-1 + LAG3 +T细胞增加,进一步证实了CD8- CXCL13与ICB治疗的相关性。此外,也通过人基底细胞癌(BCC)的单细胞数据验证,显示ICB治疗后CD8 + 耗尽T (Tex)细胞增加。
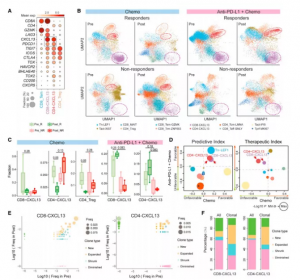 图5. 肿瘤浸润性 T 细胞亚群的时间动态
图5. 肿瘤浸润性 T 细胞亚群的时间动态
3. CXCL13 +T细胞和相关的 B 细胞预测对抗 PD-L1 免疫疗法的有利反应
与对联合治疗耐药的患者相比,有反应的患者表现出更高水平的基线 CD8-CXCL13 和 CD4-CXCL13,这意味着 CXCL13+T 细胞在塑造抗 PD-L1 治疗的临床结果中的重要性.。Pi 分析还表明,更高水平的 CXCL13 +T细胞可以预测对联合治疗的更好反应。除了 CXCL13+T 细胞,Tn-LEF1 尽管在 LN 中具有特定的富集,但也与对两种治疗方案的良好反应有关。基于 TCGA 的分析表明,乳腺肿瘤的浸润性 CD8+ CXCL13 +T 细胞高于黑色素瘤和肺肿瘤,这与 BC 对 ICB 的响应率较低。通过多色免疫组织化学 (IHC) 染色进一步证实了 CD8-CXCL13 和 CD4-CXCL13 T 细胞在对联合治疗有反应的肿瘤中的存在。
TNBC 肿瘤中的 B 细胞包括两个主要亚群,CD19 + B 和血浆 B (pB) 细胞,并且在联合治疗组中观察到的反应者基线 CD19 + B 细胞水平高于无反应者。CD19 +B 细胞高度表达CXCR5,CXCL13 ( BCA-1 )的受体,表明它们与 CXCL13 + T 细胞的潜在联系。事实上,作者观察到 CD19 + T NBC 肿瘤中对紫杉醇加阿特珠单抗有反应的 B 细胞与 CD8-CXCL13 和 CD4-CXCL13 T 细胞。此外,还发现在人 BCC 中进行 ICB 治疗后,CD19+ B 细胞与 CD8 + Tex 细胞在反应性患者中共同扩增。此外,与CD8 + CXCL13 +T细胞稀少的TCGA BRCA肿瘤相比,B细胞marker基因CD79A和CD19 以及CXCR5在含有大量 CD8 + CXCL13+T细胞的TCGA BRCA 肿瘤中高表达。通过比较应答性和非应答性肿瘤中B细胞的转录组差异,发现应答性肿瘤中富含高表达基因的B细胞参与了抗原处理和递呈、干扰素(IFN)-g应答和T细胞激活的通路。相比之下,在无应答的肿瘤高表达基因中富集的B细胞参与了B细胞激活、免疫球蛋白的产生和体液免疫应答的通路。因此,B细胞在抗肿瘤免疫中的作用可能主要是激活CXCL13 +T细胞。
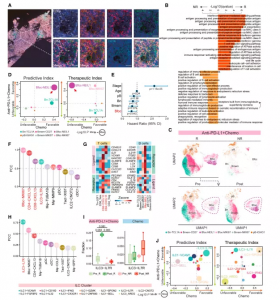 图6. TNBC肿瘤中B细胞亚群的特点和动态变化
图6. TNBC肿瘤中B细胞亚群的特点和动态变化
4. 联合治疗后,Bfoc和LTi细胞在TNBC肿瘤中一致扩增
研究发现 CD19 + B 细胞包含未显示特定组织富集的幼稚 B (Bn)、记忆 B (Bmem)、Bfoc、增殖 Bmem 和增殖 Bfoc 亚群的异质亚群。值得注意的是,Bn,Bmem和Bfoc细胞主要富集在响应于紫杉醇联合阿替利珠单抗但不是在肿瘤响应于紫杉醇。
Bfoc 细胞的特征在于MEF2B、BCL6、RGS13和NEIL1的高表达。在两个治疗组中,响应者的基线 Bfoc 水平明显高于无响应者, Pi 分析还显示了 Bfoc 与有利的临床反应之间的联系。对于 B 细胞动力学,发现在接受紫杉醇治疗的应答者中 Bfoc 降低,但在接受紫杉醇加 atezolizumab 治疗的应答者中增加,表明 Bfoc 细胞与 阿替利珠单抗治疗的相关性。重要的是,表征了不同B 细胞亚群的预后意义,并揭示了 Bfoc 是与 BRCA TCGA 患者的有利临床结果相关的最重要的 B 细胞亚型。因此,Bfoc 似乎是对患者存活和 ICB 免疫治疗最重要的 B 细胞亚群。
Bfoc 与其他免疫细胞的联系(细胞通讯描绘细胞互作关系)。通过描绘相关的免疫细胞亚型,发现 CD4-CXCL13 和 CD8-CXCL13 与 Bfoc 的细胞比例表现出高度相关性,尤其是在后处理组中。这种联系表明 Bfoc 可能与 CXCL13+T细胞相互作用,在抗肿瘤免疫中发挥作用。通过细胞通讯分析(基于配体-受体对),发现CXCR5在 Bfoc 子集中表现出最高的表达水平,包括 CD40LG-CD40、白细胞介素 (IL)21-IL21R 和 IL6ST-EBI3 在内的多个对可能介导 Bfoc 和 CD4- CXCL13。有趣的是,以CCR7、IL7R、GPR183、LTB(淋巴毒素)和IL23R表达为特征的 LTi 样 ILC3(ILC3-IL7R)也与 Bfoc 高度相关,并在联合治疗后与 Bfoc 协同扩增,但在化疗后没有。值得注意的是,ILC3-IL7R 可以预测对两种治疗方案的有利反应,表明其在有效抗肿瘤免疫中的潜在作用。
5. 联合治疗后,TNBC肿瘤中cDC1(树突状细胞)扩增
CXCL13 +T 细胞在抗 PD-L1 治疗中的重要性促使我们研究它们如何在某些 TNBC 患者中被激活和富集。由于TME 中的髓系细胞可以潜在地调节 T 细胞反应,接下来关注 TNBC 肿瘤中的髓系细胞。在这些主要亚群中,观察到在基线和联合治疗而非化疗治疗后,应答者的 DCs 水平高于无应答者,支持他们在 ICB 治疗中的作用。为了确定 TNBC 肿瘤中 DC 的特定亚群,进行了无监督聚类并基于它们的特征基因确定了以CCR7、LAMP3、CCL19、IDO1和PD-L1为特征的浆细胞样 DC(pDC)、cDC1、成熟 DC(mDC 或 LAMP3 + DC),和三个常规 DC2 (cDC2) 子集,包括朗格汉斯细胞(LCs, cDC2-CD207)、促炎和抗炎 cDC2 (cDC2-CLEC10A, cDC2-FCGR2B)。较高水平的基线 cDC1 和 pDC 可能表明对紫杉醇的反应良好,但这些 DC 亚群都不能表明对联合治疗的有利反应,这可能暗示 DC 亚群不是有效抗 PD-L1 治疗的关键决定因素。
RNA 速度分析,cDC1 和促炎 cDC2 都可以转化为 mDC,与人类肝癌和肺癌的发现一致,由于它们的转录相似性,mDC 与 TNBC 肿瘤中的 cDC1 紧密相连以及细胞比例的相关动态变化。对于接受紫杉醇加阿特珠单抗治疗的患者,还观察到,与 cDC1 和 pDC 的增加相反,治疗后应答者的 mDC 下降,这可能是由于紫杉醇方案选择性减少了 mDC。重要的是,与单独使用紫杉醇相比,在使用紫杉醇联合阿特珠单抗治疗后有反应的患者中发现了更高水平的 cDC1、mDC 和 pDC,表明他们参与了抗 PD-L1 治疗。Ti 分析进一步显示 cDC1 和 pDC 与对联合治疗的有利反应有关,但与化疗无关。值得注意的是,当也使用阿特珠单抗时,紫杉醇治疗后 mDC 的减少受到抑制,表明其与 PD-L1 阻断相关。mDC 和 cDC1 都表现出与 CD4-CXCL13 协调的时间动态,结果暗示 CD4-CXCL13 和 CD8-CXCL13 可能都被 cDC1 或 mDC 激活,正如最近的研究所暗示的那样,同源 CD4 + T 细胞许可 cDC1 诱导 CD8 +T 细胞免疫。
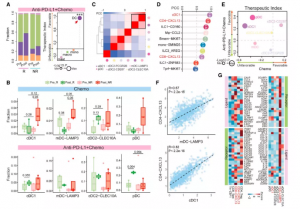 图7. TNBC肿瘤中树突状细胞的时间动态
图7. TNBC肿瘤中树突状细胞的时间动态
6. 巨噬细胞的表型与 T 细胞状态有关
与联合治疗组中的反应者相比,无反应者表现出更高的巨噬细胞 (Mφ) 基线水平,并且富含无反应者的巨噬细胞高度表达SPP1、TREM2、FN1和C3,而富含应答者中高度表达CXCL9,MMP9,和PLA2G2D,表现出不同的特征模式。研究已表明TREM2和SPP1已被证明在抗炎肿瘤相关巨噬细胞 (TAM) 中表达,实验发现单核细胞亚群高表达FCN1、S100A8和S100A9,而巨噬细胞亚群高表达CD68、APOE和 C1Q,类似于 TAM 的特征,TNBC 肿瘤中的巨噬细胞亚群倾向于共表达经典的 M1 和 M2 特征,与最近在人类乳腺癌和肺癌中的发现一致。两个巨噬细胞亚群,MΦ-CCL2和MΦ-MMP9,以及mDC和其他DC亚型,都是排名最高的免疫亚型,表明它们与CXCL13 +T细胞相关。Mφ-MMP9 子集高度表达PLA2G2D、IL2RG和CXCL9,而 Mφ-CCL2 高度表达CXCL9、CXCL10和CXCL11,其中CXCL9 和 CXCL10 是已知介导 T 细胞募集的趋化因子,它们在 Mφ-MMP9 和 Mφ-CCL2 中的高表达支持这两个巨噬细胞亚群的促炎特性。
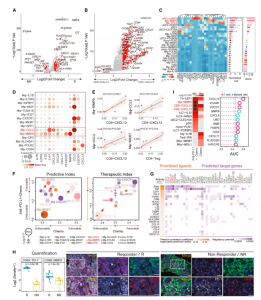 图8. TNBC肿瘤中巨噬细胞亚群与CXCL13 +T细胞的联系
图8. TNBC肿瘤中巨噬细胞亚群与CXCL13 +T细胞的联系
除了上述基于转录组的分析外,还检查了免疫细胞比例,发现 Mφ-CCL2 和 Mφ-MMP9 也与CXCL13 +T细胞高度相关,表明巨噬细胞的促炎表型可能是由 TME 中的主动抗肿瘤免疫反应塑造的,Mφ-MMP9 和 CD8-CXCL13 在对紫杉醇加阿替利珠单抗有反应的肿瘤中同时富集。与 Mφ-CCL2 和 Mφ-MMP9 相比,Mφ-MKI67、Mφ-SLC40A1 和 Mφ-MGP 的基线水平与 Tregs 呈正相关,而 Mφ-CX3CR1、Mφ-TUBA1B 和 Mφ-FOLR2 与 Treg 呈负相关。发现紫杉醇方案选择性地减少了Mφ-CCL2和Mφ-MMP9的促炎巨噬细胞,但增加了反应性患者的免疫抑制巨噬细胞,而atezolizumab似乎对巨噬细胞亚群影响不大。这些发现表明紫杉醇可能具有免疫抑制性 TME。
发现血液中较高水平的骨髓细胞(其中单核细胞主要占主导地位)可以预测对两种治疗方案的有利反应。血液中的单核细胞似乎可以部分反映 TME 的免疫特征,值得注意的是,没有在血液中检测到 cDC1,而是观察到在反应性肿瘤中联合治疗后 cDC2 的增加。
7. CD8-CXCL13在抗pd – l1治疗后细胞毒性增强
考虑到 CXCL13 + T 细胞在抗 PD-L1 治疗中的重要性,接下来检查了它们的治疗诱导的转录动力学。基于 RNA 速度和 TCR 分析,CD8-CXCL13 显示出与 CD8 + Tem 细胞的谱系联系。转录组分析表明IFNG、GZMK、GZMA和CD44 的效应和记忆相关基因;TBX21、BHLHE40和BCL6 的转录因子 (TF) ;CD28和ICOS 的共刺激分子;以及 HLA 基因和整合素而耗尽相关的基因,包括被上调HAVCR2,LAYN,TIGIT,和LAG-3,CD8-CXCL13 的表型转变也反映在其耗竭细胞评分降低和效应记忆细胞评分增加。此外,治疗后 CD8-CXCL13 中上调的基因参与了 T 细胞介导的细胞毒性、抗原加工和呈递以及 IFN-γ 介导的信号通路的正调节途径,进一步表明其在 PD-L1 阻断治疗后增强的效应特性。
单细胞 ATAC-seq (scATAC-seq) 分析以检查染色质可及性的变化,从五个样本中获得了 30,758 个免疫细胞的数据,包括来自接受紫杉醇加阿特珠单抗治疗的反应性患者的配对样本。基于我们对 scATAC-seq 和单细胞 RNA-seq (scRNA-seq) 数据的综合分析(STAR 方法),确定了免疫细胞亚型。不同亚群的特征基因的染色质可及性证实了它们的细胞身份。CD8-CXCL13 细胞的表观遗传特征,显示 T 细胞耗竭标志物的特定富集,包括PDCD1、LAG3和CTLA4与之前在小鼠模型、人类黑色素瘤和非小细胞肺癌中的研究所表征的CD8 + Tex 细胞一致。与染色质可及性特征中的其他 T 细胞亚型相比,CD8-CXCL13 和 CD8 + Tem 彼此更相似,这证实了它们在谱系分化的连续谱中的联系。具体而言,CD8-CXCL13 和 CD8 + Tem 在IFNG、GZMK和PDCD1基因座中含有开放染色质区域 (OCR) 。然而,CD8-CXCL13显示来自一个不同的细胞状态CD8+ TEM,由于在它们的富集同时进行识别CXCL13,CTLA4和LAYN。
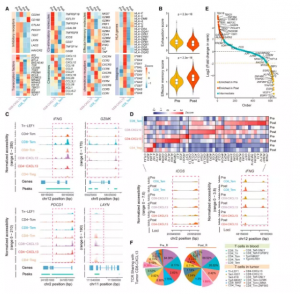 图9. 联合治疗后反应性肿瘤中T细胞亚群的转录组学和表观遗传动力学
图9. 联合治疗后反应性肿瘤中T细胞亚群的转录组学和表观遗传动力学
通过比较联合治疗前后的配对 scATAC-seq 数据,检查了 CD8 + Tem、CD8-CXCL13 和 CD4-CXCL13染色质可及性的全局动态。每个 T 细胞亚群中差异 OCR 和相关基因的表征表明 CD8-CXCL13 细胞的效应子和记忆特性增强,其在CD44、CXCR4、KLRG1、XCL2、CST7、ICOS和CD28 中的可及性增强,而在衰竭相关的基因,如CREM和MYO7A。此外,差异可及峰中过度表达的 TF 结合基序(TFBMs)也证实了 CD8-CXCL13 的表型变化,CREM和RBPJ 的 TFBMs倾向于在预处理组中富集,而TBX21、EOMES和PRDM1 的那些富集在后处理组。因此,染色质可及性动力学揭示的发现与基于转录组的分析结果一致,两者都支持联合治疗后 CD8-CXCL13 增强的效应特性。
血液中的 T 细胞,发现增殖的 T 细胞在基线时在应答者中富集,但在联合治疗后减少,可能是由于紫杉醇的影响。值得注意的是,没有观察到血液中的CXCL13 +T细胞,但发现血液中的 CD8 + Tem 细胞与肿瘤 CD8-CXCL13 共享更高水平的 TCR 克隆,并且在接受联合治疗的患者响应中也表现出升高的迁移指数。这些观察表明,在 PD-L1 阻断治疗后有反应的患者中诱导了可检测的全身免疫反应。
总结
本文通过单细胞转录组、单细胞ATAC、单细胞免疫组库技术揭示anti-PD-L1免疫治疗联合化疗在三阴性乳腺癌中应答关键的免疫细胞亚群,在TNBC肿瘤中,紫杉醇方案可以选择性地减少关键的抗肿瘤免疫细胞,但提高免疫抑制巨噬细胞,因此可能不利于伴随阿特珠单抗。在紫杉醇加 atezolizumab 治疗后,Bfoc 而不是 pB 细胞与LTi细胞、CXCL13 +T 细胞和 cDC1 协同扩增,B 细胞可能通过与 CD4-CXCL13 相互作用并激活 CD4-CXCL13 来促进抗肿瘤免疫,CD4-CXCL13 可以帮助通过 cDC1 启动 CD8-CXCL13。总的来说,本文突出了CXCL13 +T细胞在有效应对抗PD-L1疗法方面的重要性,并表明通过紫杉醇疗法减少这些细胞可能会损害伴随阿特珠单抗 (Atezolizumab)进行TNBC治疗的临床结果。







 京公网安备 11011302003368号
京公网安备 11011302003368号