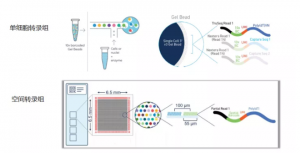
百迈客单细胞和空间转录组测序
单细胞转录组测序(scRNA)是在单细胞水平进行高通量基因表达谱检测,对复杂细胞群深入分析,表征单个细胞的表达谱,避免单个细胞的异质性生物学信息被大量细胞的均质化覆盖。
空间转录组(ST)是以高空间分辨率解析RNA-seq数据的技术,实现解析单个组织切片中的所有mRNA,从而能够定位和区分功能基因在特定组织区域内的活跃表达信息,对于癌症、免疫、肿瘤免疫相互作用,组织微环境,神经和发育等领域,有着令人期待的应用前景。
单细胞和空间转录组技术原理对比:
英文题目:A single-cell and spatially resolved atlas of human breast cancers
中文题目:人类乳腺癌的单细胞和空间分辨率图谱
发表杂志:nature genetics
影响因子:24.36
DOI:10.1038/s41588-021-00911-1
乳腺癌是一个复杂的细胞生态系统,目前人类对它们细胞组成和组织的了解是有限的。此项研究中作者对人类乳腺癌进行单细胞和空间分辨转录组学分析,并开发了一种固有亚型分类的单细胞方法来揭示复发性肿瘤细胞的异质性。利用转录组和空间转录组进行免疫分型,最终提供了高分辨率的免疫图谱和乳腺癌细胞结构的全面转录图谱。
研究背景
目前对人类乳腺癌细胞异质性和组织结构的理解主要来源于组织学、批量测序、低维假 设研究和实验模型系统。不同的细胞亚群与肿瘤微环境(TME)中的细胞以及与疾病状态之间的关系仍未明确。单细胞RNA测序(scRNA-scq)则为系统描述肿瘤的细胞景观提供了显著的新机会,并为揭示了细胞生物学、疾病病因学和药物反应提供了新见解。最近的研究了来自数百名患者的数百万细胞,以探究乳腺癌细胞类型和生态系统。因此,需要一个更详细的高分子分辨率的乳腺肿瘤转录图谱,进一步界定疾病的分类,识别细胞的异质性,从而确定细胞分类。scRNA-seq和stRNA-seq相关数据则可以更好的确定TME中的细胞是如何组织成功能单位的。
实验方法
材料:
(1) 单细胞转录组:26个肿瘤原发灶组织,包括11个ER+、5个HER2+和10个TNBC患者
(2) 空间转录组:6个肿瘤原发灶组织,包括来自本研究scRNA-seq队列的2个ER+(CID4535和CID4290)和2个TNBC(CID44971 和 CID4465),以及2个在其它实验室中处理的TNBC(1142243F 和 1160920F)
方法:单细胞转录组测序、空间转录组测序
研究结果
1. 人类乳腺癌的高分辨率细胞图谱
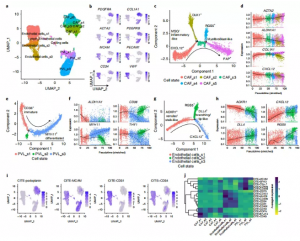
为了阐明乳腺癌的细胞结构,作者通过scRNA-seq分析了26个原发肿瘤,包括11个ER+, 5个HER2+和10个TNBCs。共对130246个单细胞数据进行了分析注释(图la,b)。主要的细胞类型代表了所有肿瘤和临床亚型(图lc)。UMAP显示肿瘤间质和免疫细胞聚集在一起。在肿瘤人群中,大量大规模基因组重排被观察到。这揭示了患者独特的拷贝数变化和乳腺癌中常见的变化,如腔癌中chrlq增加和基底样乳腺癌中chr5q丢失。
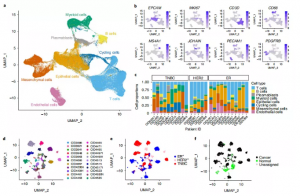
2. SCSubtype: scna -seq数据的固有亚型
由于无监督聚类不能发现肿瘤间复发的肿瘤细胞基因表达特征,作者尝试使用建立的PAM50方法对细胞进行分类,并开发了一种兼容scRNA -seq的方法来进行固有分子亚型划分。作者使用了1100个乳腺肿瘤的癌症基因组图谱(TCGA)数据集和大约2000个固有乳腺癌基因列表,对样本进行层次聚类。最终确定4组基因,这些基因将定义单细胞衍生的分子亚型。作者将这些基因定义为 “SCSubtypc”基因标记。
SCSubtype显示,20个样本中有13个样本的肿瘤细胞低于90%属于1个分子亚型,而只有1个肿瘤显示完全同质(图2b) 。在一些管腔和HER2E肿瘤中,SCSubtype预测了少量的基底样细胞,由免疫组学验证(图2c)。其应用进一步证明了低细胞性小叶癌的能力,主要为LumB和LumA细胞的混合物(图2b),这与临床IHC结果一致。

3. 复发性基因模块驱动肿瘤细胞异质性
接下来作者又以一种无监督的方式研究了驱动肿瘤内转录异质性(ITTH)的生物途径,对至少50个肿瘤细胞进行整合聚类,生成574个ITTH基因标记。并识别出七个群体,即“基因模块”(GMs)。基因集富集鉴定出这些GMs共有的和独特的功能特征(图2e)。GM4在MKI67、PCNA和CDK1等基因驱动的细胞周期和增殖标记中具有独特的富集作用。GM3主要富集干扰素应答、抗原呈递和上皮-间充质转化。GM1和GM5表现出雌激素反应途径的特征,而GM1在缺氧、肿瘤坏死因子α和p53信号转导和细胞凋亡中也表现出富集。
对于每个肿瘤细胞,作者计算了7个GMs的特征
(图2e)。GM4在MKI67、PCNA和CDK1等基因驱动的细胞周期和增殖标记中具有独特的富集作用。GM3主要富集干扰素应答、抗原呈递和上皮-间充质转化。GM1和GM5表现出雌激素反应途径的特征,而GM1在缺氧、肿瘤坏死因子α和p53信号转导和细胞凋亡中也表现出富集。
对于每个肿瘤细胞,作者计算了7个GMs的特征评分,并使用层次聚类来识别细胞相关性。这清楚的将肿瘤细胞进行了分组,减少图ld-f中所示的巨大肿瘤间变异性。一些模块与SCSubtype相关联,而其他模块则显示了更多样化的子类型关联(图2f,g)。最后,作者使用基于GM的细胞状态分配来了解肿瘤细胞的瘤内异质性。类似于SCSubtype(图2b),看到了与肿瘤亚型广泛一致但不受肿瘤亚型限制的细胞异质性证据(图2h)。SCSubtype和GM分析为肿瘤性ITTH的分类提供了互补的新方法,并进一步证明大多数肿瘤中癌细胞表现出不同的表型。
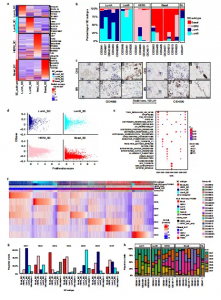
4. 乳腺癌的免疫环境
高分辨率下检查乳腺肿瘤的免疫微环境,作者重新聚集免疫细胞,以识别T细胞、固有淋巴细胞、髓样细胞、B细胞和浆细胞。通过细胞转录组和表位测序(CITE-seq)对4个样本进行免疫表型分析,并进行基于锚点的整合,将蛋白表达水平转移到其余病例中,结果显示与实验测量值高度相关。
5. 淋巴细胞和先天淋巴样细胞
作者又在患者中发现了18个T细胞和先天淋巴细胞簇(图3a)。在这5个CD8集群中,由3个高表达抑制性检查点分子包括 LAG3、PDCDI 和 TIGIT和2个低表达 IFNG 和 TNF的CD8 + T细胞组成。另外还发现了由1型干扰素(IFN-I)信号和增殖驱动的两个簇,它们都由CD4+和CD8+ T细胞组成。通过αβ T细胞受体和NK标记的表达,作者还鉴定了自然杀伤细胞(NK)和自然杀伤T (NKT)样细胞。
在TNBC样本中,IFITl/c6、LAG3/c8 和MKI67/C11的T细胞比例更高(图3c)。值得注意的是,在TNBC中LAG3/C8消耗的CD8亚群显著表达PD-1、LAG3、CD27和CD70配受体,可增强T细胞的细胞毒性(图4f)。在不同的临床亚型中,检查点分子表达的差异更为明显,包括在非免疫细胞(如CAFs)上。这些数据提供了对每种亚型疾病最适合的免疫治疗策略的见解。
6. 骨髓细胞
骨髓细胞形成13个簇,可在所有肿瘤中以不同频率被识别(图4a)。单核细胞形成三个簇,其中Mono:FCGR3A群体形成了一个小而独特的簇,以CDI6蛋白高表达为特征(图4b,c)。作者鉴定了表达CLEC9A或CD1C的传统树突状细胞(cDCs),表达 IRF7和 LAMP3,这在之前的乳腺癌单细胞研究中未见报道。巨噬细胞形成6个簇,其中一个簇具有先前“M1-like”表型相关的特征,还有两个簇类似于“M2-like”表型,所有这些簇都与之前在乳腺癌中描述的TAMs有一些相似之处。值得注意的是,作者发现了在传统的M1/M2分类之外的两个新的巨噬细胞群体(图4a-c)。这些细胞与最近报道的脂质相关巨噬细胞(LAMs)在肥胖小鼠和人类中扩增的转录组相似性非常高。同时还观察到HER2+肿瘤中LAMI:FABP5细胞的比例大幅降低(图4d), 这表明独特的肿瘤基因组学特征或微环境调节LAM1/2的命运。虽然RNA编码PD-L1和PD-L2在Mac:CXCL10和DCLAMP3髓系群体中高度共表达(图4f),但CITE-seq 数据的分析显示,PD-L1和 PD-L2蛋白表达在Mac:CXCL10、LAM1:FABP5、LAM2:AP0E和DC:LAMP3簇中分布更广(图4b和图7g),突出LAM1/2作为免疫调节分子的重要来源。
7. 基质亚类类似于不同的分化状态
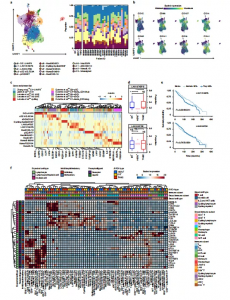
在基质室中,作者鉴定了三种主要的细胞类型(图5a,b)。Monocle2的伪时间轨迹分析揭示了5种CAF状态。状态1(s1)具有高表达的间充质干细胞(MSCs)和炎性样CAFs (iCAFs)特征。当细胞向分化状态s4和s5过渡时,这些标记物的表达减少,这种分化状态通过增加ACTA2 (aSMA)、TAGLN、FAP和COL1A1的表达和富集ECM相关通路而类似于肌成纤维细胞样CAF状态。
对于PVL细胞,作者识别出三种状态(图5e)。PVL sl和s2表达与干细胞、未成熟周细胞和粘附分子相关的标志物相关。s2的分支由RGS5、CD248和THY1确定。与基因表达一致,CITE-seq显示PVL早期s1和s2中细胞表面CD90(THY1)和整合素分子CD49a 、CD49d的富集(图5i,j)。当细胞转移到PVL s3时,这些标记的表达减少,而PVL s3则富含与收缩相关的基因和平滑肌表型相关的通路(图5),揭示PVL s3细胞在IHC检测中一直被误分类为CAFs。
接下来,作者确定了三种内皮状态(图5g)。当细胞分成两种状态时,这些标记物随着伪时间的推移而减少,这两种状态都伴有内皮细胞标记物DLL4的表达升高(图5h)。内皮细胞s2以RGS5和ESM1区分,而s3表达细胞迁移和血管生成调节因子。由于血管的生成是一个动态过程,涉及内皮柄细胞和顶端细胞之间的转换。在临床亚型和三个正常乳腺组织样本中鉴定出相似的CAF、PVL和内皮细胞状态,表明它们可能是在TME中经历重构的固有细胞类型。
8. 对乳腺癌异质性进行空间映射
为了深入了解组织细胞类型,作者对6个样本进行了空间转录组学分析(图6a),同时作者还将其与scRNA-seq数据进行了匹配分析(图6b)。在6个病例中,通过立体镜和病理学识别出癌细胞的位置,然后检查每个位置的7个GM标记,这揭示了在TNBC病例中 GM3和GM4的预期富集以及在ER +病例中GM1和GM5的预期富集。这揭示了两个主要的星系团GM1、GM3、GM5和GM6和另一个星系团的GM2和GM4在6个病例中大多是保守的(图 6d)。有趣的是,GM3和GM4在所有样本中显示出强烈的负相关(图6e-g),表明这些不同的癌症表型发生在乳腺癌相互排斥的区域。
9. 绘制新的异型细胞相互作用
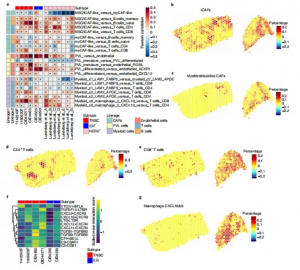
虽然一些研究表明间充质细胞在调节抗肿瘤免疫中发挥重要作用,但基质细胞和免疫细胞之间的相互作用尚未在组织中被阐明。作者在6例病患中发现5例肌成纤维细胞样CAFs和iCAFs 之间存在中度负相关性(图7a-c)。CAF定位在7个HER2+乳腺肿瘤的独立空间转录组数据是一致的,表明这种关系在不同的临床亚型中是保守的(图7a)。与上述iCAFs的免疫调节特性一致的是,在两项研究中,iCAFs均与多个淋巴细胞群体共定位(图7a,d,c)。在6个样本中,肌成纤维细胞样CAFs与CD8+T细胞相关(图7a),揭示与高TIL浸润或免疫炎症表型的浸润性乳腺癌的功能相关。通过整合信号预测和细胞邻近性,这些数据突出了 CAFs直接调控免疫细胞的相关候选因子。
之前,作者定义了巨噬细胞状态LAM1,LAM2和Mac:CXCL10/c9,它们是具有高表达的免疫调节分子。在所有的局部Visium病例中,LAM1和LAM2细胞均存在于浸润性肿瘤区域;然而,LAM2也存在于高基质细胞、脂肪细胞和淋巴细胞的形态学区域。在所有三个亚型的8个肿瘤中,LAM2细胞与CD4+和CD8 + T细胞正相关(图7a)。多个肿瘤的LAM2细胞和CD4+/CD8+T细胞富集的spots共同表达PD-L1/PD-1和PD-L2/PD-1,表明这些细胞可能具有免疫调节的功能相关性。
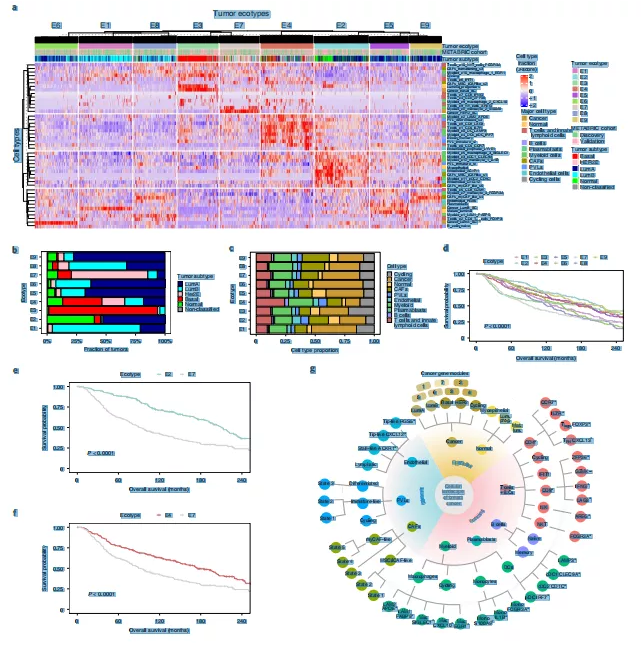
10. 乳腺肿瘤生态型与患者生存相关

作者在26个肿瘤中观察到显著的变异和细胞频率的重复模式,并从单细胞数据集中估计细胞组分,发现捕获的细胞组分和预测的比例之间具有良好的整体相关性,大多数细胞类型出先显著相关性。作者还观察到在匹配bulk-PAM50分类的肿瘤中,聚类显示9个细胞组成相似的肿瘤簇(“生态型”)(图8a-c)。这些生态型与肿瘤亚型、sc亚型细胞和主要细胞类型的多样性相关(图8a)。Ecotype 3(E3)在含有Basal_SC等细胞和基底样PAM50亚型的肿瘤中富集(图8a,b)。El、E5、E6、E8和E9主要由管腔细胞组成。E4对与抗肿瘤免疫相关的免疫细胞高度富集(图8a)。E2 主要由 LumA 和正常样肿瘤组成(图8a,b)。
在预后方面,E2肿瘤患者预后较好(图8d,e), E3肿瘤患者5年生存率较差(图8d), 这与已知的基底样和高增殖肿瘤的不良预后相一致。E7预后也较差,以HER2E肿瘤为主;E4 也有相当大的比例HER2E和基底样肿瘤(图8b),但这些患者的预后明显好于E7,可能是抗肿瘤免疫细胞浸润的结果。通过对整合基因组群与生态型之间的关联性进行研究,发现E3中来自整合基因组群10的癌症比例很高,5年生存率同样很低。E7有很高比例的ERBB2扩增和HER2E整合基因组簇5。然而大多数生态型与特定的整合基因组簇或PAM50亚型没有明确的关联,这反映了基质细胞和免疫细胞在生态型中的作用。
小结
在此项研究中,作者主要将乳腺肿瘤细胞结构分为三个层次。首先,详细的细胞分类,包括新的细胞类型和状态,以及表征细胞异质性的新方法。第二,肿瘤内细胞位置和相互作用的空间图谱,揭示组织内肿瘤和宿主细胞表型的协调性及细胞之间的空间关系。第三,利用反褶积,作者还观察了具有相似细胞类型比例和预后相关性的肿瘤组,称为生态型,通常由特定的共分离细胞群驱动。未来的工作将研究组织结构和肿瘤生态型的分子机制,旨在解释它们在临床结果上的差异,并研究肿瘤生态型是否可以用于个体化治疗。







 京公网安备 11011302003368号
京公网安备 11011302003368号