原核表达(Prokaryotic expression) 顾名思义是在原核生物体内进行的蛋白表达。一般是通过基因克隆(Gene cloning)技术在体外构建好原核表达载体,转化到原核生物的细胞中,添加诱导剂进行蛋白诱导表达,这是目前分子生物学实验中常见的方法。
原核表达载体
体外诱导目的蛋白的表达需要将携带有目的基因片段的原核表达载体导入表达菌株中,通过添加适量的诱导剂,使目的蛋白的表达量升高。
蛋白诱导表达
1.原核表达方案:
将原核表达载体导入原核生物表达菌株中,将平板上的单克隆先接种至0.2 ml的抗性液体培养基中,进行扩大培养。进而转接到5 ml抗性液体培养基中,待菌液OD值为0.6-0.8时,加入诱导剂进行诱导。通常情况下菌液OD值0.6最佳,OD值超过1.0后,菌体老化,不适合进行诱导表达。加入IPTG诱导剂,100mM的IPTG溶液, 添加的比例为1:100,1M浓度的IPTG溶液, 添加的比例为1:1000,此时TPTG终浓度为1mM。建议在添加诱导剂前吸取1 ml 未诱导的菌液作为对照,有些情况下未诱导会有本底渗漏表达,表达量很低。
2.融合蛋白存在形式的影响因素:
温度:一般来说,大肠杆菌最适合的培养温度是37℃,但在此温度下容易使得蛋白翻译速度太快,来不及正确折叠,形成以包涵体形式表达的蛋白。上清是具有生物学活性的蛋白,后续制备抗体优先选择以上清形式表达的蛋白。优化:可以尝试做温度梯度,16℃, 20℃,24℃,30℃。尝试低温诱导。
诱导剂:诱导剂浓度一般可以尝试0.2 mM 、0.4 mM、0.6 mM、0.8 mM、1.0 mM 1.5 mM、2 mM的IPTG浓度, 浓度太高容易对细胞产生毒性。
诱导时间:尝试 3 h、6h、8h、10h、12h, 依据不同蛋白所决定,诱导过程中添加适量抗生素可能有好的效果。根据每个蛋白的不同,诱导时间对于表达量的影响不尽相同。
3.表达形式:超声破碎后离心分为两部分,一部分是上清,一部分是沉淀,上清具有生物学活性。沉淀不具有生物学活性。
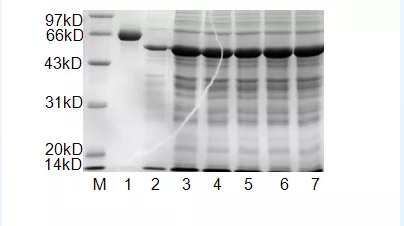
4.蛋白定量:SDS-PAGE蛋白胶可以观测蛋白的分子量和浓度,蛋白Marker是分子量指示大小,估计marker条带大小估算目的蛋白分子量大小。用BSA标准品溶液定量蛋白,可以估测蛋白浓度。
M: marker 1:0.5 mg/ml BSA(上样量10 μL)2:0.5 mg/ml 目的蛋白溶液(上样量2 μL) 3-7:0.5 mg/ml 目的蛋白溶液(上样量10μL)
5.蛋白定性
产品概述
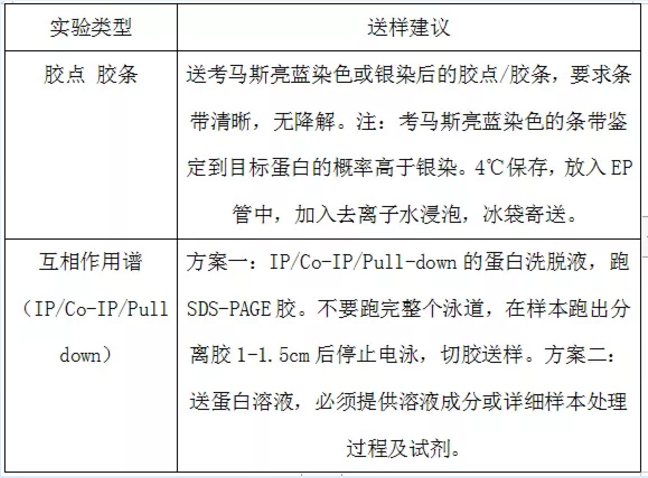
利用LC-MS/MS蛋白鉴定技术对胶条样本(即SDS-PAGE样本)、IP、co-IP、Pull-down等复杂样本进行鉴定。
技术原理
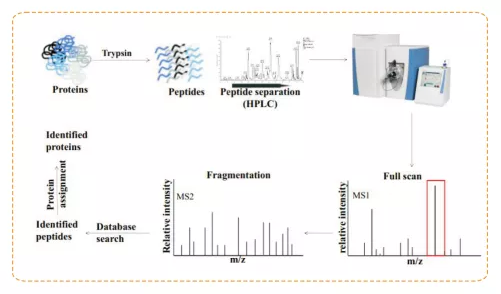
质谱一般由离子源(Ion source)、质量分析器(Mass analyzer)和离子检测器(Detector)三部分组成。传统的质谱仅用于小分子挥发物质的分析,但随着新的离子化技术的出现,如基质辅助激光解析电离飞行时间质谱(MALDI-TOF)和电喷雾电离质谱(ESI-MS)等,质谱技术的出现为蛋白质分析提供了一种新的途径。现在蛋白质组学基本研究手段是:以生物质谱技术为核心,对蛋白质进行大规模、高通量分离、鉴定和分析。
蛋白质质谱鉴定的基本原理是用蛋白酶将蛋白质消化成肽段混合物,经MAILDI或ESI等软电离手段将其离子化,然后通过质量分析器将具有特定质核比的肽段离子分离开来。通过实际谱图和理论上蛋白质经过蛋白酶消化后产生的一级质谱峰图和二级质谱峰图进行的比对,进行蛋白鉴定。
实验流程
技术优势
高通量,一次可鉴定多种蛋白质;
灵敏度高,可检测样品浓度较低的胶点;
通用性强,可分析蛋白质条带、免疫共沉淀洗脱液等多种形式的样品。
液相与质谱连用,自动化操作,分析速度快,分离效果好。
应用范围
蛋白质胶点鉴定
蛋白质胶条鉴定
蛋白混合溶液鉴定
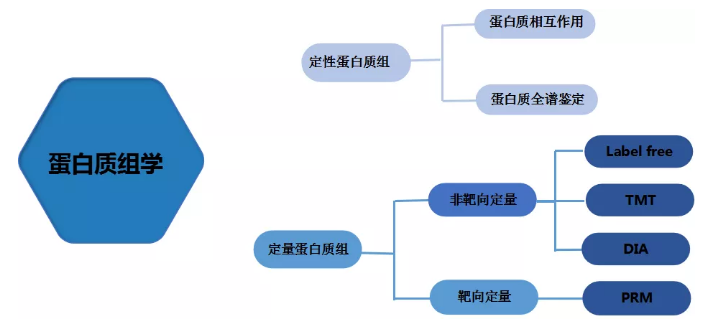
蛋白质组学服务
除了蛋白定性鉴定,百迈客还提供以下产品:








 京公网安备 11011302003368号
京公网安备 11011302003368号