 摘要
摘要
用人多能干细胞(hPSC)形成种间嵌合体已成为在体内评估hPSC多能性的有效方案,并且 可能在再生医学,包括移植器官和组织再生中发挥重要作用。使用小鼠和猪胚胎的研究表明, hPSCs并不能有力地促进与人类进化距离较远的物种的嵌合体形成。本研究主要是在体外培养的 食蟹猴(Macaca fascicularis)胚胎中研究人扩展多能干细胞(hEPSC)的嵌合能力,证明 hEPSCs能够在食蟹猴胚胎中存活、增殖,并绘制植入前后细胞图谱。同时还发现了种间细胞相 互作用,这些事件可能有助于塑造嵌合胚胎内人类和食蟹猴细胞的独特发育轨迹。本研究结果 可能有助于更好地了解早期人类胚胎发育和灵长类动物进化,并制定策略以改善进化距离较远 的物种的人类嵌合体的形成。
研究背景
多能干细胞(PSC)能够进行无限的自我更新并产生所有成体细胞类型(De Los Angeles et al., 2015; Hackett and Surani, 2014; Rossant and Tam, 2017; Wu and Izpisua Belmonte, 2016)。PSCs 可通过囊胚互补进行种间器官再生,这种技术有潜力为包括器官移植在内的再生医学提供大量 体内生成的人类细胞、组织和器官(Suchy and Nakauchi, 2018; Wu et al., 2016)。成功的种间囊 胚与人类 PSC(hPSC)互补的要求之一是它们能够形成嵌合体。hPSCs的嵌合能力已在几种物 种中进行了测试(Wu et al., 2016),虽然不同实验室都在持续努力,但普遍的共识是在与人类 进化距离很远的物种上(e.g., mice and pigs; Wu et al., 2016, 2017),hPSCs 并不能始终如一地、 有力地促进嵌合体的形成,即使人类细胞凋亡受到抑制,结果也是一样(Das et al., 2020; Huang et al., 2018; Wang et al., 2018)。hPSCs和进化距离很远的物种之间的异种屏障被认为是限制嵌合 体形成的原因(Wu et al., 2016, 2017),但尚无hPSCs与进化上接近人类的物种中进行嵌合体的研究。体外培养的PSC反映了体内多能性,体外不同的细胞培养方案导致细胞不同的多能性状态 (Morgani et al., 2017; Smith, 2017; Weinberger et al., 2016)。处于不同多能状态的hPSC表现出不 同的转录、表观遗传和代谢特征,当它们被引入动物胚胎时,它们的嵌合潜力也不同(De Los Angeles, 2019; Harvey et al., 2019; Zhang et al., 2018)。最近研究发现人类扩展多能干细胞 (hEPSC)在小鼠中表现出较高的嵌合能力(Gao et al., 2019; Yang et al., 2017), 然而尚未在其 他物种中确定hEPSCs的嵌合能力。 利用新开发的培养体系,食蟹猴胚胎可离体培养长达20天(Ma et al., 2019; Niu et al., 2019)。将hEPSCs显微注射到食蟹猴囊胚中,并在不同时间点观察其对食蟹猴胚胎的作用(见 下图),结果发现hEPSCs可以整合到晚期食蟹猴囊胚的内细胞团(ICMs)中,同时还通过单细 胞转录组测序(scRNA-seq)分析确定了体外培养过程中食蟹猴胚胎中hEPSCs的分化轨迹。
材料方法
卵母细胞采集和体外受精
参考已发表文章(Mishra et al., 2010)进行卵巢刺激、卵母细胞恢复和体外受精。健康雌 性食蟹猴通过肌肉注射20 IU重组人促卵泡激素α(rhFSH, Gonal F, Merck Serono)8 天,然后 在第9天注射1,000 IU重组人绒毛膜促性腺激素α(rhCG, OVIDREL, Merck Serono)刺激卵 泡。在给予rhCG后32-35小时,通过腹腔镜收集卵丘-卵母细胞复合物。将卵泡内容物置于 37℃含有0.3%牛血清白蛋白(BSA)的Tyrode乳酸丙酮酸白蛋白(TALP)培养基中,在短暂
暴露于透明质酸酶(<1 分钟)后,在TALP-HEPES中通过移液器将卵母细胞剥离出卵丘细胞 (0.5 mg/mL),选择核成熟中期II(MII;存在第一个极体)卵母细胞。成熟的卵母细胞立即 进行卵胞浆内单精子注射(ICSI),然后在37℃含有5% CO2的10% 胎牛血清(FBS, GIBCO) 的CMRL-1066培养基(GIBCO, 11530037)中培养,第二极体和两个原核的生成证实了体外受 精成功,然后将受精卵在含有5% CO2的10% 胎牛血清的HECM-9培养基中37℃下培养。除非 另有说明,所有试剂均来自 Sigma Chemicals。
将hEPS细胞显微注射到食蟹猴囊胚并进行体外胚胎培养
将受精后第6天的囊胚(早期囊胚)转移到覆盖有3 mL矿物油的培养皿中心的50 mL TH3液 滴中。将hEPS细胞的单细胞悬浮液注入10 uL培养基液滴中。将25个tdTomato阳性hEPS细胞吸入 内径为30°斜口的15 mm注射移液管中。使用单个激光脉冲消融透明带,并将含有hEPS细胞的 注射移液管立即插入囊胚的孔中,靠近 ICM。将注射的囊胚快速转移到HECM-9和hEPS(1:1) 的混合培养基中(Yang et al., 2017b),并培养24小时至膨胀良好的囊胚阶段。
人猴嵌合胚胎体外培养
选择tdTomato阳性人猴嵌合胚胎进行后续实验。人猴嵌合胚胎的透明带可通过暴露于来自 牛睾丸的透明质酸酶约30 s而去除,然后将胚胎接种在含有IVC1培养基的8孔板(80826,Ibidi) 中。胚胎附着在孔上后,将一半的IVC1更换为IVC2培养基,此后,每天用新鲜的IVC2更换一半 的培养基,并在指定的日期收获猴胚胎。IVC1和IVC2的成分见已经发表文章(Niu et al., 2019)。
单细胞收集和单细胞RNA-seq (scRNA-seq)
用磷酸缓冲液(PBS)(MA0008,美伦生物)洗涤后,用1mL注射器将胚胎切成几块。在 荧光显微镜(Leica)下挑取tdTomato阳性和阴性组织,用0.1%胰蛋白酶(25200-072,GIBCO) 在37°C消化3-5分钟制成单细胞悬液。2% FBS(04-002-1A, Biological Industries)中和后,用含 有0.1至1% BSA的预冷PBS洗涤细胞。最后,使用荧光显微镜用吸管将单个tdTomato阳性和阴性 细胞挑入冰上预冷的裂解缓冲液中。
通过吸管将单细胞放入裂解缓冲液中,逆转录反应和预扩增分别使用SuperScript II(18064- 071, Invitrogen)和KAPA HiFi HotStart Ready Mix(KK2602, KAPA Biostems)进行,然后进行20 个PCR循环以获得20-140 ng的cDNA。通过Tn5转座酶(TD502/TD501,Vazyme)在 55°C混合10 分钟将cDNA片段化,然后使用TruePrep 扩增酶(TD601,Vazyme)进行PCR扩增,用AM Pure XP 磁珠(A63881, Beckman Coulter)纯化文库并进行大小选择。所有文库均适用于Illumina X- Ten测序平台(由Annorad测序)。
免疫荧光(IF)
IF参考之前发表的内容(Niu et al., 2019)。收获体外培养的人猴嵌合胚胎,在4%(w/v) 多聚甲醛(BL539A,Biosharp)的PBS溶液中室温固定30分钟,用PBS洗涤。d.p.f.9胚胎直接染 色,d.p.f.11至19的胚胎在蔗糖(BGC005,美伦生物)溶液中脱水6小时,浓度从15%(w/v)增 加到30%(w/v),使用OCT(4583,Tissue-Tek OCT,SAKURA)包埋,-80℃冷冻,将胚胎制 备为8 mm厚的冷冻切片后,放在预处理过的载玻片(1A5105,CITOTEST)上,风干1小时。在 室温下PBST(含 0.3% Triton X-100 的 PBS)(T9284,Sigma-Aldrich)中透化30分钟,样品用 3%(w/v)BSA 和10%(v/v)FBS 封闭(04-001-1A, Biological Industries)在PBS 中,4℃下与一 抗一起孵育过夜,然后洗涤至少3次后,荧光偶联的二抗、4′,6-二脒基-2-苯基吲哚(DAPI)与 载玻片在室温下避光孵育2小时。使用Leica TCS SP8共聚焦显微镜拍摄图像。
统计分析
所有值均表示为平均值±SD,包括图例和补充图例中统计分析、统计显著性和n值在内的 统计参数。使用Prism软件(GraphPad)进行统计分析,采用单向方差分析,显著性p < 0.05。
细胞来源识别、scRNA-seq数据预处理和质量控制
首先通过两种不同的方法识别人和猴细胞。 一种是随机选择的10000条reads通过blastp与人 类或食蟹猴基因组(Ensembl Homo_sapiens.GRCh38和Macaca_fascicularis_5.0)进行比对;另一 个是比对到tdTomato序列的测序reads。在确定细胞来源后,使用hisat2(Kim et al., 2019)将测序 reads比对到人类或猴子基因组,使用StringTie(Pertea et al., 2015)组装转录本,并计算基因表 达量(TPM)。
细胞聚类、谱系鉴定
Seurat包(v.3.1.1)(Butler et al., 2018)用于单细胞聚类分析,并用t-SNE来可视化结果。 参考数据集包括Human-1(Zhou et al., 2019)、Human-2(Xiang et al., 2020)、monkey-1(Niu et al., 2019)和monkey-2(Nakamura et al., 2016)。除非另有说明,Control-monkey的参考数据集为 monkey-1。本研究中的嵌合体数据按照以下步骤整合到上述参考数据集中,首先,将这些数据 集分别创建为Seurat对象,顺序为Human-1、Human-2、monkey-1、chimera-human和chimera- monkey;然后使用“FindIntegrationAnchors”函数将这些对象作为输入,参数为“k.anchor = 5, anchor.features = 2000”;最后使用“IntegrateData”函数将所有数据集与默认参数进行整合。 Seurat使用前20个主成分(PC)进行聚类(分辨率为 0.6),每个cluster使用“FeaturePlot”函数 在t-SNE图上突出显示的特定标记基因定义,并由先前研究中的已知谱系证实。
差异基因鉴定
通过运行Seurat的“FindAllMarkers”和“FindClusters”功能(p <0.01)来鉴定独特的cluster 特异性表达基因。K-近邻算法SPRING(Weinreb et al., 2018)用于轨迹分析,以集成数据、2000
个高度可变基因(HVG)和默认参数作为输入。为了构建所有嵌合细胞的系统发育树,将基因 表达矩阵输入MEGA (X 10.1)(Kumar et al., 2018)构建系统发育树。
拟时序分析和拟时序依赖性差异表达基因分析
Monocle2(v2.12.0)(Trapnell et al., 2014)用于构建所有EPI细胞的拟时序分析。用EPI谱 系 中 人 、 猴 和 嵌 合 细 胞 的 2000 个 HVG 和 表 达 数 据 用 作 Monocle2 的 输 入 , 通 过 参 数 “max_components=2”的“reduceDimension”函数降低维度,将表达数据投影到低维空间后, 通过“orderCells”函数对细胞进行排序,最后使用DTW算法来对齐人类、食蟹猴和嵌合细胞之 间的不同拟时序过程,如先前研究(Kanton et al., 2019)中所述。拟时序对齐数据后,使用基于 F检验的ANOVA分析来识别具有拟时序依赖性表达模式的基因,如前所述(Kanton et al., 2019)。对于每个HVG,建立一个具有六个自由度(df)的自然线性回归模型(R包splines中的 ns函数),以表达水平作为响应变量,伪时间作为自变量。对测试基因进行Bonferroni校正,校 正P值为0.01。此外,R包slingshot(v1.1-2)用于推断具有默认设置的嵌合人类EPI-like细胞和 hEPS的潜在发展轨迹(Street et al., 2018)。
GO和KEGG分析
使用clusterProfiler R包(Yu et al., 2012)进行KEGG通路(Kanehisa, 2019; Kanehisa and Goto, 2000; Kanehisa et al., 2019)和GO富集分析,P≤0.05被认为是显著富集的。使用R包中“ggplot” 函数进行可视化。
单细胞转录因子调控网络构建
SCENIC 包(Aibar et al., 2017)可用于推断和表征嵌合体细胞scRNA-seq数据的基因调控网 络。根据网站(https://github.com/aertslab/SCENIC)的指导手册,共三个步骤:1.基于嵌入式 GENIE3的转录因子与潜在目标基因推断之间的共表达网络;2.对于每个共表达模块,RcisTarget 对所有潜在靶基因进行顺式调控motif富集分析,每个转录因子及其靶基因被定义为一个调节 子;3.通过AUCell计算每个细胞中每个调节子的活动分数。本研究将所有嵌合细胞的表达谱输 入SCENIC,以推断它们的AUC调节子活性,然后嵌合细胞基于它们的调节子活性和pheatmap (v1.0.10)的“pheatmap”功能进行聚类。为了比较,上述数据集Human-1和monkey-1也使用相 同的调节子活性分析。
RNA速度分析
RNA速度是使用Velocyto.R程序(http://velocyto.org)根据之前报道的拼接和未拼接转录本 reads计算的(La Manno et al., 2018)。Velocyto使用BAM文件来计算拼接和未拼接的reads,并 生成Loom 文件,然后使用“read.loom.matrices”函数将这些文件加载到R中,以生成用于拼接 和非拼接读取的计数表,使用具有K-近邻细胞池(kCells = 10)的基因相关模型估计RNA速度。
嵌合胚胎内人和猴细胞间相互作用的鉴定
使用CellPhoneDB(v2.0.1)基于配体-受体对,分析不同胚胎谱系中人和猴细胞之间的信号 传递(Vento-Tormo et al., 2018)。CellPhoneDB中所有配体-受体相互作用数据库都用于本次数 据分析。将所有嵌合细胞的表达谱及其信息,包括细胞类型(人类或猴细胞)和谱系信息 (EPI、HYP 和 EXMC)输入 CellPhoneDB,以推断两种类型细胞之间的潜在相互作用。使用校 正后的P<0.05作为阈值来识别两种类型细胞之间特异性表达的配体/受体,其他参数设置为默认 值。为了进行比较,上述数据集Human-1和monkey-1也进行相同分析。
结果
1、体外人猴嵌合囊胚的形成
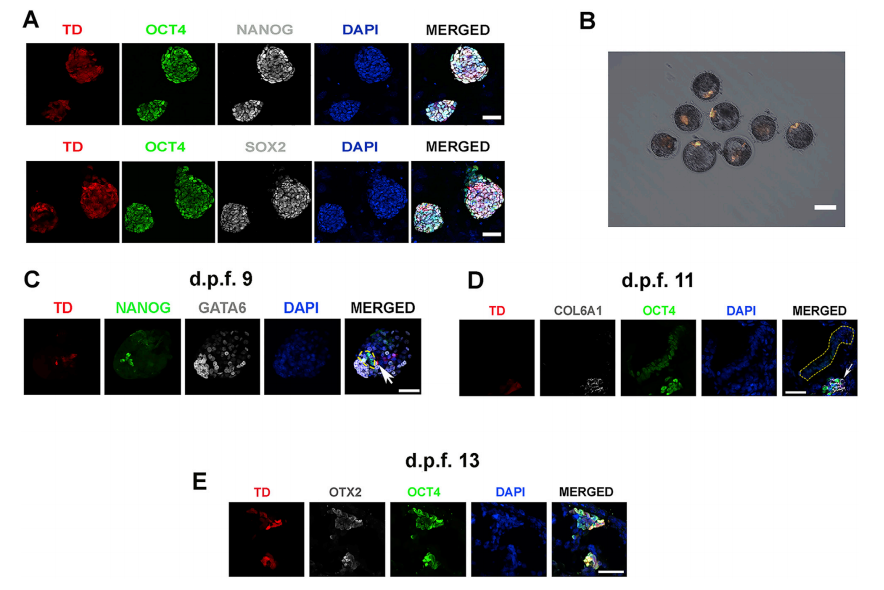
为确定非人灵长类动物中hPSC的嵌合能力,本研究使用了通过细胞重编程产生的特征明 确的hEPSC系iPS1-EPSC,它在小鼠胚胎第10.5天(E10.5)表现出优于其他hPSC(Yang et al., 2017)的嵌合性。与之前的报告一致,iPS1-EPSCs表现出圆顶形集落形态,并表达核心多能性 转录因子OCT4、NANOG和SOX2(图 S1A)。为了生成人猴嵌合胚胎,对食蟹猴的早期囊胚 (受精后 6 天 [d.p.f.6])注射了25个用tdTomato(TD)标记的iPS1-EPSC,注射的胚胎培养到 晚期囊胚阶段(d.p.f.7)进行分析,发现食蟹猴囊胚内hEPSC的增殖很明显。总的来说,在所 有d.p.f.7的食蟹猴囊胚中检测到TD+ iPS1-EPSCs(100%,n = 132)(图 S1B)。
 图S1 宿主食蟹猴胚胎中hEPSCs的谱系规范
图S1 宿主食蟹猴胚胎中hEPSCs的谱系规范
2、hEPSCs在食蟹猴胚胎中的嵌合作用
最新建立的延长胚胎培养系统可支持灵长类动物(人和猴)的离体胚胎发育到原肠胚阶段 (Deglincerti et al., 2016; Ma et al., 2019; Niu et al., 2019; Shahbazi et al., 2016; Xiang et al., 2020;Zhou et al., 2019)。在这个胚胎培养系统中,透明带被去除,裸露的囊胚附着在培养皿上进一 步发育,可使用该系统来追踪移植前后食蟹猴胚胎中hEPSC的分化。大约d.p.f.10左右,注射了 hEPSCs(92.79%, n = 111)的胚胎与未注射的对照(92.31%, n = 104)(Niu et al., 2019)类 似。附着后,注射的胚胎继续生长,胚胎盘在大约d.p.f.11时变得可见(图 1B)。在d.p.f.9 时,超过一半的胚胎中发现了TD+人类细胞,但这个比率在d.p.f.13时逐渐下降约1/3(图 1C)。为了确定引入的hEPSC是否会影响胚胎发育,本研究评估并比较了注射胚胎和对照胚胎 的发育状态(Niu et al., 2019),发现注射胚胎的发育比率略低于对照(图 1D)。此外,与对 照类似,注射胚胎的发育比率在大约 d.p.f.15 时急剧下降,这可能反映了2D附着胚胎培养系统 的局限性(图 1D)。
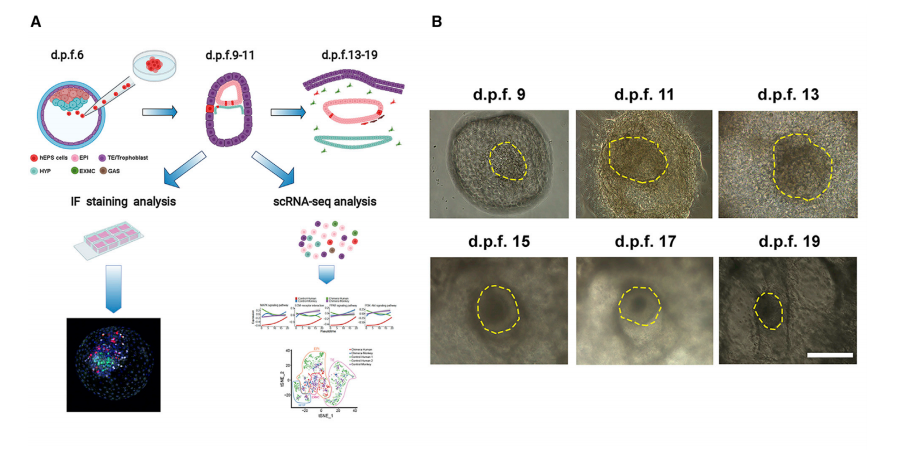
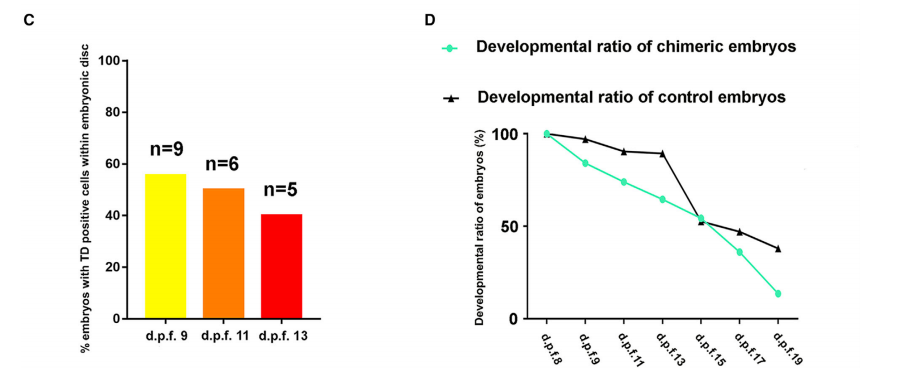 图1 人猴离体嵌合体的产生和发育能力
图1 人猴离体嵌合体的产生和发育能力
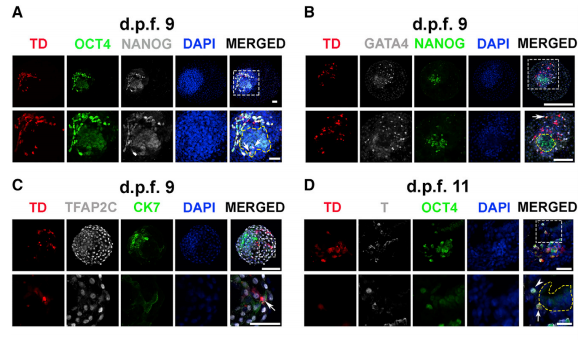
为研究食蟹猴胚胎中hEPSC的发育潜力,本研究使用几种胚胎和胚胎外谱系特异性抗体进 行了免疫荧光(IF)研究。在围植入期(d.p.f.9),平均有10.2±7.2(n = 9)个iPS1-EPSCs被 发现(在NANOG+或OCT4+食蟹猴细胞内或附近发现TD+ OCT4+细胞)(图 2A)。尽管这些 细胞表达OCT4,但只有少数细胞表达NANOG(图 S1C),没有在这些细胞中观察到GATA6 表达(一种下胚层【HYP】标记)(图 S1C)。 此外,还检测到TD+GATA4+ HYP-like细胞 (图 2B)。与小鼠中报道的结果相反(Yang et al., 2017),在食蟹猴囊胚的滋养外胚层 (TE)层中仅检测到少数iPS1-EPSC表达了TE标记基因(例如TFAP2C和CK7)(图 2C)。 在d.p.f.11时,食蟹猴胚胎的EPI层也检测到TD+OCT4+细胞,这些细胞很少表达原肠胚形成标志物T+(也称为Brachyury)。相比之下,在胚胎的背侧羊膜处检测到T+食蟹猴细胞(图 2D)。此外,在食蟹猴HYP细胞内发现表达HYP标志物、血小板衍生生长因子受体-α (PDGFRα)的TD+人类细胞(图 2E)。在EPI层外发现了表达COL6A1的OCT4+人类细胞, COL6A1是胚胎外间充质细胞(EXMC)的标志物,表明hEPSC正在向EXMC分化(图 S1D)。在 d.p.f.13时,EPI层下方检测到hEPSCs并表达内胚层标记物SOX17,表明它们已启动 原肠胚形成(图 2F)。有趣的是,本研究发现从d.p.f.13开始,人类细胞倾向于聚集在一起并 与食蟹猴EPI层分离,通过检测OTX2和OCT4的表达,发现这些人类细胞似乎已分化为原肠细 胞(Martyn et al., 2018; Vincent et al., 2003)(图 S1E)。总的来说,hEPSCs对EPI的贡献较高 (在d.p.f.15时的最高贡献值为7.08%),对HYP的贡献相对较低(在d.p.f.19时的最高贡献为 4.96%)(图 2G)。
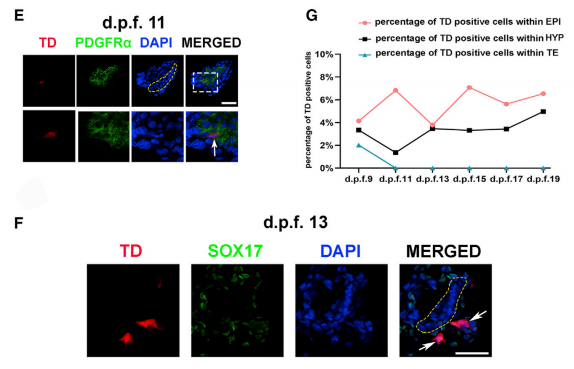 图2 hEPSCs有助于植入后食蟹猴胚胎中的嵌合体形成
图2 hEPSCs有助于植入后食蟹猴胚胎中的嵌合体形成
3、人猴嵌合胚胎的转录图谱
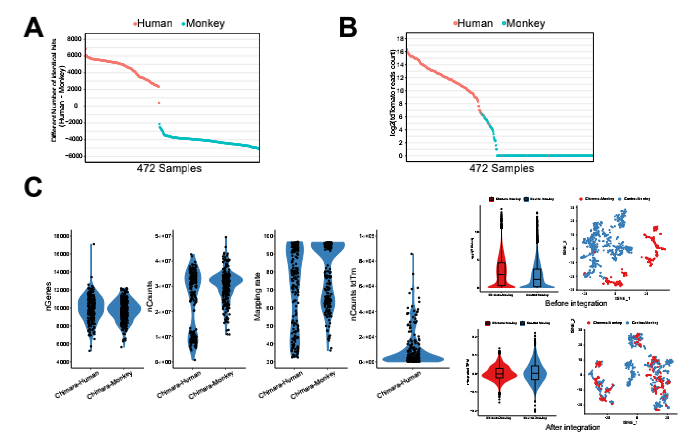
为进一步描绘人猴嵌合胚胎的发育轨迹,进行了scRNA-seq以分析不同发育阶段的人和猴 细胞的转录组。胚胎分离后,使用荧光显微镜手动收集单个人类(TD+)和猴(TD-)细胞并 进行scRNA-seq。对离体培养过程中不同时间点从嵌合胚胎中分离的227个人的和302个食蟹猴 的细胞进行了测序(d.p.f.9-d.p.f.17)。TD表达和比对到人类或食蟹猴基因组的reads用于进一步确认每个细胞的来源物种(图 S2A 和 S2B)。严格过滤后,200 个人的和 272 个食蟹猴的细 胞用于进一步分析。每个细胞平均检测到 9,798 个基因(每百万转录本【TPM】>0)和 27,936,953条reads,在人和猴细胞之间检测到的基因数量和reads没有统计学差异(图 S2C)。 为进行比较,本分析中还选择了已发表的食蟹猴和人类胚胎细胞的scRNA-seq数据集 (Nakamura et al., 2016; Niu et al., 2019; Xiang et al., 2020; Zhou et al., 2019)。为避免不同数据 集的批次影响,本研究使用“锚定”方法去除批次效应(Stuart et al., 2019)(图 S2C)。
图S2 细胞物种来源鉴定和QC
对scRNA-seq数据进行了t-SNE分析,确定了所有样本(嵌合胚胎和对照胚胎)中存在4个 主要细胞cluster:EPI、HYP、TE和EXMC(图 3A、3B和S2D)。通过细胞特异性marker分 析,发现人和食蟹猴之间存在保守性(图 S2E)(Zhou et al.,2019)。嵌合胚胎中这些细胞类 型的存在表明宿主胚胎的发育基本上不受注射的hEPSCs的影响(Ma et al., 2019; Niu et al., 2019)(图 1B 和 1D)。系统发育树分析(基于基因表达水平)显示,虽然嵌合胚胎中的大 多数食蟹猴细胞分离成不同的细胞类型特异性簇(EPI、HYP和TE),但嵌合人类HYP-和TE- like 细胞与 EPI-like 细胞聚集在一起(图 3C)。因此,嵌合食蟹猴细胞比引入的hEPSC表现出 更强的谱系分离。与IF结果一致,在scRNA-seq数据(图 3A 和 3D)中鉴定到的人类TE-like细 胞很少,因此被排除在后续分析之外。这些结果表明,hEPSCs在被引入食蟹猴早期囊胚并进 行离体胚胎培养后,可以分化为几种植入前和植入后早期细胞类型。
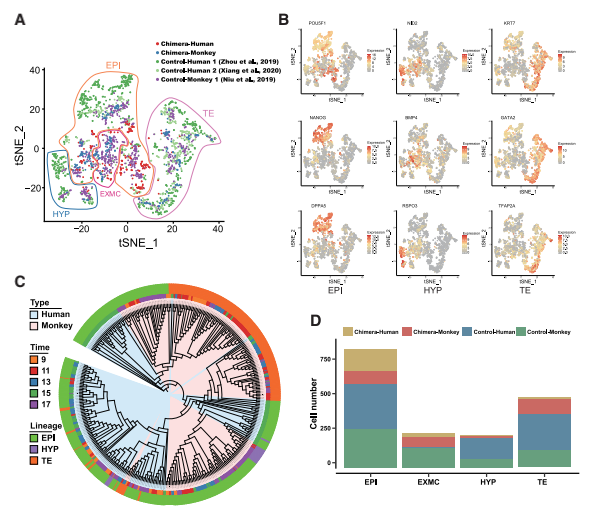 图3 人猴嵌合胚胎的单细胞转录图谱
图3 人猴嵌合胚胎的单细胞转录图谱
4、hEPSCs在人猴嵌合体发育过程中的转录组动力学
首先基于所有细胞的转录组学特性构建了一个导向图(SPRING)(Weinreb et al., 2018),所有细胞分为三个分支:EPI、HYP和TE(图 4A),明确了嵌合体和对照(人和食 蟹猴)胚胎之间基因表达模式的相关性(图 4B)。当嵌合人类细胞与对照人类(0.460)或对 照食蟹猴(0.459)细胞进行比较时,获得了类似的相关系数(图 4B,右图),但与对照胚胎 相比,嵌合猴细胞的相关系数高于嵌合人类细胞(图 4B,左图);接下来发现嵌合人EPI-like 细胞与人胚胎中的EPI细胞相似,而嵌合人HYP和EXMC-like细胞分别与嵌合猴HYP和EXMCs 细胞相关系数最高(图 4C)。同时发现嵌合人类EPI-like细胞逐渐倾向于嵌合猴EPI细胞,R2 值从0.363(植入前EPI [Pre_EPI])增加到0.464(植入后EPI [PostL_EPI]),再增加到0.693 (原肠[Gast]细胞)(图 4C)。以上结果表明猴胚胎微环境对人类细胞的基因转录状态产生影 响,反之亦然。
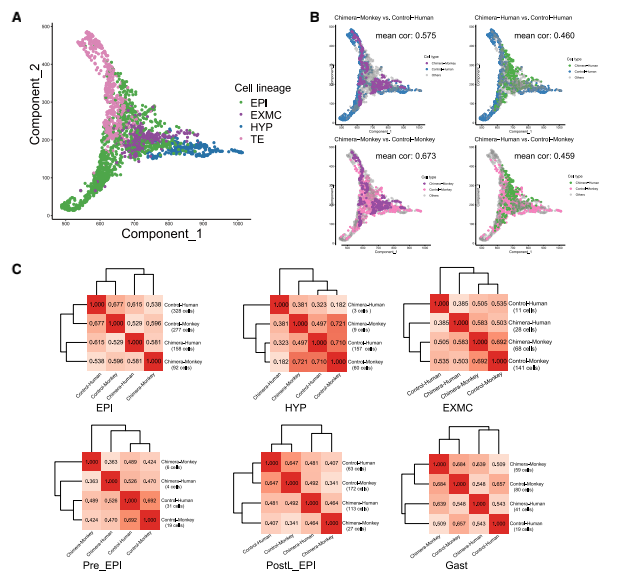
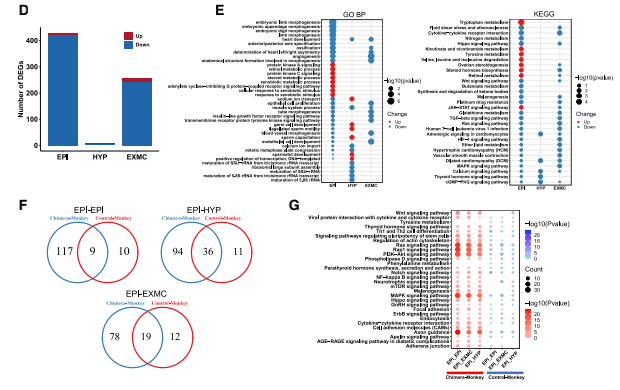 图4 嵌合胚胎的发育轨迹
图4 嵌合胚胎的发育轨迹
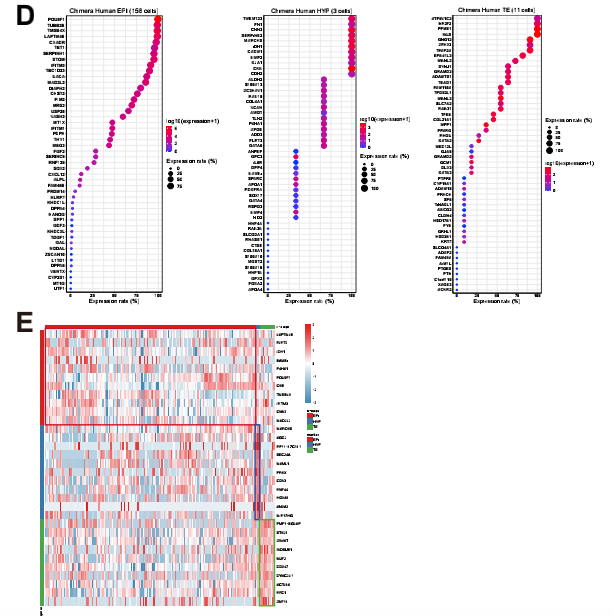
由于食蟹猴的细胞在人类细胞存在下表现出转录组的变化,接下来分析了嵌合胚胎中食蟹 猴细胞的发育动态。首先确定了嵌合猴胚胎和对照猴胚胎之间的差异表达基因(DEG)。EPI 细胞、HYP细胞和EXMCs细胞与对照胚胎相比,嵌合体细胞中分别有424、7和241个基因下 调,5、2 和13个基因上调(图 4D 和 S3A)。GO和KEGG富集分析确定了在嵌合猴EPI细胞、 HYP细胞和EXMCs细胞中上调和下调基因的信号通路,如Hippo和转化生长因子β(TGF-β) 信号通路分别在嵌合猴EPI细胞和EXMCs细胞中下调(图 4E)。 已经证明食蟹猴EPI细胞的转录组谱在嵌合胚胎中发生了改变,接下来研究了食蟹猴EPI胚 胎生态位是否也受到人类细胞的影响。CellPhoneDB(v2.0.1)(Vento-Tormo et al., 2018)可 鉴定嵌合胚胎和对照胚胎中EPI和其他谱系(HYP 和 EXMCs)之间细胞的潜在相互作用。结果发现与对照胚胎相比,嵌合胚胎中有更多的配体-受体相互作用(如,在猴EPI细胞中检测到 117个 [嵌合] 与10个 [对照] 特异性配体-受体相互作用)(图 4F 和 S3B)。进行KEGG分析发 现,嵌合胚胎中被加强的信号通路包括磷脂酰肌醇 3-激酶 [PI3K]-Akt、丝裂原活化蛋白激酶 [MAPK] 信号通路和WNT信号通路(图 4G)。使用相同的方法,还确定了嵌合胚胎内人和猴 细胞-细胞的相互作用,如FGF5-FGFR4、NOTCH4-JAG2、WNT2B-FZD4、WISP3-SORL1和 PLXNB2- PTN(图 S3C 和 S3D)。结果表明,嵌合胚胎内的细胞间相互作用得到加强,并可 能导致其他信号通路的激活。
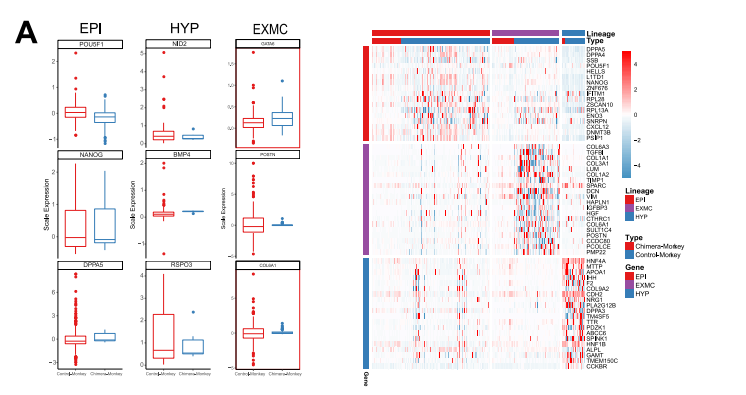
 图S3 嵌合胚胎与宿主胚胎食蟹猴细胞对比分析
图S3 嵌合胚胎与宿主胚胎食蟹猴细胞对比分析
5、嵌合的人类EPI-like细胞显示出独特的发育轨迹
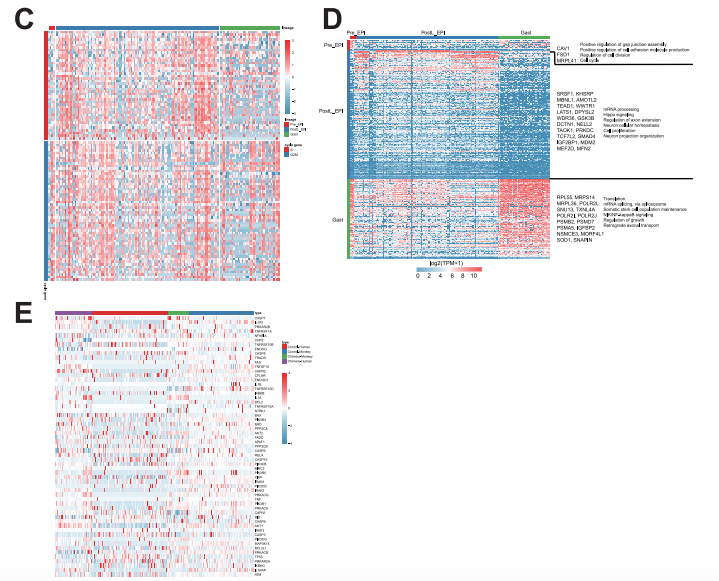
EPI发展的特点是进行多能性转变,可能在物种之间表现出不同的动态。适当的EPI分化对 于嵌合体的形成和发育至关重要,本研究对嵌合胚胎内人类EPI-like细胞的谱系分化进行了研 究,并将其与体外培养的人类和食蟹猴胚胎的数据集进行了比较(Nakamura et al., 2016; Niu et al., 2019; Zhou et al., 2019),结果人类EPI-like细胞在植入前、植入后和原肠胚形成阶段被鉴定,并且在每个阶段表达不同的标记物(图 5A 和 S4A-S4C),桑基图也显示了相同的人类EPI- like细胞发育轨迹(图 S4D)。接下来观察到hEPSCs更类似于早期PostE_EPI和PostL_EPI细胞。 嵌合体中人PostL_EPI-like细胞与制备的PSC的相关性高于naive PSC(图 S4E)。为了进一步研 究 hEPSC(Yang et al., 2017b)、嵌合体人类 EPI-like细胞和宿主猴EPI细胞的转录动力学,本研 究进行了RNA速度(La Manno et al., 2018)和Slingshot分析(Street et al., 2018)(图 5B),结 果发现两种不同的RNA速度向量模式:嵌合体人类PostL_EPI-like细胞向量较长,而原肠胚细胞 向量较短;宿主猴PostL_EPI细胞缺乏长向量,而原肠细胞具有长向量(图 5B,左边两张 图)。这些结果表明嵌合人类EPI-like细胞的发育延迟。Slingshot分析显示,hEPSCs在注入食蟹 猴囊胚后,是从EPSCs到PostL_EPI再到原肠胚的发育轨迹(图 5B,右图)。为了进一步描绘嵌 合人类EPI-like细胞的发育轨迹,将所有与EPI相关的人类和猴子reads映射到一个共有基因组, 并使用先前报道的方法(Kanton et al., 2019)预测物种之间EPI的发育轨迹,与RNA速度分析一 致,发现嵌合人类EPI-like细胞比来自宿主猴、对照猴和人类胚胎的EPI细胞分化得更慢(图 5C)。这些结果表明,hEPSCs向EPI谱系的特化和/或分化效率低于胚胎细胞。
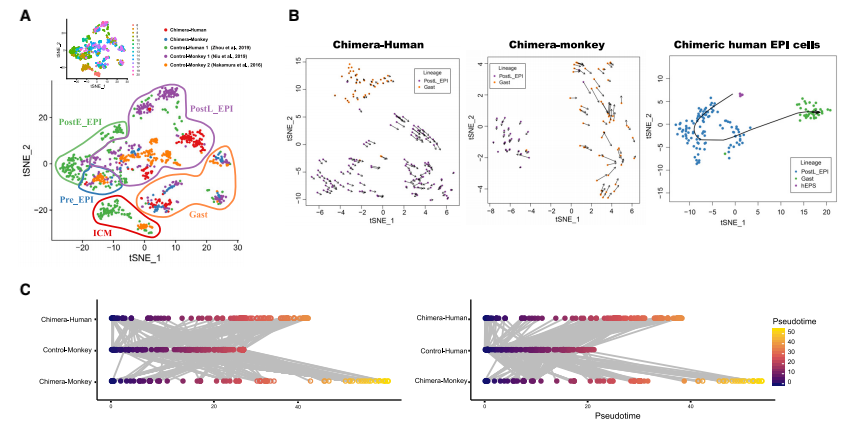
 图5 食蟹猴胚胎中嵌合人EPI-like细胞的发育轨迹
图5 食蟹猴胚胎中嵌合人EPI-like细胞的发育轨迹
为了进一步描绘嵌合体人类EPI-like细胞发育的潜在过程,本研究绘制了嵌合胚胎内的人类 EPI-like细胞和食蟹猴EPI细胞、对照人和猴胚胎的EPI细胞之间的DEG维恩图,发现嵌合体人 EPI-like细胞和来自对照猴胚胎的EPI细胞之间交集基因315个(图 5D),对这些基因进行KEGG 分析,确定了PI3K-Akt、MAPK和过氧化物酶增殖激活受体(PPAR)信号通路,表明它们可能 参与人类EPI-like细胞向食蟹猴EPI细胞的转移过程(图 5E和5F)。同时还发现了许多可能在调 节嵌合体人类EPI-like细胞发育中发挥重要作用的关键基因,如CHD2、POLR2A和RB1(图 S5A 和 S5B)。此外,还发现大多数嵌合体人类EPI-like细胞表达S/G2/M细胞周期相关基因,而嵌合 体和对照人、猴胚胎细胞凋亡相关的基因表达水平无显著差异(图 S5C 和 S5E)。Pre_EPI、 PostL_EPI和原肠胚形成细胞中DEG的GO分析显示嵌合体人类EPI-like细胞比正常细胞分化慢 (图 S5D)。这些分析揭示了驱动食蟹猴胚胎内嵌合体中人EPI-like细胞的不同谱系分化动力学 相关的信号通路和因素。
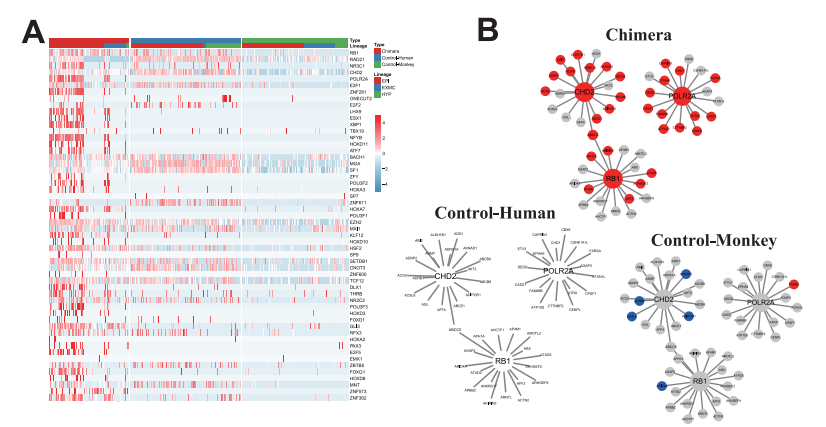
 图S5 嵌合体EPI细胞的调控网络分析
图S5 嵌合体EPI细胞的调控网络分析
结论
本研究结果初步证实了胚胎发育早期人类和猴细胞混合时发生的细胞和分子事件,结果揭示了灵长类动物胚胎发生过程中的进化趋同和发散的过程。这一系列基础研究将有助于改善进 化距离更远的物种的人类嵌合现象,出于各种原因,包括社会、经济和伦理,这些物种可能更 适合再生医学转化疗法。
本研究局限及后续研究方向
尽管本研究中使用了相对大量的食蟹猴胚胎(132),但由于嵌合体实验固有的随机性,并 考虑到可能影响种间嵌合现象的所有因素,后续需要更大食蟹猴胚胎的数量进行扩展分析。因 此本研究的局限性:(1)只测试了猴胚胎中hEPSC的嵌合能力,没有研究人类或其他物种的其 他多能干细胞,(2)没有测试不同hEPSC数量对食蟹猴胚胎的影响,以及(3)无法测试不同 的注射阶段。因此后续可针对本研究的不足,设计更大样本量、更多多能干细胞种类以及探究 不同多能干细胞数量对嵌合体胚胎的影响,为实现再生医学转化提供更多理论基础。







 京公网安备 11011302003368号
京公网安备 11011302003368号