百迈客单细胞和空间转录组测序
单细胞转录组测序(scRNA)是在单细胞水平进行高通量基因表达谱检测,对复杂细胞群深入分析,表征单个细胞的表达谱,避免单个细胞的异质性生物学信息被大量细胞的均质化覆盖。
空间转录组(ST)是以高空间分辨率解析RNA-seq数据的技术,实现解析单个组织切片中的所有mRNA,从而能够定位和区分功能基因在特定组织区域内的活跃表达信息,对于癌症、免疫、肿瘤免疫相互作用,组织微环境,神经和发育等领域,有着令人期待的应用前景。

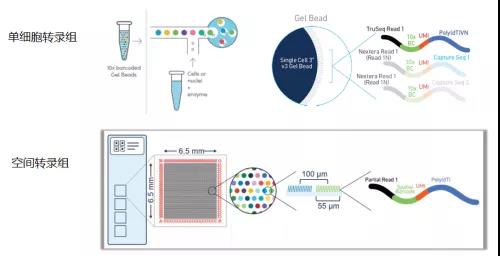
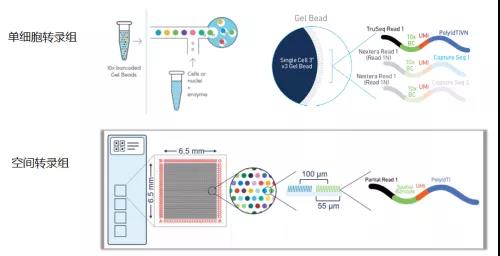
单细胞和空间转录组技术原理对比:
导读
肝转移是结直肠癌死亡的主要原因,其免疫微环境(TME)表现出高度异质性。本研究使用单细胞RNA-seq和空间转录组学对97个配对的样本进行测序。发现转移灶免疫微环境经历了免疫抑制细胞(如MRC1+ CCL18+ M2样巨噬细胞)的空间重编程,并发现巨噬细胞具有较强的代谢活性。同时,新辅助化疗可以阻断这种状态并恢复患者的抗肿瘤免疫平衡。本研究解析了结直肠癌肝转移的免疫细胞进化轨迹,并揭示了肿瘤对新辅助化疗的不同反应。
实验方法
材料:癌及癌旁组织样本
(1)人组织样本:20名患者(未治疗患者n = 11;PD/SD患者n = 5;PR患者n = 4)的89个组织样本进行了scRNA-seq;4名患者(未治疗患者n = 2;PR患者n = 2)的组织ST测序;27名患者的104个样本进行mIHC分析(未治疗的CRC和癌旁组织n = 17;未治疗的LM和癌旁组织n = 18;已治疗的PR CRC和癌旁组织n = 9;已治疗的PR LM和癌旁组织n = 8)
(2)小鼠组织样本:4只小鼠发生肝转移,1只小鼠发生结直肠腹膜转移:原发性肿瘤(n = 4)和转移性肿瘤(n = 5)进行scRNA测序
方法:单细胞转录组测序、空间转录组测序、mIHC
研究结果
1、单细胞和空间转录组学绘制可切除CRLM中的免疫细胞多样性
为了获得CRLM的单细胞图谱,本研究应用scRNA-seq和ST来量化CD45+细胞的动力学(图 1A),使用结直肠癌(CRC)组织及癌旁、肝转移(LM)组织及癌旁,沿结肠的淋巴结(LN)组织和外周血单核细胞(PBMC)。根据严格的筛选标准,共招募24 名可切除的CRLM患者。最终共计20名患者的89份样本进行了scRNA-seq,4名患者的8份样本进行了ST测序,其中包括未接受治疗的13名患者的54份样本,新辅助化疗后PR的6名患者的30份样本,新辅助化疗后PD或SD的5名患者的13份样本(图 1A)。所有肿瘤均为微卫星稳定。
来自未治疗患者(n = 11)的79,703个细胞、来自NAC PD/SD患者(n = 5)的36,284 个细胞和来自NAC PR患者的62,643个细胞(n = 4)用于进一步分析。每个样本平均包含2,007个细胞,每个细胞中1,064个基因(中位数),在不同样本之间没有明显的批次效应。整合所有178,630个CD45+细胞,进行了聚类分析,并使用SingleR和细胞marker基因注释主要细胞类型。与之前的结肠癌scRNA-seq基本一致,本研究从CRLM样本中鉴定到了骨髓细胞、CD8+ T细胞、CD4+ T细胞、NK细胞和B细胞(图 1B、1C)。值得注意的是,不同组织类型的T细胞比例明显不同,表明免疫微环境的组织异质性(图 1D)。CRC和配对LM样本中所有CD45+细胞中Treg细胞约占10%,而这些细胞在相邻的正常组织中很少见,这表明肿瘤内免疫受到抑制,这之前被归因于肝转移中免疫治疗效果降低。同样,本研究整合了SingleR和基于marker基因的手动注释,进一步注释了免疫细胞亚群(图 1E)。
本研究分析了来自2名未治疗患者和2名NAC PR患者的8个样本(配对的CRC和 LM)的ST数据(图 1F、1G)。无监督聚类分析将样品分为不同的区域,例如肿瘤细胞和成纤维细胞区域(图 1F)。为了整合scRNA-seq和ST数据,本研究使用Seurat来量化主要免疫细胞亚群。在未经处理的样本中,观察到与scRNA-seq一致的免疫细胞模式,例如CD8+T细胞在LM和CRC中的显著富集(图 1G)。相比之下,在NAC处理的样本中,观察到较小的肿瘤区域和免疫细胞的不规则分布,特别是在LM中,只有一小部分spot聚集在癌细胞中,表明NAC治疗后细胞区室的重塑。总之,结果突出了CRLM患者的免疫细胞时空图谱和NAC后免疫细胞的重塑。CRLM单细胞图谱现已在线提供,用于探索原发和转移部位的免疫多样性(http://www.cancerdiversity.asia/scCRLM)。
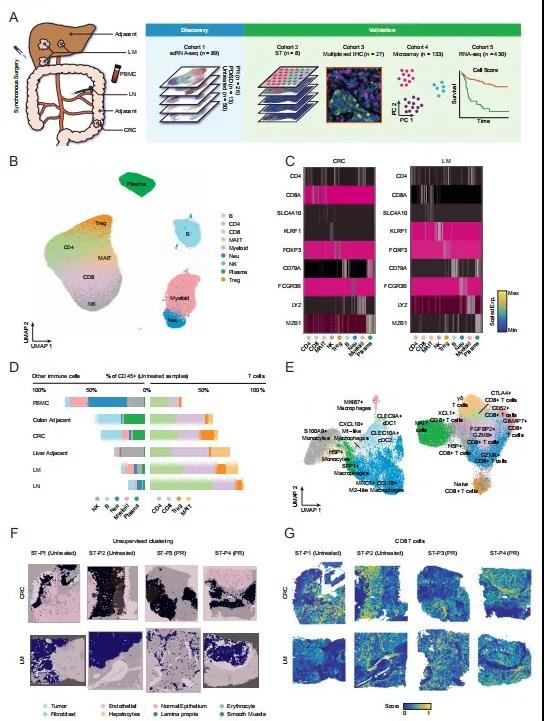 图1 scRNA-seq和空间转录组学揭示CRLM的免疫细胞图谱
图1 scRNA-seq和空间转录组学揭示CRLM的免疫细胞图谱
2、转移性肿瘤的巨噬细胞可能转向抑制状态
本研究进行了基于配体-受体的癌症-免疫串扰分析,并在原发部位和转移部位之间进行比较(图 2A),发现SPP1+巨噬细胞和MRC1+ CCL18+巨噬细胞在LM和CRC之间的差异较大,这一结果表明肝转移癌细胞可能优先重编程巨噬细胞并诱导其特定的功能状态(图 2A)。值得注意的是,LM中的转移性肿瘤细胞优先表达配体CD47,这是一个重要的检查点,因此可能招募相应的受体SIRPA或激活MRC1+ CCL18+巨噬细胞(图 2B)。进一步利用mIHC来可视化这些蛋白质,观察CD47+肿瘤细胞和SIRPA+巨噬细胞之间的串扰(图 2C)。这些配体-受体对为靶向治疗肝转移提供了线索。
对CRC和LM巨噬细胞进行了差异基因表达分析,结果发现LM的MRC1+ CCL18+巨噬细胞高度表达了对巨噬细胞极化至关重要的广谱关键分子(图 2D)。APOE作为抗炎和pro-M2转化蛋白,是显著差异表达的基因之一,其他M2极化相关基因如MARCO在LM的MRC1+ CCL18+巨噬细胞中也显著上调(图 2E)。相比之下,CRC的MRC1+ CCL18+巨噬细胞表现出更高的炎性细胞因子表达,包括TNF、IL1B、CCL3和CCL4。在SPP1+巨噬细胞中也观察到这种基因表达谱的变化,表明巨噬细胞具有从原发部位到转移部位的共同功能变化。通路富集分析显示(图 2F)CRC和LM的MRC1+ CCL18+巨噬细胞在代谢通路中高度富集,证明这些巨噬细胞在代谢功能中的基本作用。值得注意的是,CRC中的MRC1+ CCL18+巨噬细胞富含氧化磷酸化,而它们在LM中则以氨基酸代谢为主。这些数据证明,代谢调节可能介导巨噬细胞响应不同的免疫微环境。
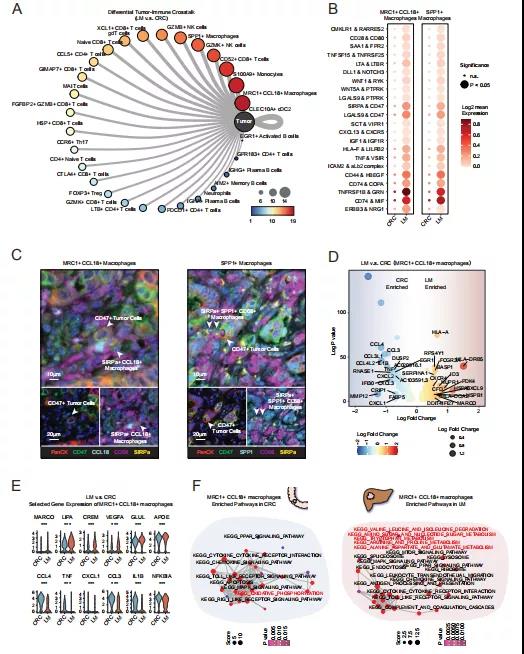 图2 转移性肿瘤中MRC1+ CCL18+巨噬细胞表现出终末分化和抑制状态
图2 转移性肿瘤中MRC1+ CCL18+巨噬细胞表现出终末分化和抑制状态
3、MRC1+ CCL18+巨噬细胞在肝转移中的代谢活性急剧增加
为了解CRLM中髓样细胞的代谢情况,首先计算了抑制性巨噬细胞和单核细胞中76种活跃代谢途径的得分,选择了前50%的可变代谢评分,并根据其平均代谢评分对骨髓细胞(不包括低丰度的骨髓细胞)进行了排名(图 3B),发现LM浸润的MRC1+ CCL18+巨噬细胞在所有骨髓细胞中表现出最高的代谢活动,这可能与它们在转移部位的独特功能有关。通过对MRC1+ CCL18+巨噬细胞的所有代谢相关基因的进一步无监督聚类,发现其与周围组织较强的代谢偏好(图 3C),确定了CRC和LM免疫浸润的MRC1+CCL18+巨噬细胞中可能上调的42种代谢途径。其中,苯丙氨酸代谢有助于产生酪氨酸,在LM的MRC1+ CCL18+巨噬细胞中表达更高。随后研究了差异表达的代谢基因,发现原发性和转移性MRC1+ CCL18+巨噬细胞中特异性上调的代谢基因,部分是已知药物的靶基因(图 3C)。GSTO1是细胞色素P450代谢的一种酶,在CRC和LM浸润的MRC1+CCL18+巨噬细胞中显著升高,并与分化相关(图 3D 和 3E)。巨噬细胞激活所必需的基因IL4I1和MIF也显示出相似的特征(图 3D 和 3E)。mIHC验证这些代谢酶,观察到基本一致的结果(图 3F)。
接下来构建CRLM的小鼠模型(图 3G)并将scRNA-seq应用于原发性/转移性肿瘤。结果在小鼠CRLM模型中发现了类似的巨噬细胞亚群,例如Mrc1+巨噬细胞和Spp1+巨噬细胞(图 3H)。没有观察到这些巨噬细胞在原发部位和转移部位之间的显著差异比例,可能是由于原发肿瘤是在皮下而不是在结肠中建立的。进一步的代谢分析显示了LM和CRC浸润巨噬细胞的特征代谢状态(图 3I)。检查了前3条差异表达途径(小鼠模型中的LM与CRC),其中一些在人和小鼠中是保守的。例如,氧化磷酸化和苯丙氨酸代谢在人和小鼠巨噬细胞之间是一致的。苯丙氨酸代谢的关键酶Mif的表达也与人CRLM一致。总之,LM中的巨噬细胞代谢活性急剧增加,例如苯丙氨酸代谢。抑制这种代谢活动可能会调动抗肿瘤免疫反应来控制晚期CRC的肝转移。
为了说明代谢重编程与巨噬细胞表型变化的关联,本研究计算了巨噬细胞的经典通路评分,例如抗原加工、呈递、炎症、血管生成、免疫抑制、吞噬作用、白细胞介素信号通路和补体评分(图 3J)。在LM中,MRC1+ CCL18+巨噬细胞的抗原加工和呈递以及补体活性评分显著增加(图 3J),SPP1+巨噬细胞也显示出类似的趋势。某些基因如HLA-A(MHC I类分子之一)在LM的MRC1+ CCL18+巨噬细胞中上调。进一步分析了42种肿瘤高代谢途径与MRC1+ CCL18+巨噬细胞通路评分之间的相关性,发现包括戊糖和葡萄糖醛酸互变在内的几种巨噬细胞特异性代谢途径与LM中的抗原加工和呈递有很强的相关性,但在CRC的相关性很弱(图 3K)。这些数据表明不同的代谢功能在MRC1+ CCL18+巨噬细胞表型中的潜在作用。
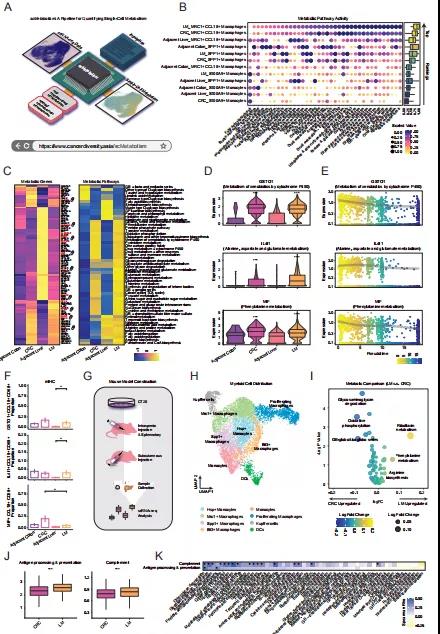 图3 转移性肿瘤中的MRC1+ CCL18+巨噬细胞显示出高代谢活性
图3 转移性肿瘤中的MRC1+ CCL18+巨噬细胞显示出高代谢活性
4、NAC反应性和非反应性肿瘤具有不同的免疫动力学
为探索NAC对肿瘤免疫的影响,本研究使用TooManyCells对所有CD45+细胞进行聚类分析,发现CRC和LM之间细胞聚类的显著差异(图 4A)。NAC对TME的影响高度依赖于细胞类型(图 4B和4C)。通常,在PR中,NAC可以下调免疫抑制细胞并激活细胞毒性细胞(图 4B)。在LM中,响应性NAC下调SPP1+巨噬细胞但上调细胞毒性T细胞,例如GZMK+CD8+ T细胞和XCL1+CD8+ T细胞(图 4B和4D)。NAC-PR中仅剩下几个MRC1+ CCL18+巨噬细胞和几十个SPP1+巨噬细胞,表明NAC在抑制巨噬细胞中的潜在作用。然而,在PD/SD中,观察到与PR不同的免疫细胞变化。例如,SPP1+巨噬细胞和MRC1+ CCL18+巨噬细胞在LM中增加,而细胞毒性免疫细胞(即FGFBP2+ GZMB+ CD8+ T细胞)下调(图 4C、4E和4F)。这些结果可能与癌细胞的器官特异性和治疗效果有关。例如,转移性PD/SD癌细胞表现出DNA修复和脂肪酸代谢的特异性富集,而转移性PR癌细胞与脂肪生成更相关。除肿瘤组织外,NAC上调邻近正常肝脏中GZMB+CD8+ T细胞的比例,并增加PR患者PBMC中FGFBP2+GZMB+CD8+ T细胞的比例。对于PD/SD患者,在邻近结肠和肝脏中也观察到FGFBP2+ GZMB+CD8+ T细胞水平降低。总之,有效的NAC不仅重新编程了肿瘤内免疫平衡,还激活了全身抗肿瘤免疫反应,为支持NAC在可切除CRLM中的潜在作用提供了证据。
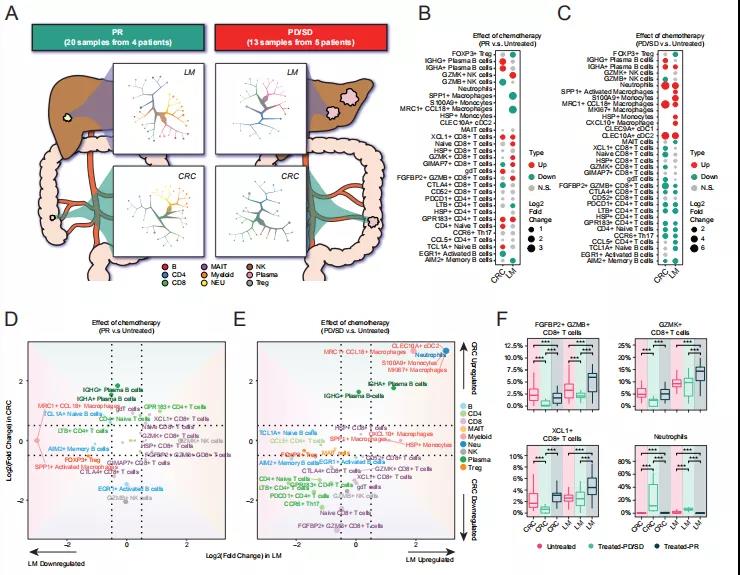 图4 新辅助化疗通过激活细胞毒性免疫细胞和抑制转移性肿瘤中的免疫抑制细胞来恢复免疫平衡
图4 新辅助化疗通过激活细胞毒性免疫细胞和抑制转移性肿瘤中的免疫抑制细胞来恢复免疫平衡
结论
本研究展示了CRLM的空间和细胞图谱,并确定了新辅助化疗对TME的功能影响,加深了我们对CRLM免疫生物学的理解。本研究对发生转移时激活的代谢途径进行了深入分析,为癌症转移生物学研究提供独特的见解。
原文链接:
https://international.biocloud.net/zh/article/detail/34417225







 京公网安备 11011302003368号
京公网安备 11011302003368号