研究背景
肝脏由超过20种细胞类型组成,包括肝细胞、肝内皮细胞、胆管细胞、间皮细胞、ER细胞和各种循环免疫细胞。在人类胎儿的发育过程中,肝脏是重要的造血器官。造血干细胞和祖细胞(HSPC)在大约6周时在人体内迁移到肝芽中。然后,胎儿肝脏成为主要的造血器官,并为HSPC增殖和分化提供了特定的生态位。肝脏是人体的重要器官之一,易受体内外多种致病因素的影响,引起炎症和损伤。肝脏疾病是导致发病率和死亡率的主要因素。此外,肝脏有很强的再生能力。肝部分切除术后,肝脏的再生依赖于残余肝组织的再生能力。因此,对胎儿肝脏发育的研究对于我们了解肝脏发育和再生机制也至关重要。
结论
本文中作者结合了单细胞RNA测序和空间转录组学(ST)技术的优点,对人类从受孕后8周(PCW)到17周(PCW)的胎儿肝脏进行了分析。系统地鉴定了9种细胞类型,并确定了主要细胞类型的发育途径。结果表明,人胎肝在实验期间经历了血液的快速生长和迁移,并鉴定了红系细胞发育过程中的差异表达基因和代谢变化。此外,作者还对肝病相关基因的表达进行了研究,发现17个已发表并与肝病相关的基因主要在巨核细胞和内皮细胞中表达,在其他细胞类型中几乎不表达。总之,作者的研究结果提供了一个全面而清晰的了解人类胚胎肝脏中所有主要细胞类型的分化过程,这可能为肝脏疾病的治疗和肝脏再生提供参考数据和信息。
中文题目:整合空间转录组学和单细胞转录组揭示了人类胚胎肝脏的基因表达谱
英文题目:Integrating Spatial Transcriptomics and Single-Cell RNA-seq Reveals the Gene Expression Profling of the Human Embryonic Liver.
期刊:Front Cell Dev Biol
发表时间:2021.5
作者:Xianliang Hou
材料与方法
材料:受孕后8周和17周人类发育中的肝组织;
方法:10× Genomics Visium Spatial Gene Expression Slides。
实验结果
一、细胞聚类与类型鉴定
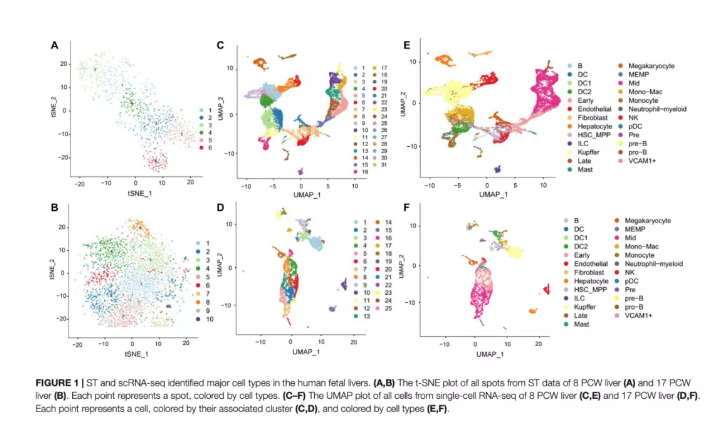
为了研究胎儿肝脏中免疫细胞和红细胞的发育,作者利用ST技术分析了人类肝脏发育过程中基因表达的时空动态。在筛选数据后,在8周PCW肝脏中检测到1267个高质量spots,平均每个spot包含204,628条reads,检测到1,132个基因和5,924个UMIs。在17周PCW中,肝脏由3,489个单独spots组成,平均78,576条reads,8,829个UMI,过滤后每个点检测到2,266个基因。通过对每个ST阵列的spots进行降维和聚类,根据基因表达模式在8周PCW肝脏(图1A)和17周PCW肝脏(图1B)中确定了6个和10个主要cluster。由于ST缺乏细胞分辨率,作者利用scRNA-seq技术研究了8周PCW和17周PCW活组织的基因表达异质性。在应用质量控制过滤器和标准化后,scRNA序列数据分别25,186个细胞和9,153个细胞组成,每个细胞中有2,454和2,705个独特表达的基因。为了探索活体器官的细胞组成,作者处理了单细胞数据,并在8和17周PCW肝脏中鉴定了31和25种细胞状态,每种状态都根据文献中已知的标记基因进行了注释(图1C-F)。作者将这些cluster鉴定为B细胞、树突状细胞(DC)、DC1、DC2、早期成红细胞、内皮细胞、HSC_MPP、成纤维细胞、肝细胞、kuper、ILC、晚期成红细胞、MEMP、肥大细胞、巨核细胞、中成红细胞、单核细胞、中性粒细胞、NK、pDC、Pre、Pre-B、Pro-B和VCAM1+。
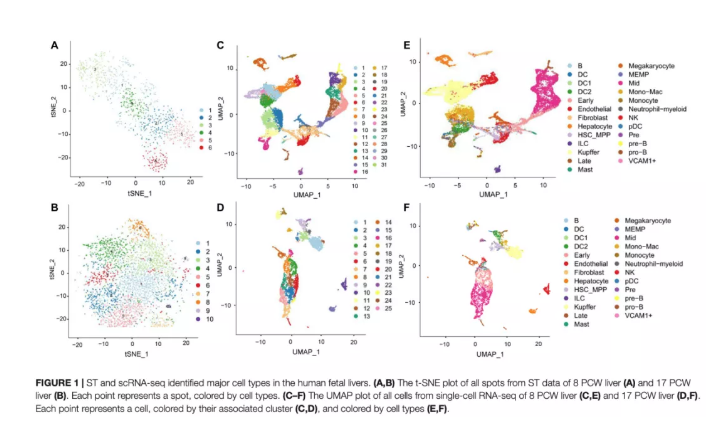
图1
二、Multimodal交互式分析
为了整合scRNA-seq和ST数据集,作者应用了先前报道的Multimodal Intersection Analysis(MIA)进行分析。通过MIA方法发现在跨空间区域识别细胞类型的消耗和富集方面是稳健的(图2A,B)。例如,作者发现肝细胞、kuper细胞、内皮细胞和巨核细胞的高表达基因在ST和scRNA序列数据之间显著重叠(图2C)。8周 PCW肝脏由kuper、中成红细胞、肝细胞、晚期成红细胞、早期成红细胞组成(图2D)。17 周PCW肝脏由肝细胞、中性粒细胞、早期成红细胞、中期成红细胞、晚期成红细胞、巨核细胞、内皮细胞和巨核细胞组成(图2E)。基于平均对数变化,每个cluster的前10个基因的热图显示了cluster之间的高度异质性(图3A,B)。此外,作者在每种细胞类型中选择一个最明显的特征基因,并以点图的形式呈现以比较差异(图3C)。根据转录相似性,用单核细胞按预测的发育轨迹(拟时序)组织细胞。它产生了一个紧密相连的分化轨迹,分为两个主要分支,分别对应于不同时期的8和17 PCW(图3D)
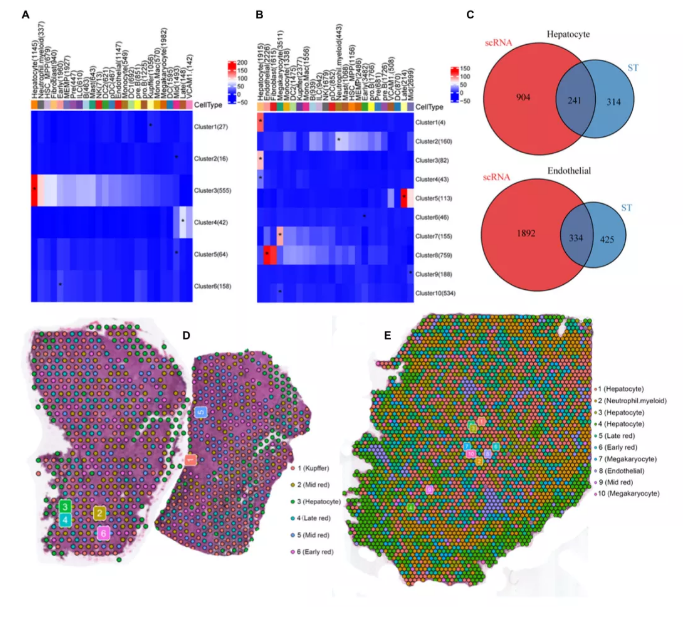
图2
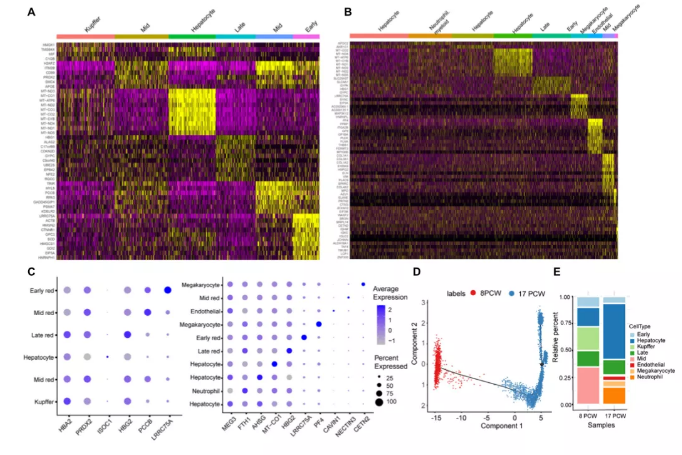
图3
三、人胎肝细胞的空间分辨异质性
如图3E所示,肝细胞是17 PCW肝脏的主要实质细胞。作者观察到三个不同的肝细胞cluster(cluster1、3和4)沿着17周PCW肝脏的空间深度分布(图4A、B)。作者发现MEG3、ITIH3和HMGCS1呈cluster1高表达。FGB、IGFBP1和A2M基因在cluster3中表达更高,表明区域DEGs可能参与了相应区域特异性功能的形成。此外,cluster4组中的肝细胞高表达数个基因,包括MT-CO1、MT-CO2、MT-CO3,它们参与线粒体电子传递和氧化磷酸化。值得注意的是,cluster1和3主要聚集在肝组织的中心区域,cluster4主要聚集在肝的周围区域(图4a)。差异表达分析的热图显示肝细胞分化过程中逐渐下调或上调的基因。GO分析表明,1-3-4cluster中逐渐上调的基因主要与细胞极性通路、Wnt信号通路和GTPase活性的调节有关,而逐渐下调的基因则参与坏死细胞死亡、糖原生物合成过程的调节,肝脏再生。此外,作者描述了cluster1-3-4细胞之间的细胞通讯(图4C),为将来的研究提供了潜在的信号转导信息。值得注意的是,尽管cluster3和cluster1的距离更近,但cluster3与cluster4细胞的信号转导比cluster1细胞更为显著。此外,作者还发现了一些共享的和活跃的配体-受体对,如DLK1-NOTCH2、EFNA1EPHA2、AGT-AGTR1,这些配体-受体对既存在于cluster1细胞与cluster4细胞的细胞通讯中,也存在于cluster3细胞与cluster4细胞的细胞通讯中。
在17周PCW肝脏的scRNA序列数据中,肝细胞可进一步细分为三个cluster。热图显示了每个cluster的前十个标记基因(图4D)。作者检测了LGR5的表达模式,并根据scRNA-seq数据发现了一部分LGR5+肝母细胞(图4E)。在8 周PCW肝脏,5.68%的肝母细胞表达LGR5,而在17周 PCW肝脏,LGR5+细胞的比例下降到3.80%。此外,在8和17 PCW肝脏存在HNF4A+ID3+肝母细胞亚群(图4F)。作者将这些HNF4A+ID3+细胞命名为ID3+肝母细胞。scRNA-seq数据显示,8周PCW肝母细胞中25.26%(475个细胞中120个细胞)和17周PCW肝母细胞中15.76%(184个细胞中29个细胞)属于这个cluster。此外,DLK1在ID3+肝母细胞中高表达,而NCAM1在ID3+肝母细胞中不表达。作者在17 PCW胎肝中鉴定出巨核细胞的两种主要细胞状态(cluster7和cluster10)(图2E)。结果显示,第7组中PF4、PPBP、ITGA2B、GP9和MYL9上调,第10组中JCHAIN、IGLC3、IGLC2、IGHM和IGKC上调。
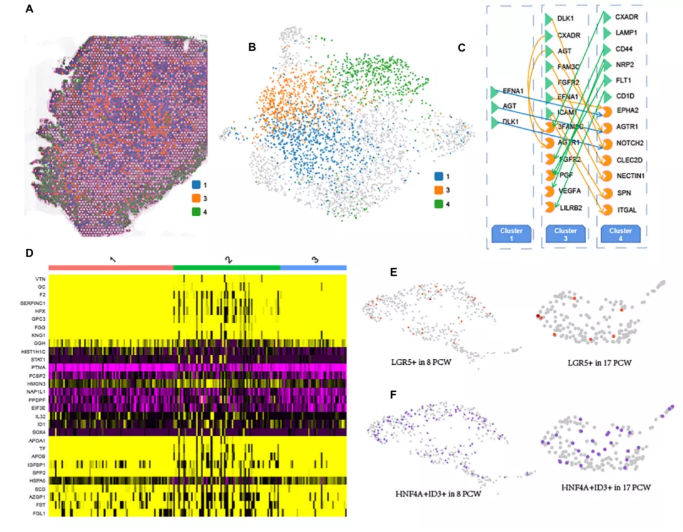
图4
四、人胎肝组织红细胞分化与成熟途径研究
在8PCW肝脏中,小的红细胞簇散布在整个肝脏中(图5A)。在17PCW肝脏中,肝脏充满了红细胞,并且完全变红(图5b)。值得注意的是,早期的红细胞位于肝组织的外围,而中期红细胞和晚期红细胞则分散在肝组织的中心区域(图5B)。这一戏剧性的形态学变化表明,在实验研究期间,人类胎儿肝脏都经历了血液的快速生长和迁移。在8和17PCW肝中均有早、中、晚期成红细胞。为了研究红细胞的发育过程,作者研究了这三种类型红细胞间差异表达的基因。在8PCW肝脏中,818个基因在早、晚分化过程中逐渐下调,2648个基因在早、晚分化过程中逐渐上调。逐渐上调的基因富含乙醛酸和二羧酸代谢、嘧啶代谢、果糖和甘露糖代谢、丙酮酸代谢和嘌呤代谢,而逐渐下调的基因与丁酸代谢相关(图5C)。在17PCW肝组织中,有812个基因在分化早期、中晚期逐渐下调,880个基因在分化早期、中晚期逐渐上调。
对下调基因的KEGG富集分析显示,最显著的包括果糖和甘露糖代谢、半胱氨酸和蛋氨酸代谢、牛磺酸和低牛磺酸代谢、组氨酸和硫胺代谢相关的信号通路。上调基因的高度富集项与丙酸代谢有关(图5D)。作者进行了早、中、晚期细胞间的配体-受体相互作用分析,发现在早期-中晚期细胞通讯中发现了促红细胞生成素(EPO)、蛋白酪氨酸磷酸酶受体C(PTPRC)、连接蛋白细胞粘附分子3(NECTIN3)(图5E)。此外,还对红细胞的分化轨迹进行了分析,得出了一条紧密相连的分化轨迹,分化成五个主要分支(图5F)。这表明系统是通过一个连续的而不是几个断开的谱系来维持的。此外,在8PCW肝脏和17PCW肝脏的早期、中期和晚期红细胞中分别鉴定了617、674和503个DEGs。为了进一步了解8PCW肝脏和17PCW肝脏之间红细胞的差异,对两个胚胎阶段的基因表达模式进行了PCA分析。从每种细胞类型中取样50个点以产生平衡的数据集,并且发现基于它们的转录相似性可以区分8 PCW和17 PCW肝脏中的所有点(图5G,H)。
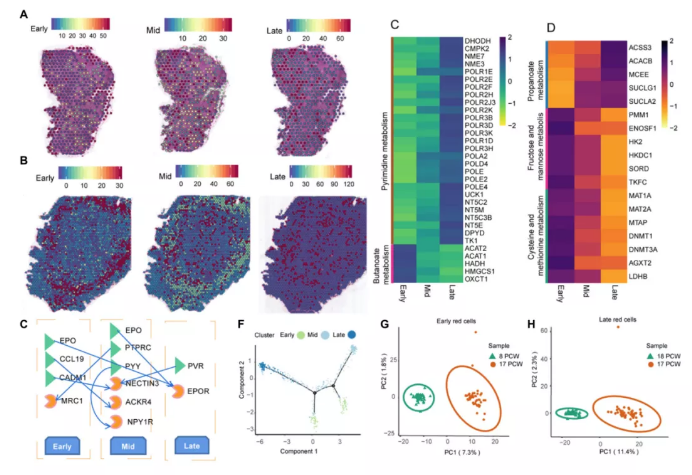
图5
五、人胎肝组织中肝病相关基因的表达模式
为了确定与肝脏疾病胎儿起源相关的功能基因,作者将胎儿肝脏ST数据与公开的网络资源整合,以直观地探索与肝脏疾病相关的细胞类型和空间区域。17个已发表并与肝病相关的基因主要在巨核细胞和内皮细胞中表达,在任何其他细胞类型中几乎不表达(图6A,B)。例如,SPP1、TGFB1、JAG1、STAT1和VIM与先天性胆道闭锁有关,并被证实在内皮细胞和巨核细胞中强烈表达。TGFB1和THBS1(先天性肝纤维化相关)在巨核细胞和内皮细胞中也有高表达。此外,儿童肝细胞癌相关基因SPP1和TGFB1在内皮细胞和巨核细胞中也有强表达。值得注意的是,SPP1和TGFB1基因不仅与先天性(和儿童期)肝病有关,也与成人肝病有关。在此,作者还分析了一些与成人肝病相关的基因的特异性表达。例如,乙型肝炎相关基因(GP1BA、HSPG2、CCL5和SPP1)、脂肪肝相关基因(COL3A1、CCL5和SPP1)、酒精性肝病相关基因(CAV1、ELANE、CCL5和SPP1)、原发性胆汁性肝硬化相关基因(TGFB1、PDE5A、COL1A1、CCL5和SPP1)和原发性恶性肝肿瘤相关基因(SELP、PECAM1、,HSPG2和THY1)主要表达于内皮细胞和巨核细胞,在其他细胞中几乎不表达。
为了进一步揭示这一现象,作者分析了这17种肝病相关基因在17PCW胚胎肾脏中的表达水平。除PECAM1外,其余基因在17PCW肾中表达。但其表达模式与肝脏不同,主要不在巨核细胞和内皮细胞中表达,说明这些肝病相关基因在胚胎肝脏中具有独特的基因表达模式。此外,对这17个肝病相关基因的蛋白质相互作用网络分析显示TGFB1、COL1A1、SPP1、PECAM1和THBS1在表达网络中起关键作用,而PDE5A与其他基因没有相互作用(图6C)。
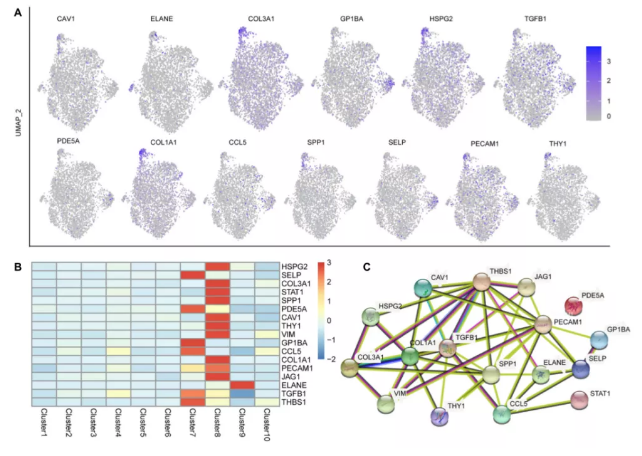 图6
图6
六、人胎肝组织发育基因分析WGCNA分析
为了更好地了解与肝脏发育相关的基因调控变化和细胞类型之间的相互作用,作者使用WGCNA算法构建了一个基于主要细胞簇中差异表达基因的ST数据无偏共表达分析。在8PCW肝脏中确定了5个主要的共表达模块,并在17PCW肝脏中定义了两个基因表达模块(相关指数>0.56)(图7A)。每个模块在细胞cluster中显示出不同的相关性。分析这些模块发现,许多模块是由基因优先表达在特定的细胞群。此外,高相关性模块往往包含丰富的KEGG途径、GO生物过程和蛋白质-蛋白质相互作用(PPI)网络,这进一步突出了基因功能的协作模式(图7B)。在8 PCW肝脏中,KEGG分析显示蓝色模块富集了多种途径,包括核糖体、DNA复制和谷胱甘肽代谢。黄色模块23个基因的共表达网络显示了PF4和PPBP在表达网络中的重要作用。此外,细胞群之间的细胞通讯和信号转导调控是胎儿肝脏发育的过程。为了研究胎儿肝脏中的细胞通讯和空间串扰,作者进行了配体-受体相互作用分析,发现细胞cluster之间存在活跃的细胞通讯(图7C、D)。CD74-MIF、DLK1-NOTCH3、IGF2-IGF1R、AGT-AGTR1和CCL2-ACKR1等配体-受体对在8PCW肝脏中更常见,ESAM-ESAM、TIMP1-FGFR2、JAG1-NOTCH3、LTBR-LTB和PLXNB2-PTN等配体-受体对在17PCW肝脏中更常见。此外,8PCW和17PCW肝脏共有129个配体-受体对。
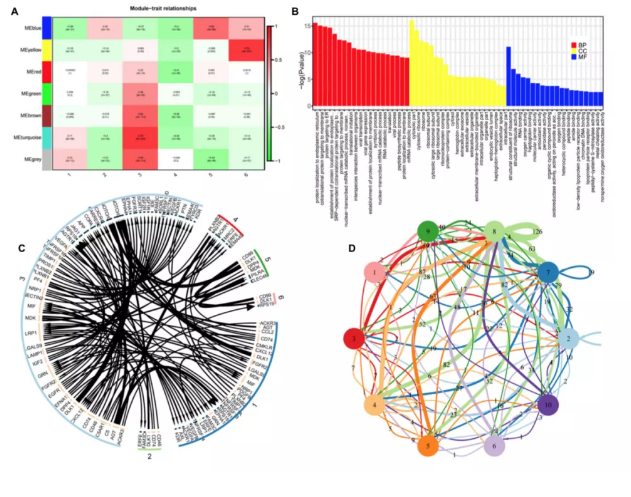
图7
讨论
人类胎儿肝脏在子宫内的发育至今仍知之甚少。在这项研究中,作者应用了一种方法来识别和空间定位胎儿肝组织中不同的细胞状态、亚群和细胞类型。该方法首先通过scRNA-seq对活组织中存在的cluster和细胞类型进行表征,同时通过ST鉴定转录组区域。通过MIA,可以完美地整合ST数据和scRNA-seq数据,并以无偏的方式分析感兴趣区域的数据。
在ST和scRNA-seq数据中鉴定了三个肝细胞亚群,它们在每个亚群中显示出不同的基因表达和功能富集。提示不同区域的肝细胞可能具有不同的功能。在这些亚群的细胞通讯中,发现了几种活性配体-受体对,如DLK1NOTCH2、EFNA1-EPHA2、AGT-AGTR1。
自从Barker(1990)发表了《成人疾病的胎儿和婴儿起源》以来,人们对宫内环境及其对成人疾病的影响给予了极大的重视。环境的变化会引起身体的反应和调整。在胚胎阶段,所有组织器官都处于发生、分化和发育的最敏感阶段。如果宫内环境不利于胚胎分化和发育,那么胚胎会发生结构和功能变化,包括表观遗传机制,这种胚胎的适应性变化将对其生命造成严重甚至不可逆转的损害。在本研究中,作者重点研究了肝脏疾病相关基因在胚胎肝脏中的表达,发现17个已发表并与肝脏疾病相关的基因主要在巨核细胞和内皮细胞中表达,在其他细胞中几乎不表达。
综上所述,将scRNA-seq数据与空间信息相结合,识别出一套全面的基因探针,这些探针可以总结空间和细胞信息,并提供对人类胎儿肝脏中所有细胞类型分化过程的清晰而全面的了解。本研究所得的结果有助于今后的研究免疫性和感染性肝病发病机制的研究及治疗靶点的确定。
文献下载:








 京公网安备 11011302003368号
京公网安备 11011302003368号