2021年8月,国内第一篇基于10x Genomics单细胞联合10× Visium 空间转录组的文章在《Cell Research》见刊!文章作者来自中国科学院动物研究所的刘峰老师课题组和北京大学生命科学学院的李程老师课题组,利用scRNA-seq和ST技术构建小鼠胎肝(FL)的时空转录组图谱,揭示HSCs/MPPs的转录异质性,进一步解析造血干细胞和多能祖细胞(HSC/MPP)在其固有生态位扩增的细胞和分子机制。
近期百迈客推出“10X单细胞联合空间转录组(促销+送豪礼)活动”,欢迎感兴趣的老师咨询当地销售,优惠名额有限,先到先得哦!
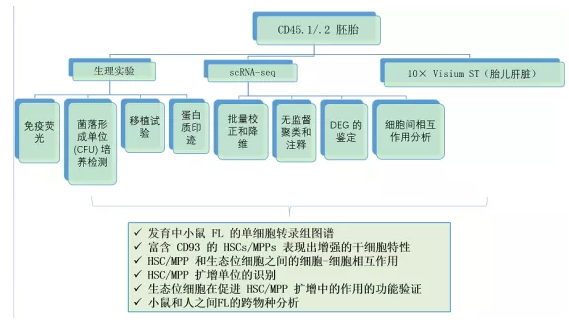
实验材料
将雄性CD45.1小鼠与雌性CD45.2小鼠杂交获得小鼠胚胎;终止妊娠后获得的人类胚胎;健康志愿者处收集人类脐带血 (CB) 样本
ScRNA-seq样本:经FACS分选FL四个时间点(E11.5,E12.5,E13.5,和 E14.5)的细胞,包括造血细胞(HC)、内皮细胞(EC)和非造血/费内皮细胞(NC),之后混合测序。
ST样本:使用来自 E14.5 胚胎沿背腹轴的四个切片进行了 10× Visium ST,重点放在 FL 区域。
实验方法
免疫荧光,菌落形成单位(CFU)培养试验,移植试验,蛋白免疫印迹(WB),scRNA-seq,10× Visium ST,小鼠和人之间FL的跨物种分析
文章思路图
研究背景
在哺乳动物中,造血干细胞和多能祖细胞 (HSCs/MPPs) 占据造血系统层次结构的顶端,表现出多向分化和自我更新的能力。HSC/MPP 扩增的研究为再生医学带来了巨大希望,并且科学家们已经做出了重大努力,通过基因工程或优化培养条件来实现长期的HSC/MPP离体扩增。然而,在目前的HSC/MPP离体扩增培养中,挑战的关键是如何保持干细胞的特性;因此,需要全面了解 HSC/MPP 在体内固有生态位中的扩增。高度血管化的胎肝 (FL) 是各种来源的造血细胞 (HC)的临时发育部位。研究证明在小鼠中,FL结构生态位细胞包括内皮细胞(EC)、基质细胞和成肝细胞,并通过多样化的生长因子、细胞因子和趋化因子与HSC/MPP相互作用。HSC/MPP 和不同生态位细胞之间复杂的相互作用的潜在机制,以及 HSC/MPP 扩增的系统性调控网络仍然难以捉摸。
结果讨论
一、发育中小鼠 FL 的单细胞转录组图谱
基于10× Genomics,构建E11.5,E12.5,E13.5和 E14.5 FL 的单细胞分辨率细胞图谱,共计包含有32449个单细胞,分为了21个细胞簇,包括 18 个 HC 簇和 3 个结构生态位细胞簇,并发现它们的比例与发育阶段动态相关。四个时间点的差异基因的GO 分析显示有丝分裂细胞周期调节和细胞生长也富含不同类型的结构生态位细胞,表明细胞数量和大小的整体增加用以适应 FL 扩张。
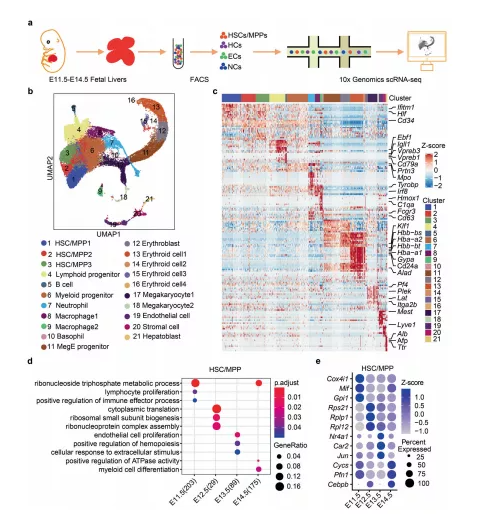
图1 发育中小鼠 FL 的单细胞转录组图谱
a FL组织的scRNA-seq 实验流程示意图。b FL中所有单细胞的UMAP可视化。c热图显示每个细胞簇前20个DEGs的表达模式。d在 FL 发育过程中,HSC/MPP 中富集的 GO通路。e FL发育过程中 HSC/MPP 中富集的 DEGs的散点图。
二、 富含 CD93 的 HSCs/MPPs 表现出增强的干细胞特性
GO 和 DEG 分析表明 HSC/MPP1-3 中造血调节和分化、主动翻译过程和细胞周期调节等通路富集。HSC/MPP亚群和下游髓系淋巴祖细胞之间的轨迹分析显示 HSC/MPP1 占据造血系统层级的顶部。总体而言,这些结果表明,与 HSC/MPP2-3 相比,HSC/MPP1 表现出最强大的干细胞转录组特征。
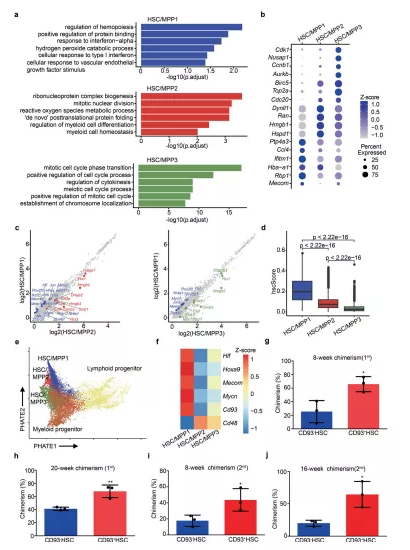
图2 富含CD93 的 HSC/MPP 表现出增强的干细胞特性
a HSC/MPP三个亚群的GO富集分析。b三种HSC/MPP亚型中富集的DEG的散点图。c HSC/MPP1与HSC/MPP2(左)与 HSC/MPP3(右)中所有基因表达的散点图。d箱线图显示了三种 HSC/MPP 亚型的 hscScore 分布。e轨迹分析重建HSC/MPP 到淋巴和骨髓祖细胞的谱系分化。f热图显示了三种 HSC/MPP 亚型中HSC/MPP 特征基因和Cd93的表达模式。g使用 CD93 + SLAM-LSK (CD93 + HSC) 和 CD93 – HSC进行初次移植后 8 周受者外周血 (PB) 中供体来源的嵌合体比例。h使用 CD93 + HSC 和 CD93 – HSC进行初次移植后 20 周时受者 PB 中供体来源的嵌合体比例。i在使用 CD93 + HSC 和 CD93 – HSC进行二次移植后 8 周时受者 PB 中的供体来源嵌合体比例。j使用 CD93 + HSC 和 CD93 – HSC进行二次移植后 16 周时受者 PB 中供体来源的嵌合体比例。
三、 HSC/MPP 和生态位细胞之间的细胞-细胞相互作用
利用单细胞数据构建了一个无偏的 HSC/MPP-生态位细胞相互作用网络,重点是结构生态位细胞和巨噬细胞。深入分析确定了参与 HSC/MPP 发展的几种众所周知的配体-受体相互作用,例如 TGFΒ1-TGFΒR1、TEK-ANGPT1 和 IGF2-IGF1R。通过反卷积分析发现红细胞和成肝细胞在大多数斑点中显示出最高的富集分数,表明它们是 FL 的主要细胞成分。总之,ST 描绘了 FL 的空间组织结构,用以进一步解读 scRNA-seq 预测的细胞-细胞相互作用。
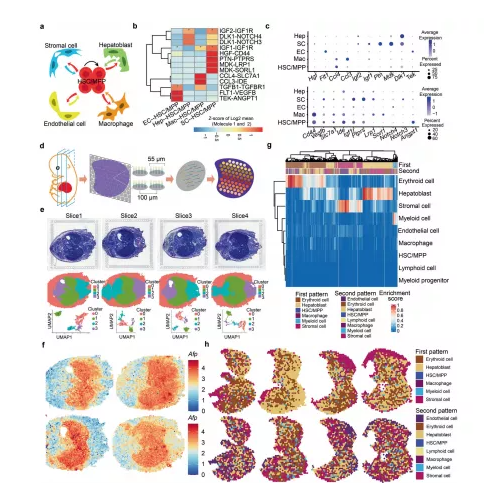
图3 HSCs/MPPs 和小生境细胞之间的细胞间相互作用
a示意图展示 HSC/MPP 和生态位细胞(内皮细胞、基质细胞、成肝细胞和巨噬细胞)之间的细胞相互作用。b CellPhoneDB 分析展示主要的 HSC/MPP-生态位细胞相互作用对。c主要的HSC/MPP-生态位细胞相互作用对的配体(顶部)和相应受体(底部)表达模式的散点图。d 10×Visium ST 实验流程示意图。e E14.5 胚胎组织切片的苏木精和伊红 (HE) 染色。f组织切片中成肝细胞标记物Afp 的表达模式。g热图展示了FL斑点的富集分数。h FL部分空间特征图。
四、 HSC/MPP 扩增单位的识别
对于每种生态位细胞类型,不同类型斑点的富集得分分析表明,点内得分最高的 EC 接近 HSC/MPP。发现巨噬细胞在点内富集 11.52 倍,在点间富集 1.31 倍,EC 在点内富集 1.62 倍,而肝母细胞和基质细胞在点内富集较少。总之,数据结果支持巨噬细胞是与 HSCs/MPPs 关系最密切的重要生态位细胞。通过分析预测的交互信号的空间表达,发现编码配体的基因,如 MDK 和 PTN,在点内和点间的生态位细胞中高度表达;并且与受体相关的基因,如 LRP1 和 PTPRS,在HSCs/MPPs 定位点富集。该结果证明 FL的 HSCs/MPPs 以多个单位扩增,其中巨噬细胞和多种生长因子(包括 MDK 和 PTN)高度富集。
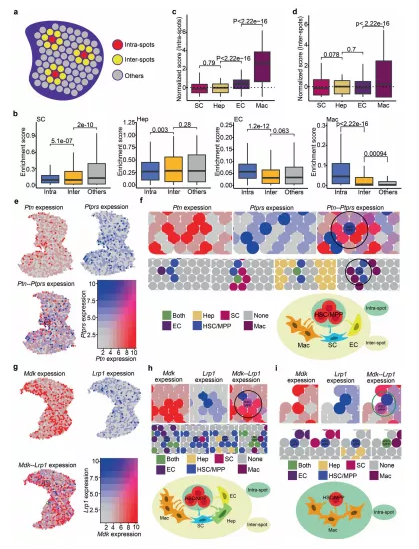
图4 HSC/MPP扩增单元识别
a点内、点间及其他的示意图。点内:HSC/MPP 定位点;点间:HSC/MPP 包围点;其他,其他远端的点。b箱线图展示点内、点间和其他点中生态位细胞的富集分数。c箱线图展示了点内生态位细胞的归一化(富集)评分。d箱线图显示点间生态位细胞的归一化(富集)评分。e FL中Ptn和Ptprs 的共表达模式。f 空间特征图展示Ptn-Ptprs丰富的 HSC/MPP 扩增单元。基因Ptn在生态位细胞定位点(顶部,红色点)和基因Ptprs在HSC/MPP 定位点(顶部,蓝色点)的表达模式。g FL中Mdk和Lrp1 的共表达模式。h富含Mdk -Lrp1 的HSC/MPP 扩增单元(点间)的空间特征图。i空间特征图展示富含Mdk- Lrp1 的HSC/MPP 扩增单元(点内)。
五、 生态位细胞在促进 HSC/MPP 扩增中的作用的功能验证
免疫荧光分析揭示巨噬细胞可以通过形成“口袋状”结构来促进 HSC/MPP 扩增,同时通过分泌 MDK 因子促进 HSC/MPP 扩增。10×Visium ST 结果说明了 HSCs/MPPs 和 ECs 之间更密切的空间关系,免疫荧光分析验证了HSCs/MPPs 被 ECs 包围。从功能上确定源自结构生态位细胞的预测交互信号可以调节 HSCs/MPPs 扩增。功能分析验证了潜在的细胞间相互作用和支持 HSC/MPP 扩增的潜在分子机制。
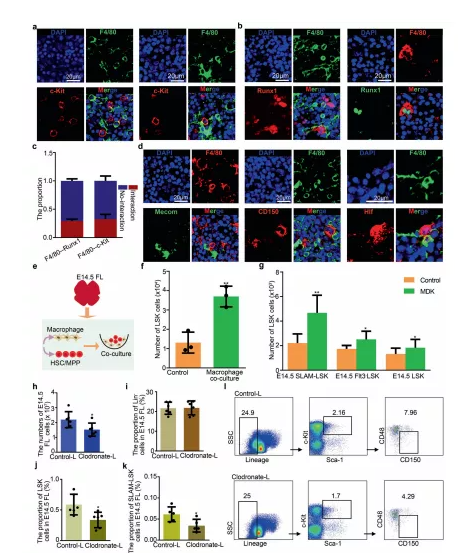
图5 巨噬细胞促进 HSC/MPP 扩增
a免疫荧光分析显示 E14.5 FL 冷冻切片中 F4/80(代表巨噬细胞)和 c-Kit(代表 HSCs/MPPs)的表达。b免疫荧光分析显示 E14.5 FL 冷冻切片中 F4/80(代表巨噬细胞)和 Runx1(代表 HSCs/MPPs)的表达。C柱状图展示有和无细胞相互作用的 HSCs/MPPs 的比例。d免疫荧光分析显示 E14.5 FL 冷冻切片中 F4/80(代表巨噬细胞)、CD150(代表 HSCs/MPPs)、Mecom(代表 HSCs/MPPs)和 Hlf(代表 HSCs/MPPs)的表达。f源自巨噬细胞和 HSC/MPP 共培养系统的 HSCs/MPPs(LSK 细胞)的数量。g源自MDK补充培养物的 100 个 HSCs/MPPs(LSK、Flt3 -LSK 和 SLAM-LSK 细胞)的HSCs/MPPs(LSK 细胞)的数量。h氯膦酸盐-脂质体和对照-脂质体处理后 E14.5 FL 中的总细胞数。i氯膦酸盐处理前后 E14.5 FL中谱系- (Lin- ) 细胞的比例。j氯膦酸盐处理前后 E14.5 FL 中 LSK 细胞的比例。k氯膦酸盐处理前后 E14.5 FL 中 SLAM-LSK 细胞的比例。l流式细胞仪分析显示E14.5 FL在氯膦酸盐处理前后Lin -,LSK,SLAM-LSK的细胞比例。
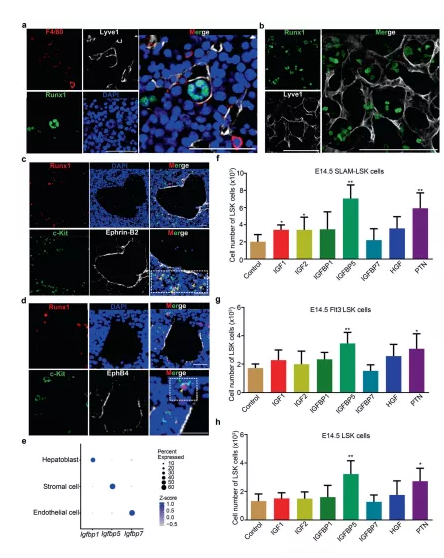
图6 促进 HSCs/MPPs 扩增的结构生态位细胞
a 免疫荧光分析显示了在 E14.5 FL 冷冻切片中 Lyve1(代表ECs)和 Runx1(代表 HSCs/MPPs)的表达。b免疫荧光分析显示了 E14.5 FL 冷冻切片中 Lyve1(代表EC)和 Runx1(代表 HSCs/MPPs)的表达。c免疫荧光分析显示 E14.5 FL 冷冻切片中 c-Kit(代表 HSCs/MPPs)、Runx1(代表 HSCs/MPPs)和 EphrinB2(代表动脉门脉血管)的表达。d免疫荧光分析显示 c-Kit(代表 HSCs/MPPs)、Runx1(代表 HSCs/MPPs)和 EphB4(代表静脉)在 E14.5 FL 冷冻切片中的表达。e Igfbp1、Igfbp5和Igfbp7在三种结构生态位细胞(内皮细胞、基质细胞和成肝细胞)中的表达模式散点图。f来自 E14.5 FL 的 100 个 SLAM-LSK 细胞因子培养物的 HSCs/MPPs(LSK 细胞)的数量。g来自 E14.5 FL的 100 个Flt3-LSK 细胞因子培养物的 HSCs/MPPs(LSK 细胞)的数量。h来自 E14.5 FL 的 100 个 LSK 细胞因子培养物的 HSCs/MPPs(LSK 细胞)的数量。
六、 小鼠和人类FL造血功能的跨物种分析
本文数据揭示了小鼠和人类 FL 之间保守的细胞类型和造血分化途径,说明人类和小鼠之间保留了许多 FL HSC 扩增机制,但 HSCs/MPPs 中也存在物种特异性转录组特征。
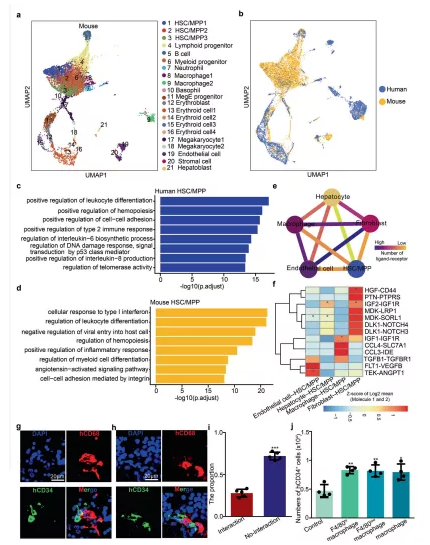
图7 小鼠和人类FL造血的跨物种分析
a E14.5 FL中所有细胞类型的UMAP 可视化。b来自小鼠(E14.5)和人类(受孕后 11 周)的 FL 细胞群的 UMAP 可视化。c对人类 HSCs/MPPs中top DEG 进行 GO 生物过程相关的通路富集分析。d对小鼠 HSCs/MPPs 中top DEG进行GO生物过程相关的通路富集分析。e配体-受体相互作用网络展示了人 HSC/MPP与生态位细胞之间的潜在通讯网络。f热图展示主要的人 HSCs/MPPs-生态位细胞相互作用对。g – h免疫荧光分析展示CD68(代表巨噬细胞)和 CD34(代表 HSCs/MPPs)在人受孕后第 11 周 FL 切片中的表达。i柱状图展示有和无细胞相互作用的 HSCs/MPPs 所占的比例。j源自小鼠巨噬细胞和 HSCs/MPPs 共培养系统的人 CD34 + HSCs/MPPs的数量。
研究结论
单细胞转录组学揭示了三种具有转录异质性的亚群,其中CD93+亚群表现出增强的干细胞特性。此外,通过整合单细胞和空间转录组学的联合分析,发现了新的HSCs/MPPs‘口袋样’单元(HSC PLUS),由生态位细胞 (肝母细胞、间质细胞、内皮细胞和巨噬细胞) 组成,并富含生长因子。出乎意料的是,巨噬细胞在HSC PLUS中表现出了11倍的富集结果。在功能上,巨噬细胞- HSC /MPP共培养检测和候选分子检测分别验证了巨噬细胞和生长因子(MDK、PTN和IGFBP5)在HSCs/MPPs扩增中的支持作用。该研究通过高通量测序技术解读了HSCs/MPPs扩增的结构和分子基础。最后,跨物种分析和功能验证表明细胞间相互作用和扩增机制具有保守性,但小鼠和人FL的HSCs/MPPs之间的转录组特征同时存在差异。综上所述,本文为了解FL中HSCs/MPPs的发生发展以及体外功能性HSCs/MPPs扩增提出了的新见解。
参考文章:
Gao, S., Shi, Q., Zhang, Y. et al. Identification of HSC/MPP expansion units in fetal liver by single-cell spatiotemporal transcriptomics. Cell Res (2021). https://doi.org/10.1038/s41422-021-00540-7
原文下载链接:
https://international.biocloud.net/zh/article/detail/34341490
推荐阅读
百迈客新品-植物空间转录组的机遇与挑战
空间转录组+基因组数据联合分析揭示乳腺原位癌的异质性
文献分享|【综述】单细胞技术开启对肝脏病理学及发病机制的新认知
单细胞转录组助力构建不同胃腺癌亚型的转录组图谱
百迈客:10x单细胞转录组与空间转录组联合分析一睹为快
空间转录组-在生长发育中的应用2
空间转录组-在癌症中的应用1







 京公网安备 11011302003368号
京公网安备 11011302003368号