
文章题目:Genomic profiling reveals heterogeneous populations of ductal carcinoma in situ of the breast
中文题目:基因组分析揭示乳腺原位癌的异质性群体
期刊:Communications Biology
影响因子:6.6
DOI:10.1038/s42003-021-01959-9
导读
对大部分患者来说,乳腺导管原位癌(DCIS)不会发展为浸润性导管癌,在当前的临床标准下,这些患者经常被过度治疗。虽然有各种候选标记物可用,但尚未建立用于描述风险类别的相关标记物。在本研究中,作者分析了431例DCIS患者的临床特征,并对21例患者进行了全外显子组测序分析,对72例患者进行了靶向深度测序分析。确定了年龄<45岁、HER2扩增和GATA3突变可能影响复发。PIK3CA突变阴性和PgR阴性也被认为是危险因素。空间转录组分析进一步显示GATA3功能障碍上调上皮-间充质转化和血管生成,随后PgR下调。这些结果揭示了DCIS中异质细胞群的存在,并为DCIS分类和优化治疗提供了预测性标记。
百迈客不仅提供单细胞系列产品,6大核心产品,单细胞转录组、空间转录组、单细胞免疫组库、单细胞ATAC-seq、单细胞核转录组、单细胞全长转录组,而且实现了单细胞转录组、空间转录组百迈客云端APP分析,深入大数据挖掘,一键快速分析,单细胞和空间转录组的联合分析近似实现单细胞分辨率的空间异质性,助您进入时空组学研究新时代。接下来我们来看看作者如何实现基因组数据和空间转录组数据联合研究乳腺原位癌的异质性。
方法
外显子组文库构建和全外显子组测序
从21例DCIS(原发性肿瘤)患者和4例IDC(复发性肿瘤)患者中选择福尔马林固定石蜡包埋(FFPE)组织样本。同时对每位患者制作相应的冰冻切片,染色确定DCIS和正常上皮组织中的区域。
全外显子组测序中基因组风险因子的选择
为了提高基于临床评估区分低风险和高风险DCI标准的准确性,作者尝试识别基因组因素。评估了21例DCIS患者,他们是随机选择的,具有匹配的固有亚型和相对较高的复发率。对匹配的正常乳腺组织进行测序(平均深度×109.1),以区分体细胞突变的种系变异。获得的变异图如图1a所示。
GATA3和PIK3CA突变是队列中最常见的突变,分别出现在4例(19%)和5例(24%)患者中。在4例GATA3突变患者中,3例出现IDC复发。GATA3突变阳性与GATA3突变阴性复发的优势比(OR)为5.5(95%CI=0.63–76.7)。为了进一步研究GATA3突变在复发中的意义,对复发肿瘤患者的样本进行额外分析,以确定与配对原发性DCI相比的突变状态。
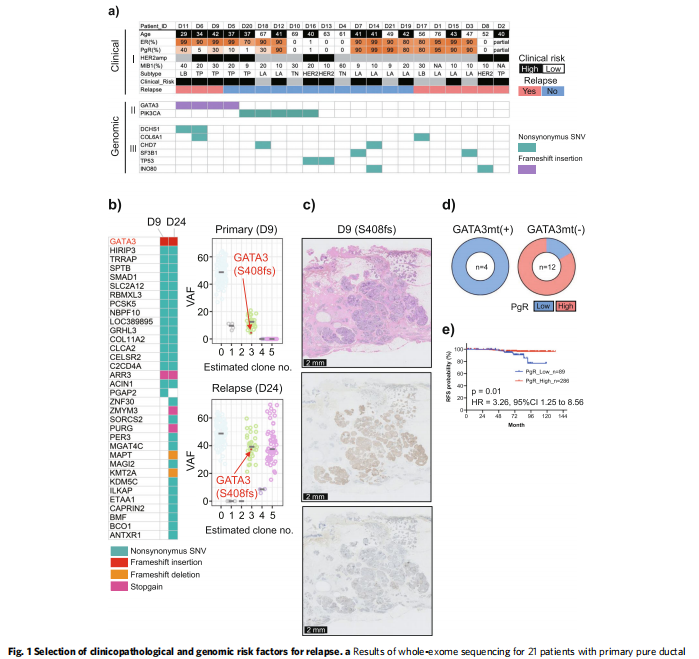
结果
全外显子靶向测序
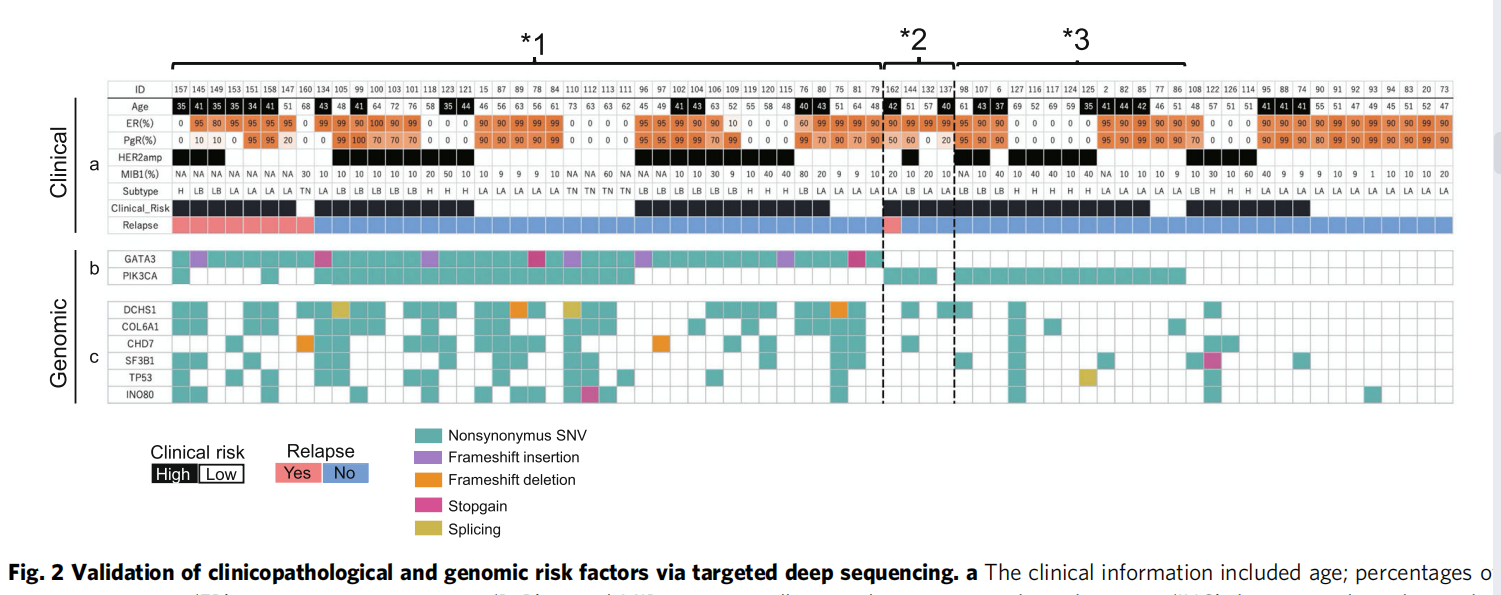
获得的突变图如图2所示。总共有40名(56%)和36名(50%)患者分别携带GATA3和PIK3CA突变。与上述结果一致,GATA3突变与复发呈正相关(OR=7.8;95%CI=1.17~88.4),而PIK3CA突变往往与复发呈负相关(OR=0.45;95%可信区间=0.12~1.7)。在测试的180个基因中,没有一个比这两个因素更能作为预测标记。对于PgR蛋白表达,低PgR表达再次与复发相关(OR=25.6;95%可信区间=3.64–142.2)。结果表明在11例中的8例中发现了GATA3突变,尽管ER阳性,但PgR较低。
DCIS患者的分子解剖分析
为了确定所识别的高危标记物的分子病因,调查了另外三名具有代表性的新鲜冰冻标本患者。患者A患有带有GATA3突变(图2,*1)和微侵袭的DCIS,病变被认为是真正的DCIS。患者B患有PgR低表达的DCIS(图2,*2)和微侵袭,病变被视为真正的DCIS。患者C患有PIK3CA突变的DCIS(图2,*3),没有任何微侵袭,病变被认为可能是假DCIS(低风险DCIS)。
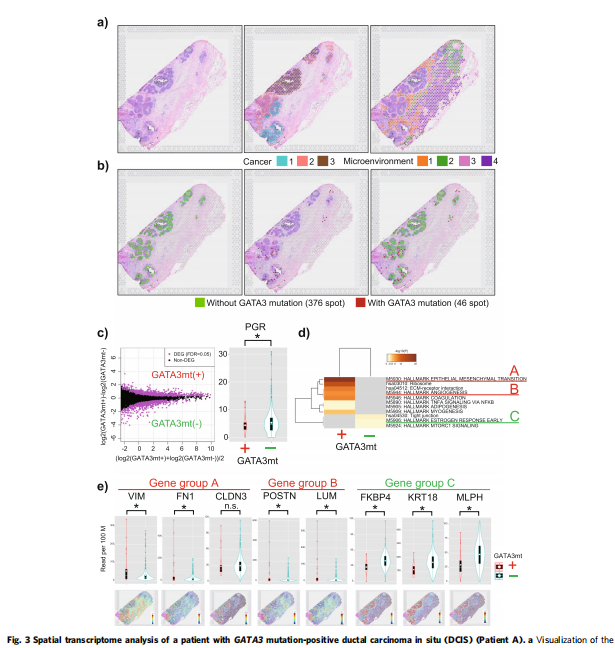
含有GATA3突变的DCIS病变的STseq
首先,利用空间转录组学技术——10X基因组学Visium平台,通过STseq分析了患者A标本的空间基因表达。该患者在术前病理诊断中被诊断为DCIS,但在术后病理诊断中发现有微侵袭部位。因此,DCIS病变被确定为IDC的真正前兆。平均深度为×2391.4的面板测序分析显示该样本含有GATA3突变(外显子4:c.865dupG:p。C288fs,变异等位基因频率[VAF]=7%)。在较高的VAF(外显子5:c.T1035A:p。N345K,VAF=26.1%),表明新出现的GATA3突变用PIK3CA突变覆盖了DCIS的基本特征。
PgR低表达但无GATA3突变的DCIS病变的STseq
接下来,作者将患者B作为PgR低表达的例外患者进行研究,尽管没有GATA3突变(图2,*2)。从平均深度×3030.6的靶向测序中,检测到PIK3CA突变(外显子21:c.A3140T:p。H1047L,VAF=40%),而即使在这个足够的测序深度,也没有检测到GATA3突变。因此,从分子水平来看,该患者的预后良好。然而,术后病理检查显示微侵袭,表明DCIS病变是IDC的真正前兆。免疫组化分析显示该患者ER阳性,PgR阴性。
DCIS和PIK3CA突变
最后,将患者C的病例分析为可能的假DCIS病例,不太可能发展为IDC(低风险DCIS)。该患者特征为PIK3CA突变,GATA3突变或下调缺失,无微侵袭,术后无复发。该患者的DCIS病变包含两个PIK3CA突变(外显子10:c.G1633A:p。E545K,外显子10:c.A1634G:p。E545G,两种突变的VAF=25%)。
对于Visium分析,收集了799133428个测序读数,测序饱和度为86.2%。分析点的数量(直径55µm)为2043个,其中包含7469个唯一分子标识符(UMI)读数的中位数和每个点2928个检测基因的中位数。如图3A的中间板所示,癌细胞斑点被分为三组,通过非分层k-均值聚类(K=9),表明DCIS病变中存在异质性。此外,可能代表癌细胞周围微环境的非癌点被分为四类。在代表病理学鉴定的癌细胞的总共422个点中,通过分析Visium读数在46个点中检测到GATA3突变读数(图3b)。幸运的是,在该患者中,GATA3突变位于转录本的3′端,因此可以通过Visium读数来表示。为了研究携带GATA3突变(spots)的细胞是否是克隆性的,检测了46个携带GATA3突变的点的VISUM读数上的GATA3突变位点。突变完全存在于同一位点(外显子4:c.865dupG:p。C288fs),表明它们是单克隆来源。使用TCC R检测了GATA3突变的斑点之间的差异表达基因(DEG)。总共检测到1468个DEG(错误发现率[FDR]<0.05,图3c,左面板)。如图1d所示,在具有GATA3突变的斑点中观察到PgR表达下调(P=0.02901;t检验;图3c,右面板)。为了预测检测到的DEG的功能结果,使用Metascape进行了路径分析(http://metascape.org/)28.发现了9条与11种癌症特征相关的关键途径。
与突变阴性点的结果相比,GATA3突变的癌点受影响(图3d)。特别是,关键基因和关键途径包括EMT和血管生成。重要的是,具有表达变化的关键基因是那些被鉴定为对异常GATA3功能作出反应的基因,如VIM和FN1(图3e)。这些结果表明GATA3突变在DCIS进展过程中出现,并伴有恶性特征。据报道,增加的VIM表达发生在管腔癌细胞的GATA3突变下游24;因此,在这些斑点中观察到的GATA3突变可能代表恶性发展过程中先前的基因改变。相反,在没有GATA3突变的斑点中,DEG主要富集于雌激素反应、紧密连接和mTORC1的信号通路,表明这些斑点中的细胞获得了允许细胞转化的最小变化。
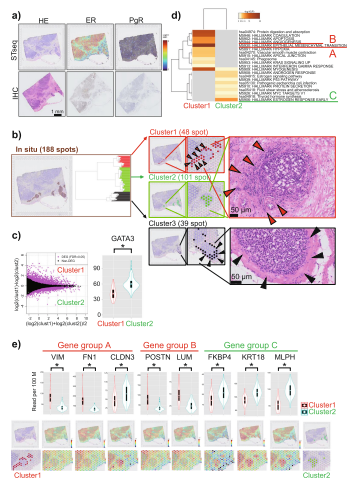
Visium分析发现了异质基因表达,这取决于癌区和非癌区细胞的位置。PgR表达下调,尽管观察到高ER表达(图4a,上图),与免疫染色结果一致(图4a,下图)。针对DCIS细胞中基因表达的变化,手动选择了188个位于导管内区域的形态学斑点。这些斑点的无监督分层聚类确定了三个明显的聚类(图4b,左面板)。在空间上,不同的簇对应于不同的区域(图4b,中间面板)。重要的是,簇1的48个斑点(红色)与DCIS细胞的位置重叠,DCIS细胞根据其形态即将入侵(由图4b右面板中的红色箭头指示)。同时,簇2(有色绿色)的101个斑点位于同一导管的中心,并被视为不侵入基质的细胞(由图4B的中间板中的绿色斑点指示)。簇1和簇2之间的差异表达分析确定了2747个DEG(FDR<0.05,图4c,左)。有趣的是,GATA3表达在簇1中显著下调(图4c,右图)。尽管该基因未发生突变,但该患者的GATA3功能异常可能发生在基因水平。根据基因富集和通路分析的结果,该患者始终观察到以GATA3为中心的基因表达变化,如患者A所观察到的(图4d,e)。共有21条途径和18个癌症特征,包括EMT和血管生成途径受到影响。如对患者A所观察到的,在未侵入间质的第2组中,DEG主要代表雌激素反应相关基因。总之,在这名患者身上,我们得出结论,GATA3通过其表达的变化发挥关键作用。即使没有基因组突变,GATA3的异常表达也可能在某些患者中导致相同的结果。
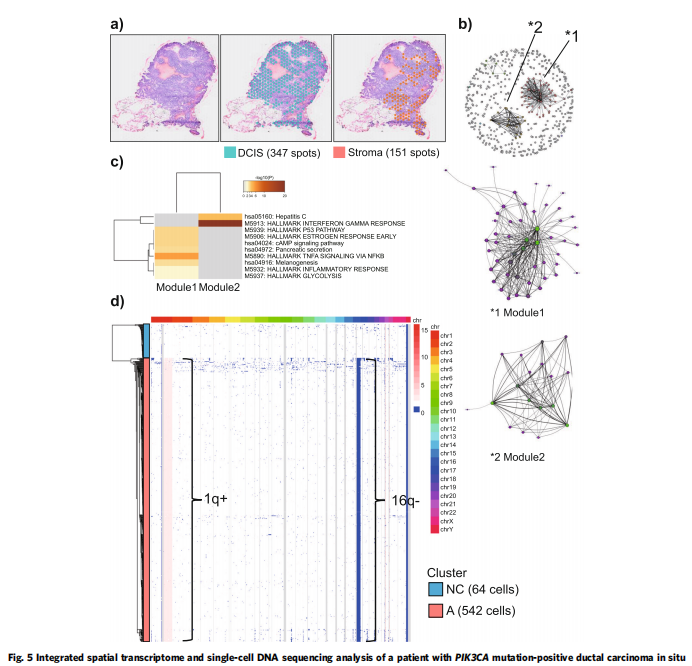
通过全外显子组测序,平均深度为×134.8。Visium分析揭示了一种单调的基因表达模式,与该癌的形态学单克隆结构一致(图5a,左面板)。事实上,这些斑点通过非层次聚类大致分为两个簇(图5a,中间和右侧面板)。它们几乎与形态学确定的癌细胞和非癌细胞(基质细胞)完全重叠。因此,使用DEG分析比较了癌细胞中的347个斑点(蓝色斑点)和基质细胞中的151个斑点(橙色斑点),并确定了癌斑点中508个上调的DEG(FDR<0.05)。加权基因共表达网络分析(WGCNA)显示,与非癌点相比,癌点中只有两个主要节点(模块)发生改变(图5b,上面板)。进行了子网络分析,以确定枢纽基因(图5b,中间和下部面板)。hub基因的途径富集分析显示,参与雌激素反应和p53途径的基因在模块1中富集(图5c,补充数据5),这与在患者A和B中观察到的良性出现斑点的特征相同,表明该病变中没有发生恶性转化。
讨论
在本研究中,将GATA3突变确定为DCI分类的潜在标记。ER阳性DCIS患者的PIK3CA突变阴性和PgR蛋白阴性也被认为是危险因素。传统的临床病理因素对于预测IDC发生的风险也至关重要,包括年龄(≥45岁与<45岁)和HER2状态(阴性与阳性)。在缺乏HER2靶向治疗的情况下,HER2扩增是众所周知的IDC预后不良因素。然而,HER2扩增的频率在DCIS和IDC33–37之间有所不同,HER2扩增是否是DCIS的风险因素仍有争议。HER2阳性率/年龄的HR≥45岁与2岁消极/年龄≥45年为1.54(95%可信区间=0.31-7.65,P=0.595)。HER2阴性/年龄<45岁与HER2阴性/年龄的HR比较≥45为2.43(95%可信区间=0.78-7.52,P=0.125)。相反,HER2阳性/年龄<45岁与HER2阴性/年龄的HR≥45为11.03(95%可信区间=3.54-34.4,P<0.0001)。尽管交互试验的P值为0.121,但这些结果可能表明年龄与HER2扩增之间存在交互作用。还发现PIK3CA突变的DCIS细胞没有任何导致恶性转化的基因组或转录组改变。未来,DCIS的临床研究(包括正在进行的试验12 14)可能会提供一种准确的算法,使用包括本研究提出的标记物在内的标志物来区分高风险和低风险DCIS,从而避免不必要的治疗。
参考文献
Nagasawa S, Kuze Y, Maeda I, et al. Genomic profiling reveals heterogeneous populations of ductal carcinoma in situ of the breast. Commun Biol. 2021 Apr 1;4(1):438.
文献下载
https://international.biocloud.net/zh/article/detail/33795819
推荐阅读
文献分享|【综述】单细胞技术开启对肝脏病理学及发病机制的新认知
单细胞转录组助力构建不同胃腺癌亚型的转录组图谱
百迈客:10x单细胞转录组与空间转录组联合分析一睹为快
空间转录组-在生长发育中的应用2
空间转录组-在癌症中的应用1
单细胞转录组应用4——结直肠癌研究
单细胞&空间转录组应用3-动植物研究“遍地开花”
单细胞转录组应用2——食管鳞状细胞癌研究
单细胞转录组应用1——衰老研究






 京公网安备 11011302003368号
京公网安备 11011302003368号