2021 年 5 月 11 日,华南农业大学与北京百迈客生物科技有限公司合作的鸭肠道菌群研究的文章在Science of the Total Environment(IF 7.96)在线发表,该文章使用全长16S扩增子测序技术研究了砷诱导下导致的肠道微生物菌群失调和肠道屏障损伤,并揭示了砷诱导的鸭肝脏和空肠炎症是由LPS/TLR4/NF-kB信号通路和NLRP3炎症小体的激活引起的。以下是对该文章的详细解读。
文章信息
英文主题:Arsenic exposure induces intestinal barrier damage and consequent activation of gut-liver axis leading to inflammation and pyroptosis of liver in ducks
中文主题:砷暴露引起鸭肠道屏障损伤进而激活肠-肝轴导致肝脏炎症和细胞凋亡
发表期刊:Science of the Total Environment
影响因子:7.96
发表时间:2021 年 5 月
研究亮点
• 砷会引起鸭肝脏和肠道毒性,带来生态风险
• 砷暴露导致肠道微生物群失调和屏障损伤
• 砷可通过 TLR4/NF-κB 和 NLRP3 通路触发炎症反应
• 砷诱导的肝毒性与肠-肝轴的激活有关
研究概览
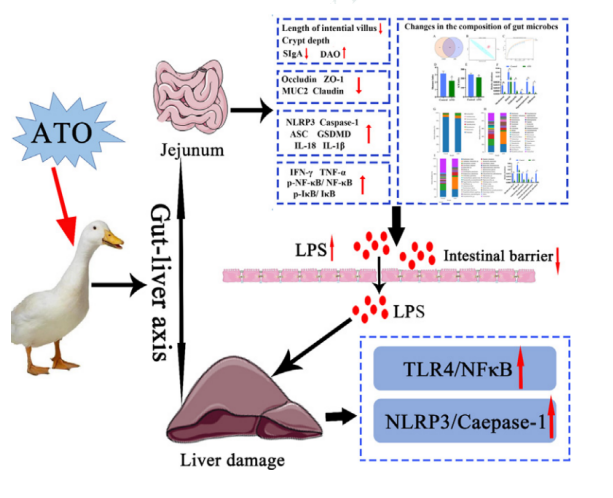
研究方法
组织病理学研究,酶联免疫吸附试验 (ELISA),定量实时 PCR (qRT-PCR),蛋白质印迹分析,免疫组化,免疫荧光分析,16S全长肠道微生物多样性测序分析
摘要
砷元素广泛存在于自然界中,砷及砷化合物是常见的有毒有害类污染物,常见于受污染的土壤、河流和地下水中。然而,关于三氧化二砷 (ATO) 对水禽的肠-肝轴和随之而来的肝毒性的影响的研究很少。在此,我们研究了 ATO 对鸭肠和肝脏的影响,并探讨了肠肝轴在 ATO 诱导的肝毒性和肠道毒性中的作用。结果表明,ATO 暴露会导致肠道损伤、肝脏炎症细胞浸润和囊泡脂肪变性。此外,暴露于 ATO 的鸭子的肠道微生物群落显示出显著降低的α多样性和细菌群落的改变。并且,ATO 暴露显著降低了肠道屏障相关蛋白(Claudin-1、MUC2、ZO-1 和 Occludin)的表达,导致肠道通透性增加和脂多糖水平升高。同时,ATO 暴露还上调肝脏和空肠中与细胞凋亡相关的指数水平,并增加促炎细胞因子的产生(IFN-γ、TNF-α、IL-18 和 IL-1β)。我们进一步的机制研究表明,ATO 诱导的肝脏和空肠炎症是由 LPS/TLR4/NF-κB 信号通路和 NLRP3 炎症小体的激活引起的。总之,这些结果表明ATO暴露可引起肝脏和空肠炎症和细胞凋亡,间接肠肝轴通路可能在ATO诱导肝毒性的潜在机制中起重要作用
研究背景
砷广泛分布于农业土壤和地下水中,在全球许多地区,土壤和河水中的砷浓度超过了世界卫生组织规定的标准限值(<10 μg/L)。据报道,在一些亚洲国家,饮用水中的砷含量已达到 150-440 微克/升。由于砷在土壤/植物/动物-人类食物链中的运输和积累,砷暴露变得越来越普遍。大约 80% 的无机砷在摄入后被胃肠道吸收。近几十年来,许多报告描述了砷诱导的动物免疫毒性、肾毒性、生殖毒性和其他不良反应。此外,近期关于砷毒性的其他研究表明,砷暴露可通过氧化损伤引起鸡的肝毒性和肠道毒性,但很少有重点研究砷对水禽肠道和肝脏的影响。鸭子是人类饮食中的重要成分和蛋白质来源,然而,由于受砷污染的水和饮食摄入,水禽比其他家禽更容易受到砷毒性的影响,这可能导致人类食用的农产品(例如鸭肉和鸡蛋)中存在砷残留。因此,研究鸭在砷暴露期间肠道和肝脏的变化尤为重要。
肠道是营养消化和吸收的主要器官,肠道微生物对免疫调节、营养消化和吸收以及宿主对病原体的防御至关重要。在正常生理条件下,肠黏膜免疫、上皮细胞完整性以及肠道微生物群与营养物质之间复杂的相互作用维持肠道环境的稳态。越来越多的证据表明,重金属暴露对肠道功能有不利影响。据报道,镉可通过增加小鼠肠道通透性和降低肠道微生物丰富度来损害肠道组织。此外,另一项研究表明,铜暴露显着影响鲤鱼肝功能的生化指标,并抑制肠上皮紧密连接蛋白(ZO-1 和 Occludin)的表达。这些研究表明,重金属暴露会干扰肠道微生物群,从而导致代谢紊乱并增加肠炎和脂肪肝等疾病的风险。
肝脏是肠道微生物及其产物易位的第一个目标。因此,肠肝轴在肝脏疾病的发病机制中具有重要意义。研究表明,肠道菌群可通过增加脂多糖(LPS)诱导肝损伤,主要通过激活 TLR4/NF-κB 信号通路诱导肝脏炎症和脂质积累。此外,肠道屏障破坏引起的肠道通透性增加也可能是肝病发生的重要因素。值得注意的是,一些研究人员已经表明肝脏和肠道炎症与重金属暴露密切相关。最近的一些报道也表明肠道炎症的发生可能与 NLRP3 炎症小体和 IκB/NF-κB 信号通路的激活有关。然而,据我们所知,砷引起的肝脏和肠道炎症的激活机制仍不确定。因此,砷是否通过激活 NF-κB 信号通路和 NLRP3 炎症小体导致鸭肠道损伤,并通过肠-肝轴激活引起肝脏炎症和细胞凋亡需要进一步研究。
本研究采用组织病理学技术、实时定量 PCR、蛋白质印迹分析和全长 16S rRNA 高通量测序技术研究砷诱导肠道和肝脏损伤的潜在机制及其对鸭肠道微生物组成的影响。本研究的结果可能有助于更好地了解砷诱导家禽肝脏和肠道毒性的潜在机制,并为未来的研究奠定基础。
研究结果
ATO 暴露对空肠组织病理学的影响
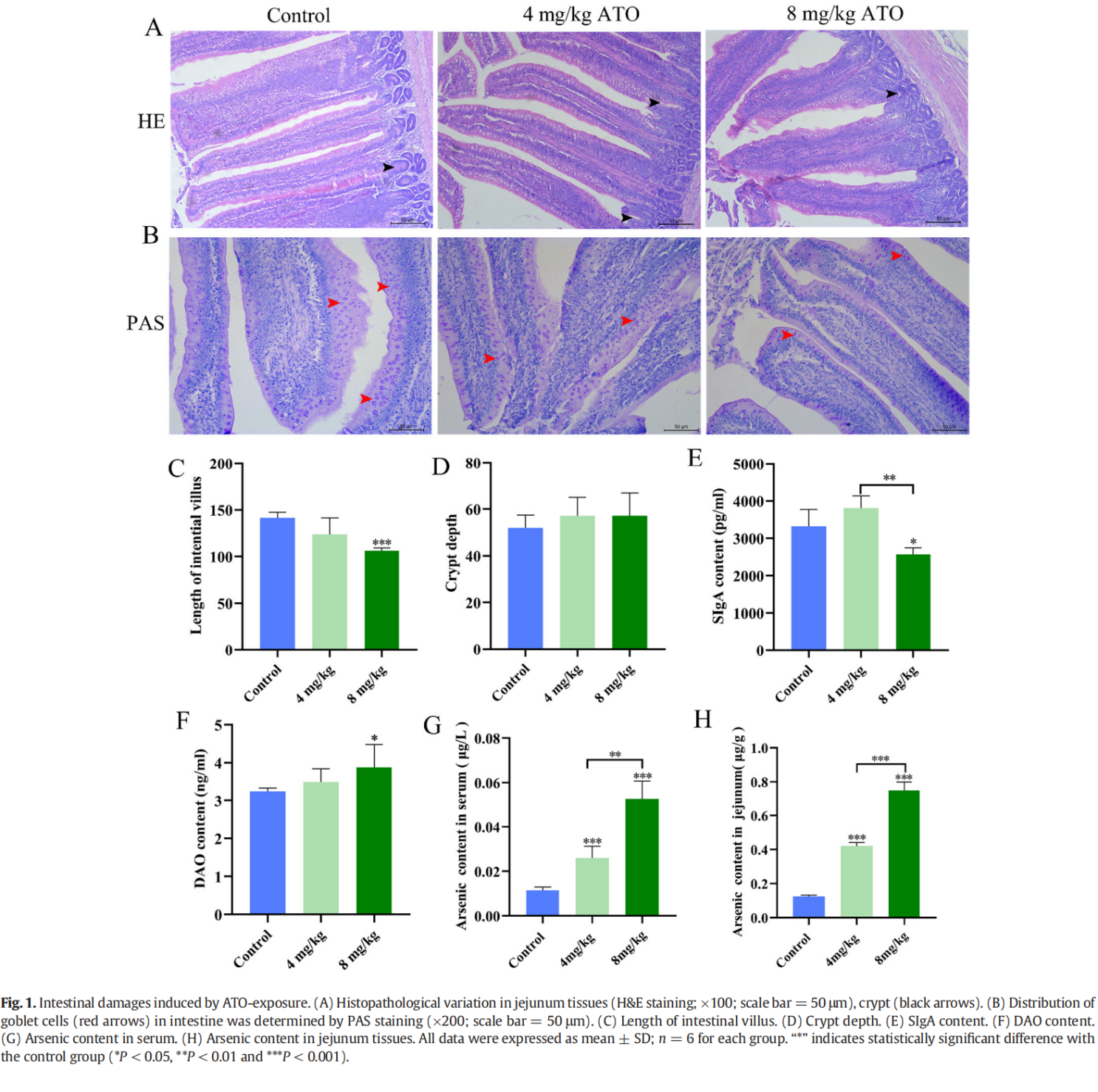
为了评估对 ATO 暴露的潜在肠道形态学改变,H&E 染色用于检测肠道组织病理学变化,PAS 染色用于检测 ATO 对粘蛋白层和杯状细胞数量的影响。组织病理学改变(H&E染色)见图1A,对照组空肠组织形态正常,边界清晰,上皮细胞排列整齐。然而,用 8 mg/kg ATO 处理的鸭子表现出通过肠绒毛顶端上皮脱落和绒毛长度显着减少的空肠损伤(P < 0.01)。与对照组相比,隐窝深度(黑色箭头)没有明显变化(P > 0.05)(图 1C-D)。PAS 染色产生了类似的结果。如图1B所示,未处理组的肠黏膜覆盖着一层厚厚的连续黏蛋白层和许多紫红色的杯状细胞(红色箭头)。然而,暴露于 8 mg/kg ATO 后,粘蛋白层变薄,杯状细胞数量显着减少。此外,与对照组和 4 mg/kg ATO 组相比,8 mg/kg ATO 治疗组的 SIgA 水平也显着降低(P < 0.05 或 P < 0.01,图 1E),而 DAO 含量则为随着 ATO 水平的增加,显着升高(P < 0.05,图 1F)。结果表明,砷会引起空肠损伤,从而影响营养物质的消化和吸收。
ATO暴露对空肠和血清砷含量的影响
如图 1G-H 所示,鸭空肠和血清中砷浓度呈剂量依赖性增加。与对照组相比,所有ATO治疗组血清和空肠组织中砷含量均显着升高(P < 0.001)。此外,8 mg/kg ATO 组的砷水平显着高于 4 mg/kg ATO 治疗组(P < 0.01 或 P < 0.001)。
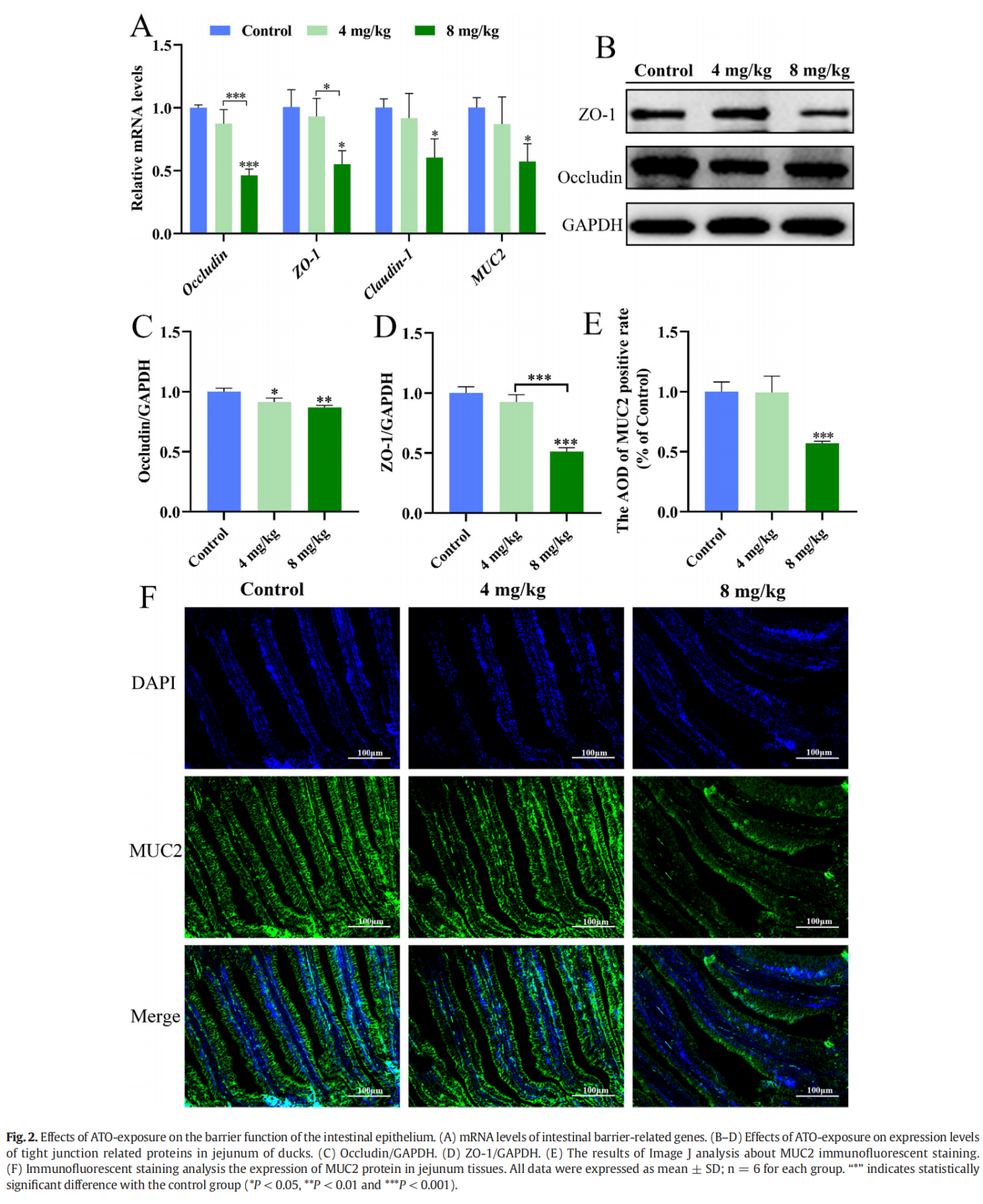
ATO暴露对肠道屏障功能的影响
为了研究 ATO 暴露是否通过破坏肠道屏障来增加组织毒性,我们评估了肠道屏障标志物。图 2A-D 显示了肠道屏障相关基因和蛋白质。与对照组相比,8 mg/kg ATO组Occludin、ZO-1、Claudin-1和MUC2的mRNA水平显着下调(P < 0.05或P < 0.001)。此外,8 mg/kg ATO 组中 Occludin 和 ZO-1 的 mRNA 水平显着低于 4 mg/kg ATO 组(P < 0.05 或 P < 0.001)。同样,与对照组相比,所有 ATO 治疗组的 Occludin 蛋白水平显着降低(P < 0.05 或 P < 0.01)。与对照组和4 mg/kg ATO组相比,8 mg/kg ATO组的ZO-1蛋白水平也明显降低(P < 0.001)。同时,MUC2 抗体的免疫荧光显示 ATO 降低了鸭空肠组织中的 MUC2 荧光强度(图 2E-F)。
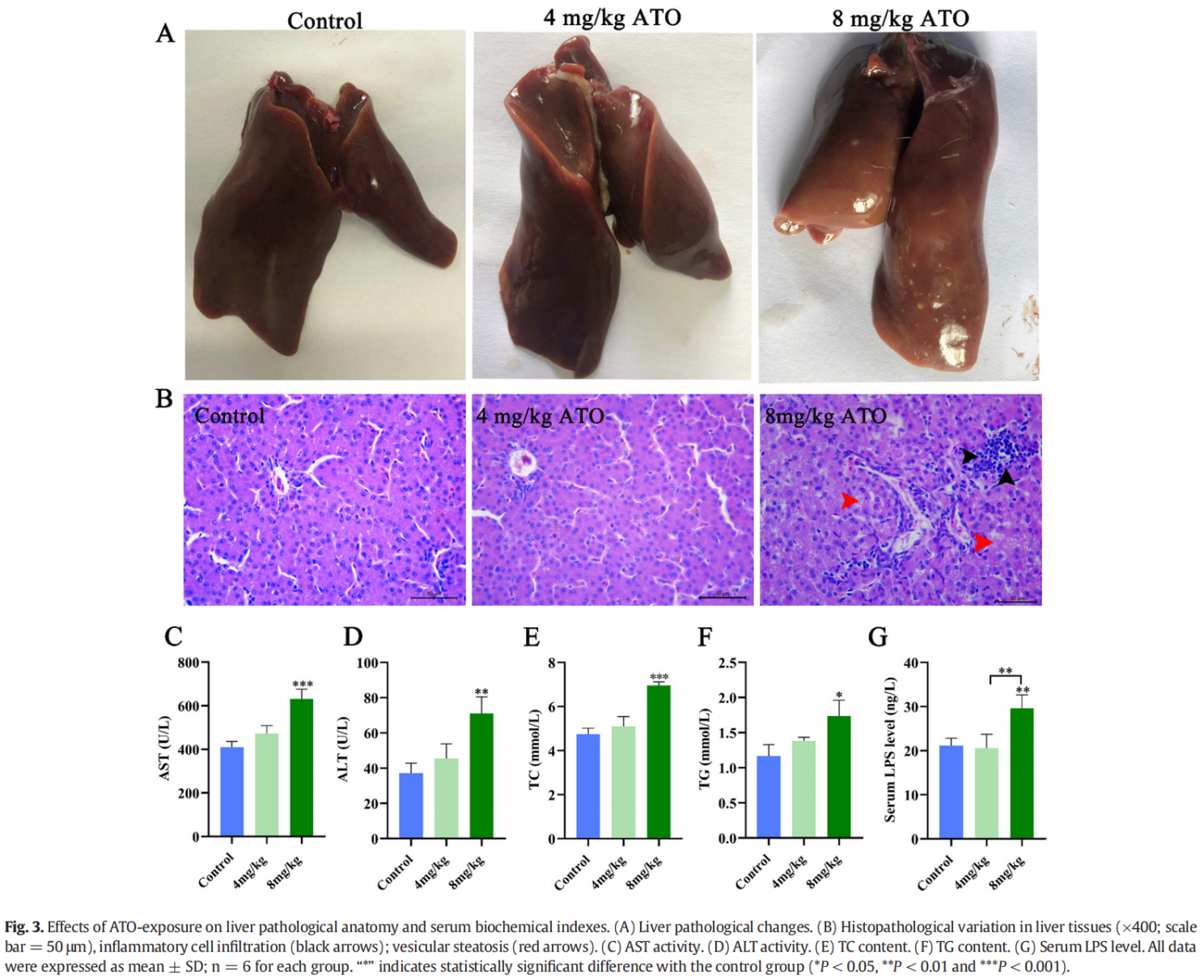
ATO暴露对肝脏组织病理学和生化指标的影响
如图 3A 所示,外观学检测显示 8 mg/kg ATO 组的肝脏表面有许多白色结节性病变。同样,组织病理学结果显示,与对照组相比,8 mg/kg ATO 组的肝脏有炎症细胞浸润(黑色箭头)和囊泡脂肪变性(红色箭头)(图 3B)。此外,增加的血清 AST、ALT、TC 和 TG 水平证实 8 mg/kg ATO 组的鸭有严重的肝损伤和脂肪变性(P < 0.05 或 P < 0.01 或 P < 0.001,图 3C-F)。值得注意的是,8 mg/kg ATO 治疗组的血清 LPS 水平显着高于对照组和 4 mg/kg ATO 组(P < 0.01,图 3G)。
ATO暴露对肠道菌群多样性的影响
在目前的微生物多样性分析中,我们使用 PacBio 平台对八个肠道内容物样本进行全长 16S rRNA 基因扩增,获得了 102,583 个原始 CCS 序列(范围 = 10,078 至 14,498)。剔除低质量 CCS 序列后,对照组和 8 mg/kg ATO 组分别获得了平均 54,518±747 和 45,050±1675 的高质量 CCS 序列。补充表 S2 提供了有关 CCS 序列的详细信息。基于 97% 的序列相似性,在两组中鉴定出 340 个 OTU,对照组和 ATO 组分别包含 43 个和 15 个独特的 OTU(图 4A)。
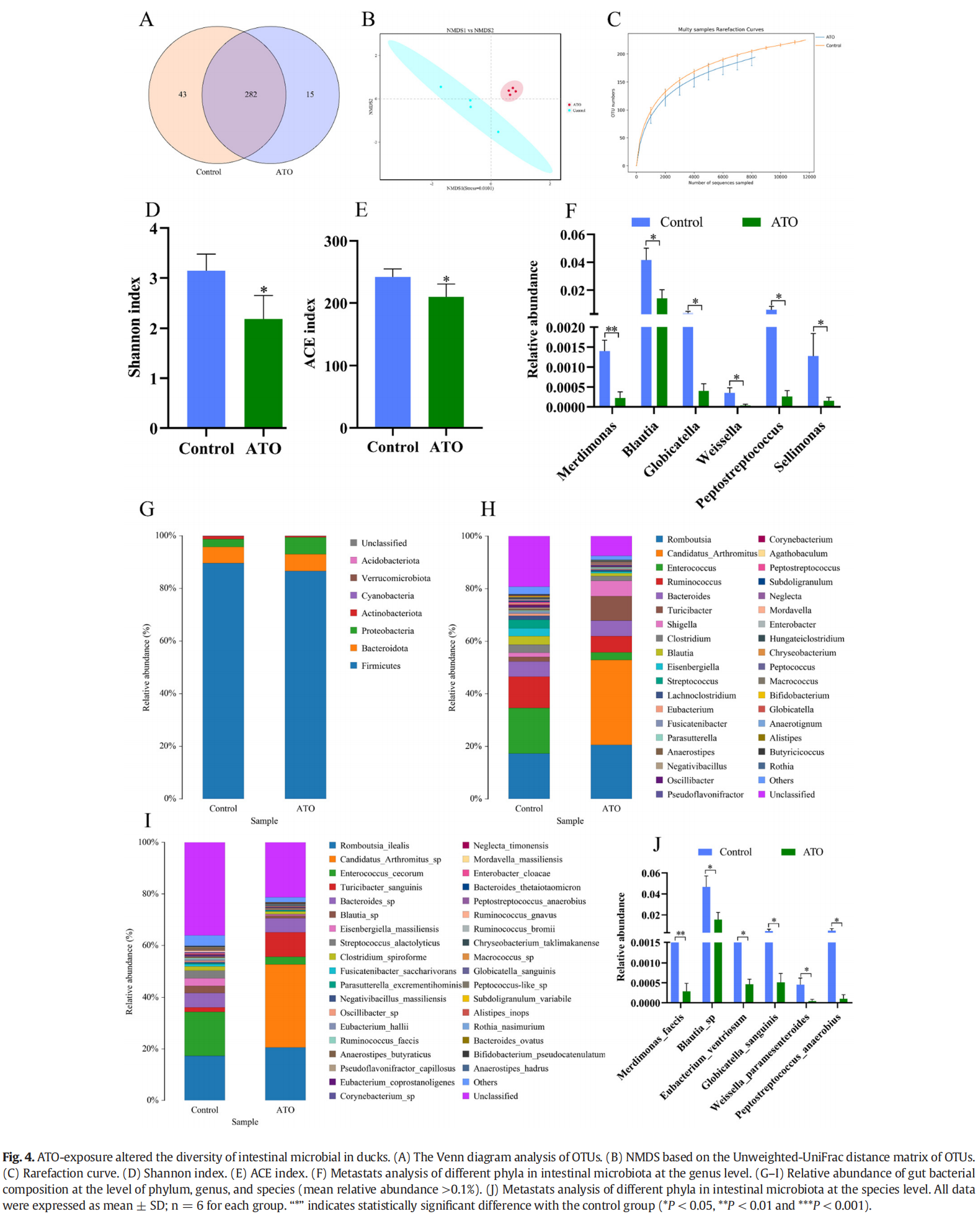
α 和 β 多样性分析都用于评估对照组和 ATO 治疗组之间肠道细菌群落多样性的差异。如图 4B 所示,NMDS 分析用于分析各组之间的 β-多样性,ATO 治疗组和对照组之间的肠道微生物群分布分别与每组聚类。此外,物种稀释性曲线趋于相对平坦,说明测序数量和深度符合后续分析的要求(图4C)。肠道微生物种群的α多样性通过群落丰度(ACE)和多样性指数(香农指数)来反映。与对照组相比,ATO 暴露显着降低了 ACE 和香农指数(P < 0.05,图 4D-E),这表明 ATO 暴露显着改变了鸭肠道微生物的丰富度和多样性。
我们进一步分析了空肠微生物群在门、属和种水平上的变化。在门水平(图 4G),Metastats 分析显示可检测门的丰度在对照组和 8 mg/kg ATO 组之间没有显着差异。值得注意的是,在诱导 ATO 后,鸭的肠道微生物群落中无法检测到两种细菌门(疣菌门和酸杆菌门)。此外,进一步使用Metastats分析来比较两组之间的属水平差异。如图 4F 所示,ATO 暴露显着降低了 Merdimonas、Blautia、Globicatella、Weissella、消化链球菌、Sellimonas 的相对丰度(P < 0.05)。在物种水平上,从所有样本中鉴定出 36 个物种(图 4I),并且相比于ATO 处理组, Merdimonas_faecis、Blautia_sp、Eubacterium_ventriosum、Globicatella_sanguinis、Weissella_paramesenteroides 和 Peptostreptococcus_anaerobius 的相对丰度在对照组更高 (P < 0.05,图 4J)。
ATO暴露对空肠组织NLRP3炎症小体活化的影响
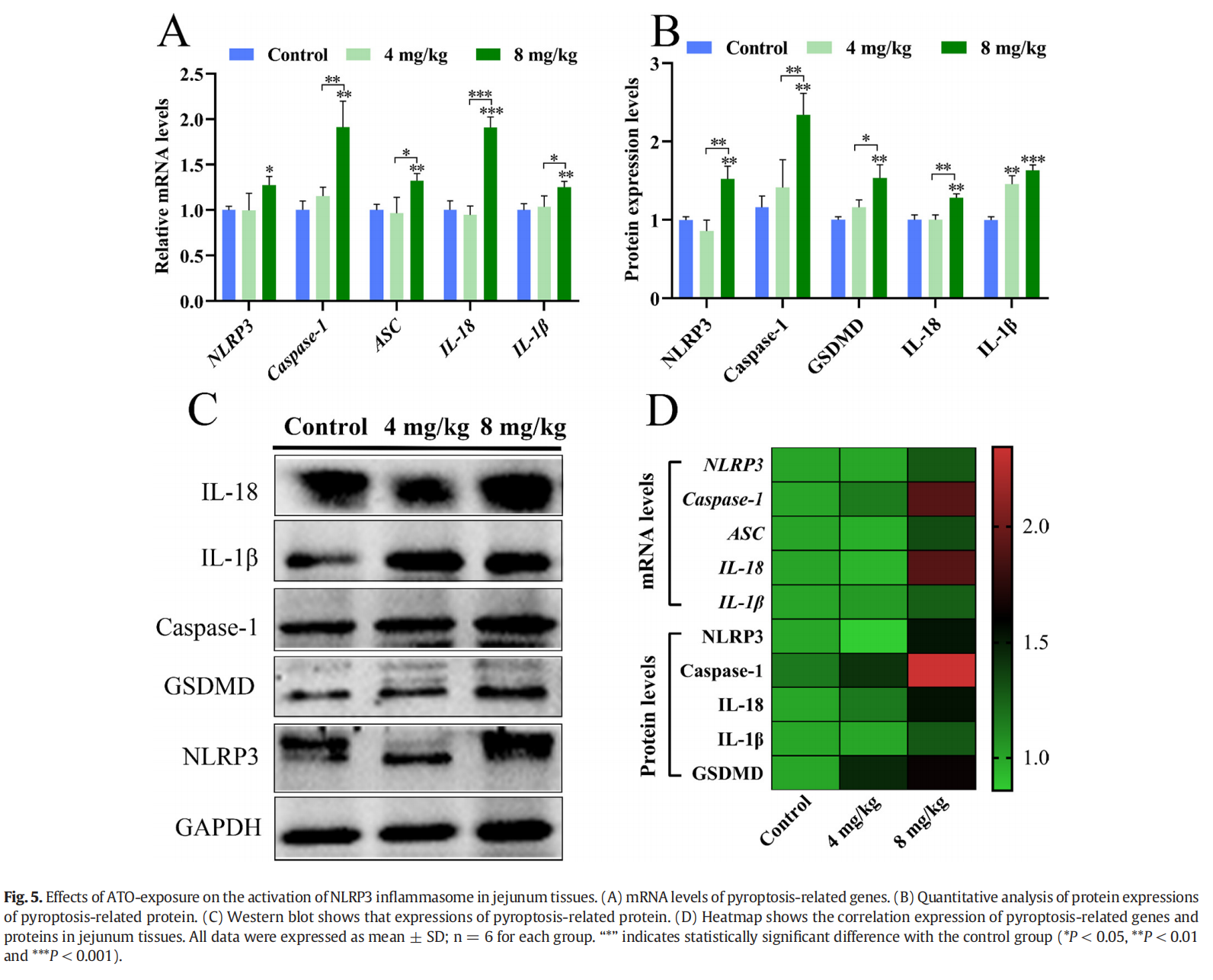
为了评估 ATO 诱导的炎症小体激活是否与肠道损伤有关,我们检查了炎症小体激活标志物的表达水平。从图 5A 可以看出,NLRP3、Caspase-1、ASC、IL-1β 和 IL-18 的 mRNA 表达水平随着 ATO 水平的增加而升高,与对照相比,8 mg/kg ATO 组和 4 mg/kg ATO 组出现显着差异 (P < 0.05 或 P < 0.01 或 P < 0.001)。同时,NLRP3、Caspase-1、GSDMD、IL-1β 和 IL-18 的蛋白质浓度在 8 mg/kg ATO 组中也显着增加(P < 0.01 或 P < 0.001,图 5B-C)。这些基因和蛋白质的变化在热图中直观地显示出来(图 5D)。这些结果表明,ATO 处理引发了鸭空肠组织中 NLRP3 炎症小体的激活和细凋亡。
ATO暴露对空肠组织IκB/NF-κB信号通路的影响
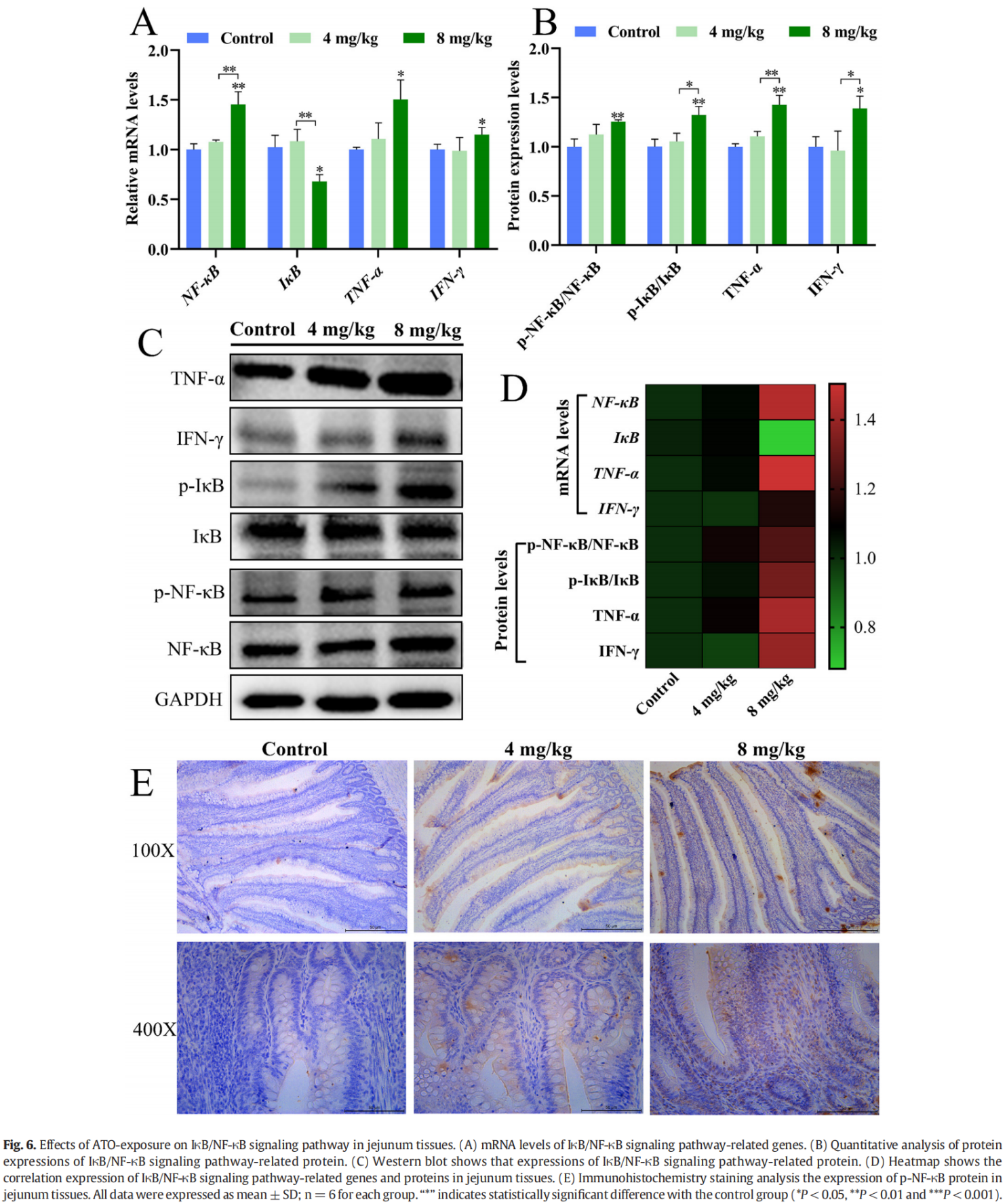
为了进一步确认 ATO 是否在空肠组织中诱导炎症反应,通过 qRT-PCR 和蛋白质印迹分析确定了空肠组织中 IκB/NF-κB 信号通路相关基因和蛋白质的水平,如图 6 所示。与对照组相比,8 mg/kg ATO 治疗组中 NF-κB、IFN-γ 和 TNFα 的 mRNA 水平显着升高,伴随着 IκB 水平的降低(P < 0.05 或 P < 0.01,图 2)。6A)。此外,ATO暴露下IFN-γ、TNFα、p-NF-κB/NF-κB和p-IκB/IκB蛋白水平也上调,8 mg/kg ATO组的变化为与对照组和 4 mg/kg ATO 组相比最明显(P < 0.05 或 P < 0.01 或 P < 0.001,图 6B-C)。这些基因和蛋白质的变化通过热图直观地显示出来(图 6D)。此外,免疫组织化学染色结果显示,8 mg/kg ATO 处理组的细胞核中呈阳性棕色颗粒,表明 p-NF-κB 在细胞核中表达(图 6E)。这些数据表明,8 mg/kg ATO 处理的鸭的空肠组织发炎,并且 IκB/NF-κB 信号通路被激活。
ATO 诱导肝脏炎症反应和细胞凋亡
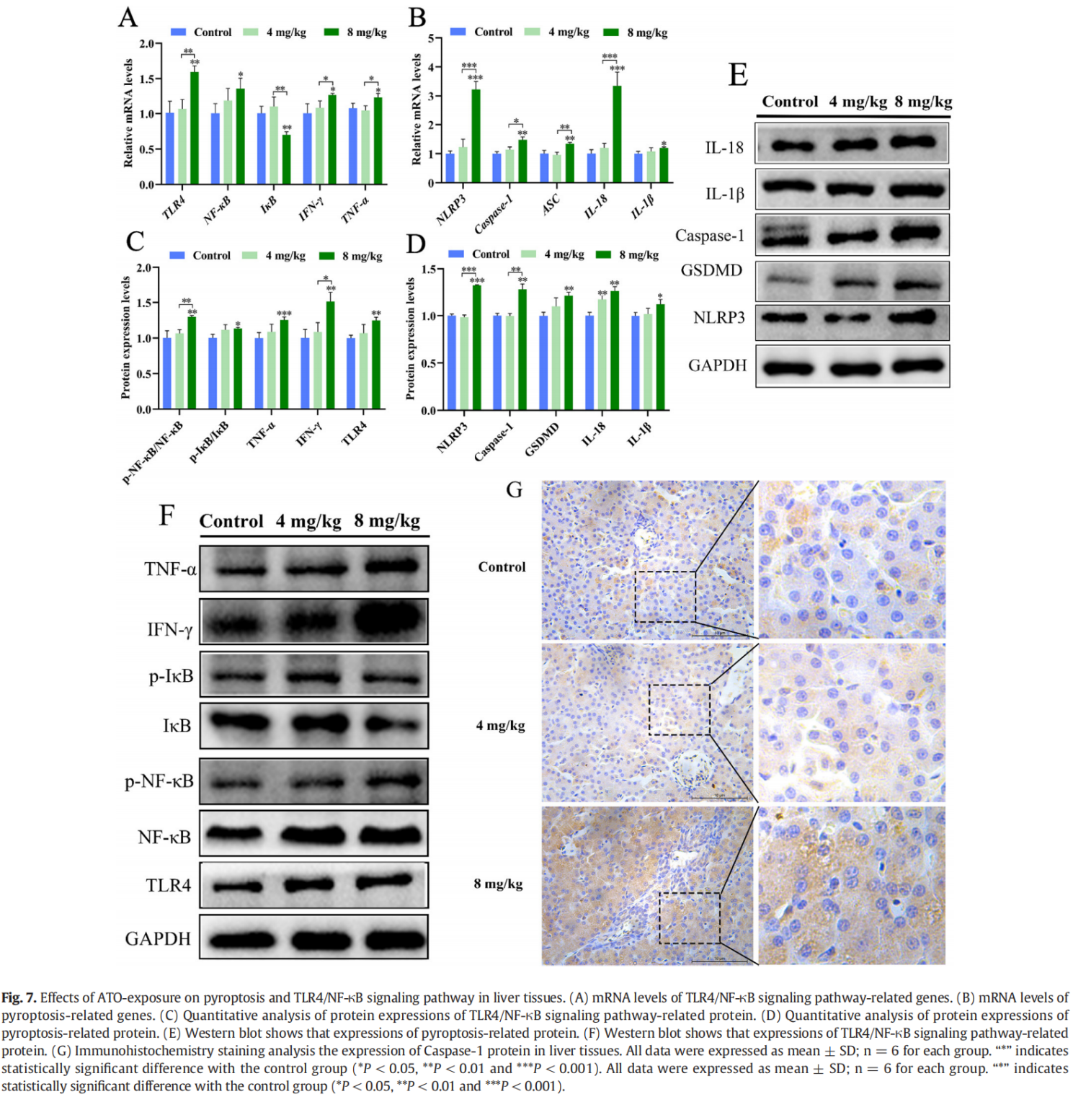
为了进一步研究 ATO 暴露对鸭肝炎症反应的影响,我们检测了 TLR4/NF-κB 相关基因的 mRNA 水平。如图 7A 所示,与对照组和 4 mg/kg ATO 组相比,8 mg/kg ATO 组中 TLR4、NF-κB、IFN-γ 和 TNF-α 的 mRNA 水平显着上调( P < 0.05 或 P < 0.01),而 IκB mRNA 水平显着下调(P < 0.05)。此外,与对照组相比,治疗组的 TLR4、p-NF-κB/NF-κB、p-IκB/IκB、TNFα 和 IFN-γ 蛋白水平显着升高(P < 0.05 或 P < 0.01或 P < 0.001;图 7C, F)。与 4 mg/kg ATO 组相比,8 mg/kg ATO 组的 p-NF-κB/NF-κB 和 IFN-γ 蛋白水平显着增加(P < 0.05 或 P < 0.01 图 7C,F)。为了探索 ATO 诱导肝损伤的机制,我们进行了进一步的实验以确定肝损伤是否与细胞凋亡有关。如图 7B 所示,与对照组相比,8 mg/kg ATO 暴露后 NLRP3、Caspase-1、ASC、IL-1β 和 IL-18 的 mRNA 表达显着增强(P < 0.05 或P < 0.01 或 P < 0.001)。类似地,与对照组和 4 mg/kg ATO 组相比,8 mg/kg ATO 治疗组的 NLRP3 和 Caspase-1 的蛋白质水平显着增加(P < 0.01 或 P < 0.001;图 7D-E,G)。此外,与对照组相比,8 mg/kg ATO 组的 GSDMD、IL-1β 和 IL-18 的蛋白质水平显着增加(P < 0.05 或 P < 0.01;图 7D-E)。因此,暴露于 8 mg/kg ATO 会在鸭肝组织中引起显着的炎症反应和细胞凋亡。
结论
我们的结果表明砷暴露会损害肠道屏障功能并导致鸭空肠炎症损伤。同时,过量的砷可通过触发 LPS/TLR4/NF-κB 信号通路和 NLRP3 炎症小体来诱导肝脏炎症和细胞凋亡。肠-肝轴的间接通路可能在 ATO 诱导的肝毒性和肠道毒性的潜在机制中起重要作用。该研究为水禽过量砷暴露的毒性研究提供了基础,并为深入了解砷的毒性机制提供了依据。








 京公网安备 11011302003368号
京公网安备 11011302003368号