
2019年11月2日Nat Cell Biol杂志在线发表了题为“Mitochondria-localised ZNFX1 functions as a dsRNA sensor to initiate antiviral responses through MAVS”的文章,该文章由中山大学生命科学学院徐安龙教授团队完成,其中RNA-seq部分由百迈客协助完成,详细情况如下:
英文题目:Mitochondria-localised ZNFX1 functions as a dsRNA sensor to initiate antiviral responses through MAVS
中文题目:线粒体定位的ZNFX1充当dsRNA传感器通过MAVS启动抗病毒反应
发表杂志:Nature Cell Biology,2019
影响因子:17.728
合作单位:中山大学生命科学学院
小编悄悄告诉您,近期百迈客医学的高分合作文章不少,趁着年前陆续解读给各位fans,咱们也看看人家是如何设计文章思路的。
研究背景
过去的二十年的研究表明,属于解旋酶超家族2(SF2)的DExD/H-bo解旋酶在抗病毒先天免疫中起着至关重要的作用。但是,与SF2共享一个保守的解旋酶核心(两个串联的RecA域组成,具有ATPase活性和RNA结合能力)的解旋酶SF1的抗病毒功能鲜为人知。
病毒衍生的核酸与胞质病毒传感器结合后,可以募集两个配体MAVS和STING来诱导I型干扰素(IFN)的产生以及许多具有抗病毒活性的干扰素刺激基因( Interferon Stimulated Genes,ISG)。这些ISGs在多种抗病毒免疫水平上发挥着多种功能,比如ISGs可抑制特定的病毒生命周期阶段,此外,某些ISGs还可以增强先天病原体的识别能力或积极调节IFN信号传导。
研究目的:
确定很少研究的解旋酶SF1的抗病毒功能并鉴定更多ISGs。
研究方法
已发表数据重新挖掘:水疱性口炎病毒(VSV)感染的人单核细胞衍生巨噬细胞(MDM)的IVT-SAPAS(in vitro transcription-sequencing alternative polyadenylation sites)时间梯度数据,筛选新的可能基因–包含ZNFX1。
关键基因抗病毒作用验证:1)敲减关键基因表达,VSV-eGFP感染检测这些基因的抗病毒活性–初步证实ZNFX1参与抗病毒反应;2)qRT-PCR或免疫印迹分析VSV感染或干扰素诱导剂聚肌胞苷酸(poly(I:C))刺激各细胞系或小鼠后组织中ZNFX1表达改变;3)病毒感染公共数据挖掘,感染后ZNFX1表达上调;
ZNFX1为干扰素刺激基因ISG验证:人重组IFN-α和IFN-β孵育实验、JAK1抑制剂鲁索替尼(ruxolitinib)、Ifnar1敲除后qRT-PCR和免疫印迹分析ZNFX1表达水平;转录因子预测及转录因子motif缺失和WT报告基因试验证实其病毒感染后的上调取决于JAK1-STAT1级联反应。
体外和在体实验证明ZNFX1抗RNA病毒天然免疫调控作用:A549、L929细胞、293T细胞、小鼠等siRNA沉默或Crispr-cas9敲除VSV感染实验,ZNFX1过表达和对照组A549细胞转录组测序分析其影响的信号通路。
ZNFX1与IFN信号传导:ZNFX1过表达质粒和Ifnb1-reporter或IFN刺激的应答元件(ISRE)报告质粒瞬时转染A549细胞进行萤光素酶报告基因分析,然后进行或不进行VSV感染,等实验证实ZNFX1通过诱导I型IFN的产生而参与抗病毒免疫反应,其抗病毒特性也取决于IFN信号传导。
ZNFX1与病毒RNA结合:pulldown实验和RIP-seq等;
ZNFX1线粒体定位以及互作的IFN产生相关adaptor分析:不同组分分离WB、显微共聚焦实验、Co-IP实验、线粒体组分分离及蛋白酶保护测定等;poly(I:C)处理与否的Rig-I-/-A549细胞RNA-seq,空载EV、ZNFX1过表达、EV+poly(I:C)、ZNFX1+poly(I:C),共计4组;等
研究结果
1、病毒感染诱导ZNFX1表达
作者首先分析了他们先前发表的被水疱性口炎病毒(VSV)感染的单核细胞衍生巨噬细胞(MDM)的IVT-SAPAS(in vitro transcription-sequencing alternative polyadenylation sites)数据,并发现了许多表达改变的基因。【之前已发表文章的数据重新挖掘】通过比较受VSV感染的人MDM数据和小鼠腹膜巨噬细胞数据,发现了一些共同的基因,它们被上调了三倍以上,包括FFAR2,ZEB2,TIPAP,PTGS2,CMPK2,ZNFX1和CSRNP1。随后敲除A549细胞中的这些基因,用VSV-eGFP(VSV-增强型绿色荧光蛋白)感染细胞,流式细胞术检测GFP阳性细胞的百分比表明,敲减ZNFX1(其抗病毒作用尚未见报道)促进了VSV感染。
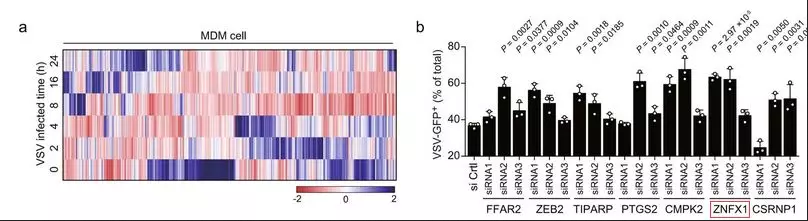
补充图1
研究表明,属于RNA解旋酶SF2的DExD/H-box RNA解旋酶在抗病毒免疫反应中起着多种作用。ZNFX1是RNA解旋酶SF1的代表,它包含一个ARM(Armadillo-type fold)域、一个P环解旋酶域和一个锌指(ZF)域。因为来自解旋酶SF1和SF2的基因共享一个保守的核心结构,以两个串联的RecA域为特征,所以作者认为SF1也可能在抗病毒免疫中发挥重要作用。
为验证假设,作者使用IVT-SAPAS数据分析了SF1和SF2的基因表达谱,发现这两个亚家族中的许多基因在VSV感染后表达都有变化(图1a)。流式细胞仪分析结果表明,敲低A549细胞中的MOV10、HELZ2、UPF1和ZNFX1导致VSV复制明显增强,而敲除SEXT引起相反的结果。MOV10、UPF1和SEXT以前被报道与抗病毒免疫有关,验证了基于RNAi和病毒感染的筛选方法有效,并暗示ZNFX1可能是未发现的抗病毒分子。
为了更深入地了解ZNFX1在抗病毒应答中的作用,进行了qRT-PCR或免疫印迹分析,以了解VSV感染或干扰素诱导剂聚肌胞苷酸(poly(I:C))刺激A549细胞、外周血单个核细胞(PBMC)或小鼠胚胎成纤维细胞(MEF)细胞后ZNFX1的表达上调(图1b–d)。qRT-PCR也证实了静脉注射VSV后小鼠脾脏和肺中Znfx1的丰度上调(包括胸腺、淋巴结脾脏和肺)(图1e)。作者还对先前收集的芯片数据集(GDS4231/4214/1271/3210/6082/6063)进行了统计分析,发现与健康对照相比,在HIV感染患者和猿猴免疫缺陷病毒(SIV)引起的脑炎猴子中,Znfx1的RNA水平明显更高(图1f,g)。此外,在不同的细胞类型(包括巨噬细胞、树突状细胞和上皮细胞)中感染病毒后,Znfx1的转录显著增加。这些数据都表明ZNFX1可能是抗病毒分子。
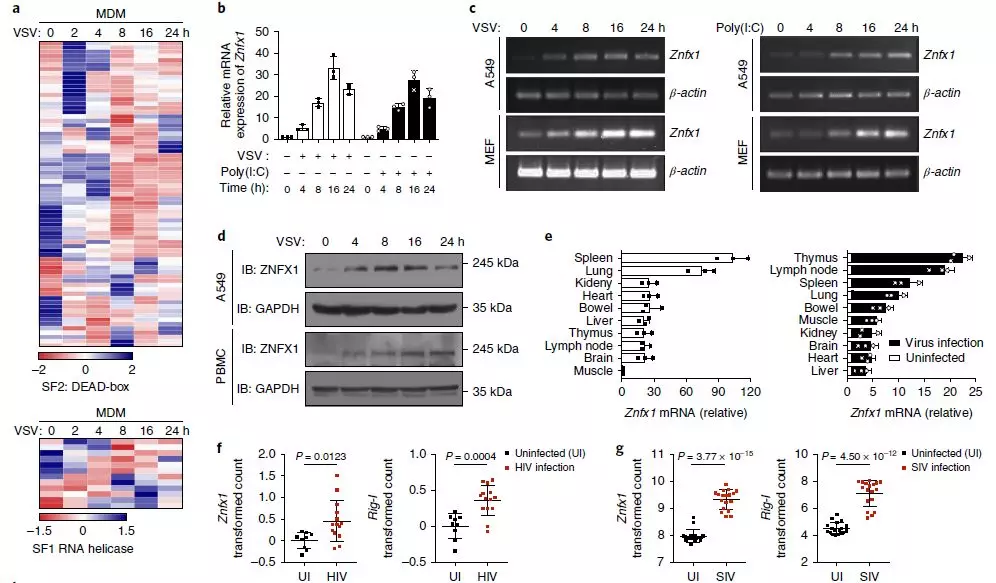
图1_上
2、ZNFX1是干扰素刺激基因ISG
由于病毒感染导致ZNFX1的mRNA和蛋白质水平表达均增强,接下来通过将A549细胞与人重组IFN-α和IFN-β一起孵育来检测ZNFX1是否为ISG。qRT-PCR和免疫印迹分析的结果表明ZNFX1的表达可以被IFN-α和IFN-β诱导(图1h,i)。相比之下,JAK1抑制剂鲁索替尼(ruxolitinib)可以抑制VSV对Znfx1 mRNA的诱导,并且在Ifnar1-/-A549细胞中几乎消失(图1j,k)。
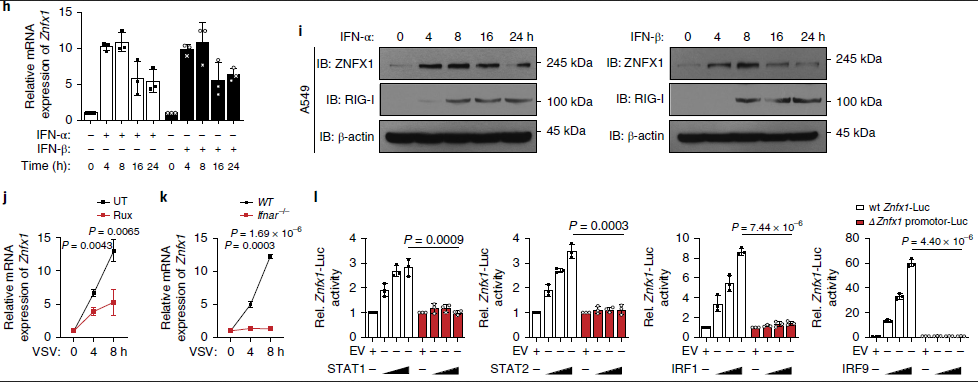
图1_下
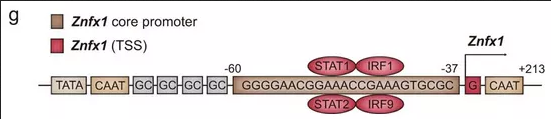
为了确定哪些核苷酸和区域Znfx1转录中很重要,使用promoter 2.0( http://www.cbs.dtu.dk/services/promoter/)、JASPAR(http://jaspar.genereg.net/)和CpGplot(http://www.ebi.ac.uk/Tools/seqstats/emboss_cpgplot/)进行识别,其中包含TATA框、GC框和CAAT框的Znfx1的-1,064~+63之间的区域,是启动子。对转录因子结合位点的进一步分析表明,Znfx1的启动子在相对集中和重叠的区域中包含STAT1、STAT2、IRF1和IRF9结合基序。基于这些分析,构建了一个Znfx1启动子报告基因载体,包含−1,064~+63之间的区域,以及一个突变的报告基因构建体,其中缺失了STAT1、STAT2、IRF1和IRF9结合motif。接下来,STAT1,STAT2,IRF1或IRF9过表达质粒和2个报告基因载体转染293T细胞,报告基因分析表明,在STAT1、STAT2、IRF1或IRF9存在的情况下,报告基因的表达可以由Znfx1启动子诱导,而不能由缺少转录因子结合位点的启动子载体诱导(图1l)。总而言之,ZNFX1是一个ISG,其病毒感染后的上调取决于JAK1-STAT1级联反应。
3、ZNFX1对于抗RNA病毒天然免疫至关重要
为了进一步探讨ZNFX1在抗病毒免疫反应中的作用,作者沉默了A549和L929细胞中ZNFX1的内源性表达,用VSV-eGFP感染,并进行流式细胞仪分析。结果表明,Znfx1的敲低显著增强了A549和L929细胞中的VSV复制(图2a)。同时,在Znfx1沉默细胞中观察到更高的VSV滴度和增加的VSV-G蛋白(图2b,c)。一致地,在VSV感染或poly(I:C)刺激后,敲低Znfx1表达可显著降低A549细胞中IFN-α和IFN-β蛋白的产生。相反,当ZNFX1过表达时,在A549细胞中观察到了较低的VSV mRNA和VSV滴度。
为了获得ZNFX1在抗病毒反应中的更多功能证据,采CRISPR介导的基因组编辑方法敲除293T和A549细胞中的Znfx1。同样发现293T和A549细胞中敲除Znfx1增强了VSV复制(图2d)。同时,在野生型或Znfx1-/-A549细胞中ZNFX1的过表达限制了VSV复制(图2e)。进一步的RNA-seq分析比较了野生型对照和ZNFX1过表达的A549细胞之间差异表达基因,结果显示参与病毒复制和I型IFN信号转导负调控的上调基因显著富集(图2f)。有趣的是,在脑心肌炎病毒EMCV和甲型流感病毒(H1N1)感染的Znfx1敲低的A549细胞中,病毒mRNA水平升高,但在单纯疱疹病毒1型(HSV-1)感染后并未显著改变,表明ZNFX1具有广泛的抗RNA病毒谱 。
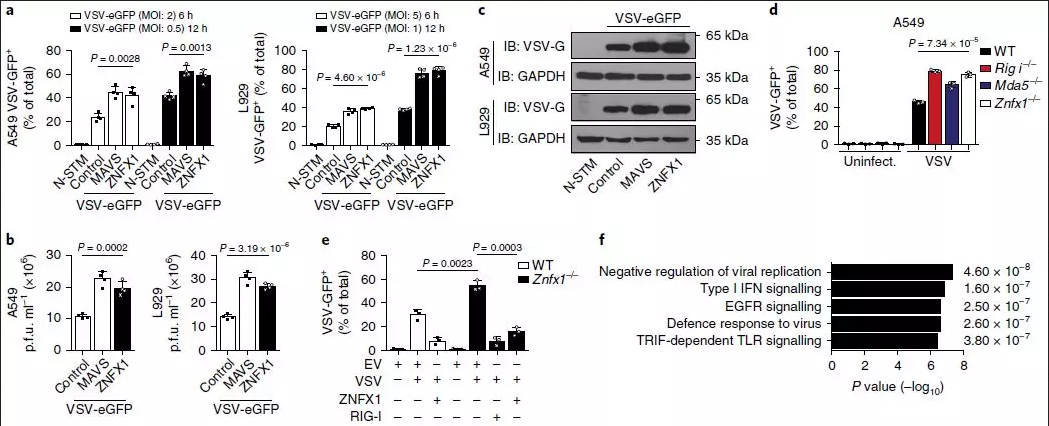
图2_上
为了研究ZNFX1在体内的生理作用,使用CRISPR/Cas系统生成了Znfx1-/-C57BL/6J小鼠。Znfx1-/-小鼠存活,没有明显的生理或行为异常。在这项研究中使用了六至八周大的小鼠。首先,分离野生型和Znfx1-/-小鼠的BMDM并用VSV、EMCV、H1N1或HSV-1感染,与野生型相比,Znfx1-/-BMDM的IFN-α或IFN-β分泌较低。RNA病毒感染后,包括VSV、EMCV和H1N1,但不包括HSV-1(图2g),Znfx1-/-BMDM中检测到较高的病毒mRNA水平,但在HSV-1感染的细胞中未检测到较高的病毒mRNA水平(图2h)。与野生型相比,Znfx1-/- MEF和A549细胞在RNA病毒感染VSV和EMCV后表现出较低的IFN-β分泌(图2i,j)。
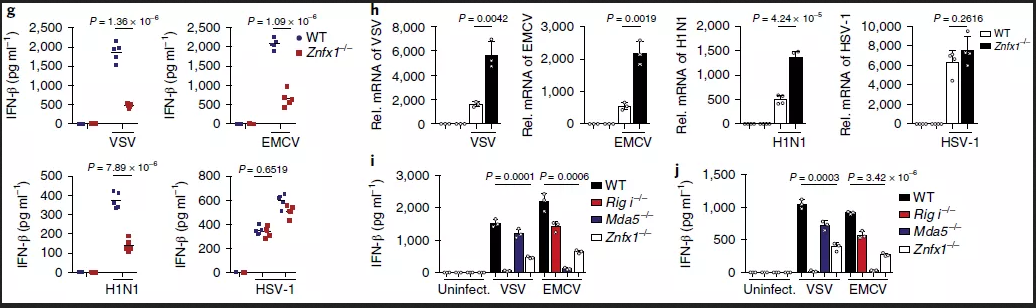
图2_下
ZNFX1在宿主体内对抗病毒感染的防御中的重要性:通过尾静脉向野生型和Znfx1-/-小鼠注射了VSV。与野生型小鼠相比,Znfx1-/-小鼠的肺和肝中的VSV复制增强了(图3a),随着肺和肝中Ifnb1表达的减少,在Znfx1-/-小鼠中血清中IFN-α和IFN-β的分泌降低(图3b,c)。而HSV-1感染后,Znfx1-/-和野生型小鼠之间血清中的IFN-α和IFN-β没有差异(图3c)。有趣的是,VSV感染一天后,Znfx1-/-小鼠中有80%患有结膜炎,这是VSV感染的早期症状(图3d)。另外,观察到VSV感染后炎性细胞更多地渗透到Znfx1-/-小鼠的肺中(图3e),并且Znfx1-/-小鼠在存活试验中对VSV感染的抵抗力较弱(图3f)。这些数据表明,Znfx1缺乏后体内产生较少的I型IFN,削弱了针对RNA病毒感染的先天免疫反应。总之,ZNFX1专门针对RNA病毒发挥其抗病毒特性。
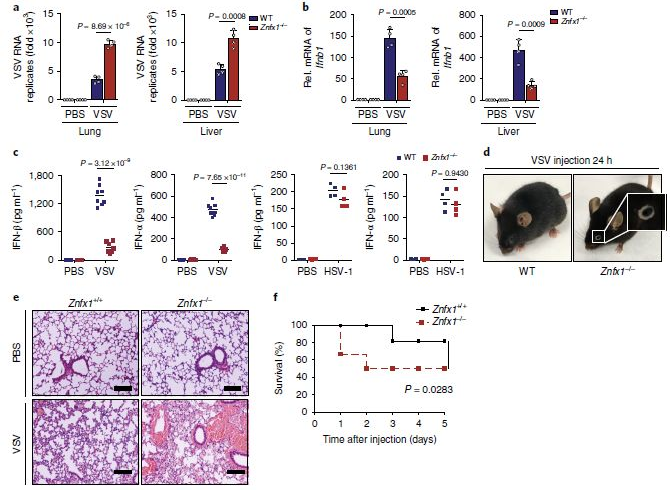
图3
4、ZNFX1启动基于IFN的抗病毒反应
为了研究ZNFX1在IFN信号传导中的作用,通过ZNFX1过表达质粒和Ifnb1-reporter或IFN刺激的应答元件(ISRE)报告质粒瞬时转染A549细胞进行萤光素酶报告基因分析,然后进行或不进行VSV感染。结果表明,ZNFX1的过表达轻微激活了Ifnb1启动子和ISRE报告基因(图4a)。此外,ZNFX1以剂量依赖的方式显著增强了由VSV、2种类型的poly(I:C)或poly(dA:dT)触发的Ifnb1启动子激活(图4b,c)。相反,敲除Znfx1可降低VSV诱导的293T细胞中Ifnb1报告基因和ISRE报告基因的激活(图4d)。Ifnb1和ISGs的转录以剂量和时间依赖性的方式诱导(图4e),当ZNFX1在A549细胞中过表达时随着剂量和时间增强反之敲除ZNFX1则降低。而与野生型细胞相比,Znfx1-/-A549和MEF细胞中ISG蛋白表达量分别减少(图4f)。VSV感染后Znfx1-/-巨噬细胞中TBK1和IRF3的磷酸化低于野生型巨噬细胞(图4g)。在VSV感染的Znfx1-/-293T细胞中,IRF3的二聚化也低于野生型细胞(图4h)。野生型A549细胞中观察到了VSV的限制性复制,但在Ifnar1-/-A549细胞中未观察到(图4i)。所有这些数据表明,ZNFX1通过诱导I型IFN的产生而参与抗病毒免疫反应,其抗病毒特性也取决于IFN信号传导。
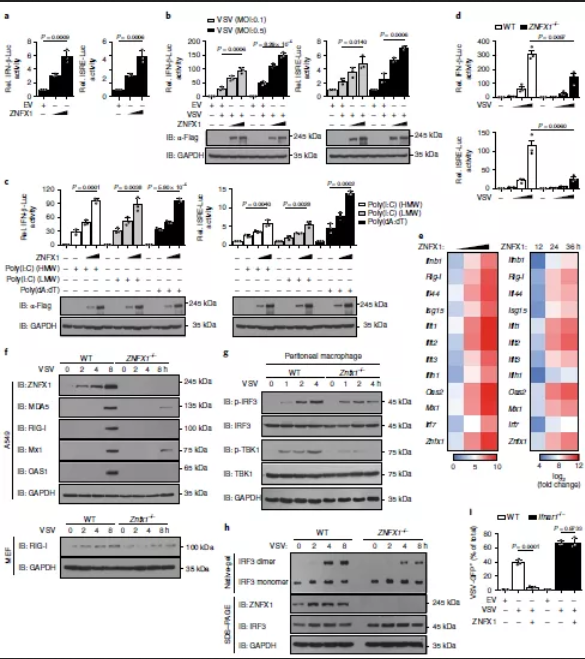
图4
5、ZNFX1直接结合病毒RNA
属于RNA解旋酶SF2的许多基因被鉴定为结合病毒RNA的RNA病毒传感器,因此假设属于SF1的ZNFX1也可能作为RNA传感器结合病毒RNA。为证实这一假设,首先在293T细胞中过表达ZNFX1,然后进行pulldown和qRT-PCR分析以确定ZNFX1与VSV-RNA的高结合能力(图5a,b)。也检测了内源性ZNFX1与A549细胞中的VSV,EMCV和仙台病毒(SeV)RNA的结合能力(图5c)。通过用抗内源性ZNFX1的抗体从免疫沉淀物中分离RNA来进行RNA免疫沉淀(RIP)测序分析,将ZNFX1相关的RNA比对到VSV基因组(图5d),优先定位于约6,000-8,000 nt的VSV片段(图5e)。值得注意的是,当与ZNFX1相关的RNA转染到A549细胞中时,通过qRT-PCR和荧光素酶活性分析观察到了Ifnb1的诱导转录和基于Ifnb1启动子的报告基因的诱导表达(图5f)。
为了进一步评估与ZNFX1结合的病毒RNA的性质,首先将核酸类似物连接的磁珠与经Flag标记的ZNFX1、RIG-I或MAVS过表达的293T细胞裂解液一起孵育,并进行了pulldown试验以显示ZNFX1和RIG-I蛋白与poly(I:C)结合,但不与poly(C)结合(图5g)。cGAS而非ZNFX1结合单链和双链DNA(ISD,一个45 bp的双链DNA;图5h)。竞争实验显示ZNFX1蛋白与HMW poly(I:C)优先结合,而不是与LMW poly(I:C)、poly(dA:dT)或5’pppdsRNA优先结合(图5i)。为了找到ZNFX1的poly(I:C)结合位点,准备了ZNFX1的截短版本并进行了poly(I:C) pulldown实验。结果表明,ZNFX1与poly(I:C)的结合需要ARM域和P环结构域,而不是ZF锌指域(图5j)。病毒感染后ZNFX1的寡聚化增强(图5k,1)。因此,ZNFX1充当RNA病毒传感器,它倾向于结合长RNA分子。
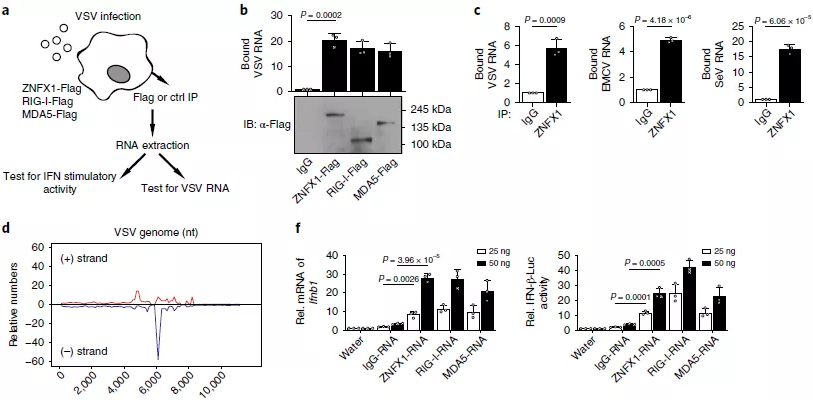
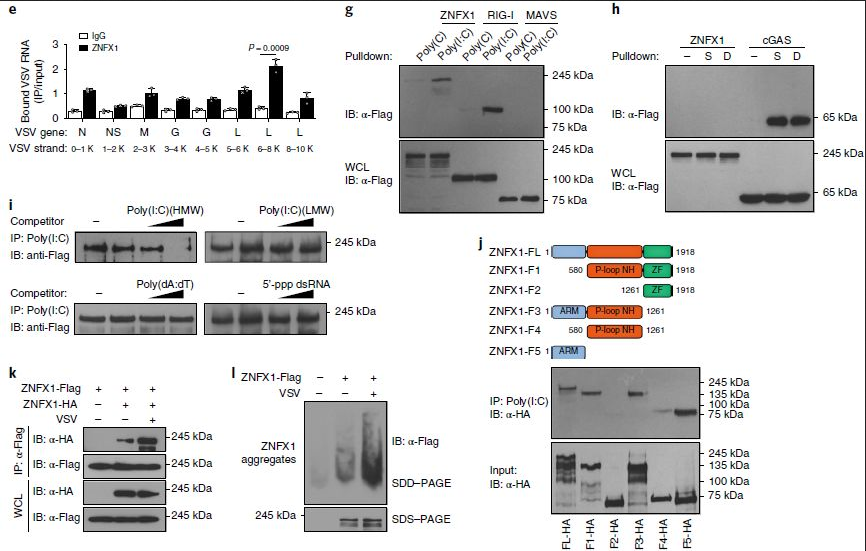
图5
7、ZNFX1定位于线粒体并与MAVS相互作用
为了确定ZNFX1的亚细胞定位,将受VSV感染的细胞分为细胞质和细胞核部分,主要在细胞质中检测到ZNFX1蛋白(图6a)。以前有关含ARM域的蛋白ALEX3和ARM1的研究表明,这些蛋白是线粒体定位的。因此,通过免疫印迹分析确定ZNFX1是否也可以定位于该免疫相关细胞器上。结果显示,从VSV感染的细胞中分离出的线粒体部分中ZNFX1蛋白量增加(图6a)。共聚焦显微镜证实过表达的ZNFX1蛋白与线粒体共定位,病毒感染后观察到ZNFX1斑点扩大(图6b)。为了进一步探索ZNFX1的线粒体定位,进行了蛋白酶保护测定。如图6c所示,当用不含Triton X-100的蛋白酶K处理线粒体时,MAVS和大多数ZNFX1蛋白被消化,表明ZNFX1是线粒体外膜蛋白。相反,细胞色素c氧化酶亚基IV(COX IV)是线粒体内膜蛋白,对蛋白酶K消化有抵抗力。进一步对线粒体进行碱提取,回收具有外周膜蛋白的上清液和具有完整膜蛋白的沉淀物,发现外膜整合蛋白MAVS主要在提取后的沉淀中回收,但在2个馏分中均观察到了COX IV。ZNFX1在上清液中大量回收(图6c),表明ZNFX1作为外周膜蛋白定位于线粒体,如先前报道中的SARM1和ALEX3。
为了进一步表征ZNFX1在感测病毒RNA时如何转导抗病毒信号,检查了ZNFX1与涉及IFN产生的配体(包括TRIF、MyD88,MAVS和STING)的相互作用。免疫共沉淀实验表明,带有HA标记的ZNFX1与带有Flag标记的MAVS相关,但与TRIF、MyD88和STING无关(图6d)。免疫沉淀(Co-IP)实验进一步表明,ZNFX1和MAVS在A549细胞中形成天然复合物,并且病毒感染后ZNFX1表达上调而增强了它们的结合(图6e-g)。共聚焦显微镜实验还表明ZNFX1与MAVS共定位(图6h)。使用一系列ZNFX1截短突变体进行进一步的免疫沉淀试验表明,全长ZNFX1和含ARM的突变体,包括F3和F5,都可以与MAVS相互作用(图6i)。与共免疫沉淀试验一致,ZNFX1的全长和F3截短突变体过表达导致了Ifnb1和ISG的诱导表达以及受限制的VSV复制(图6j)。此外,如果没有跨膜(TM)域,ZNFX1不能与截短的MAVS相互作用(图6k),ZNFX1的线粒体分布与其与MAVS的相互作用无关。
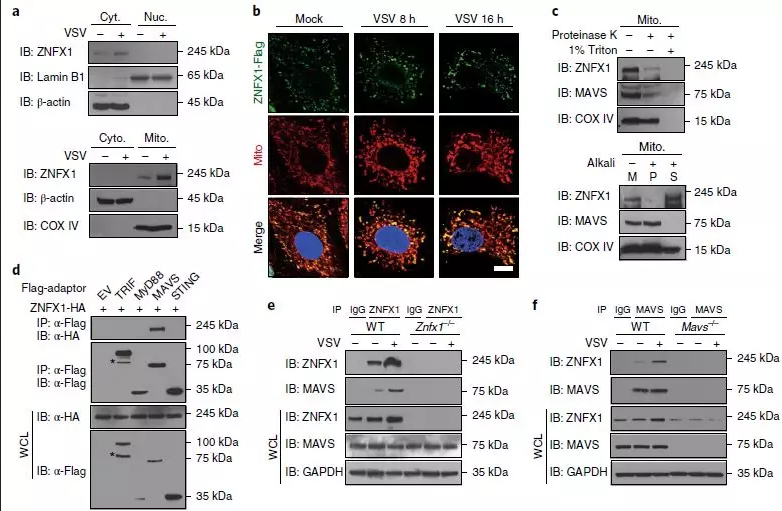
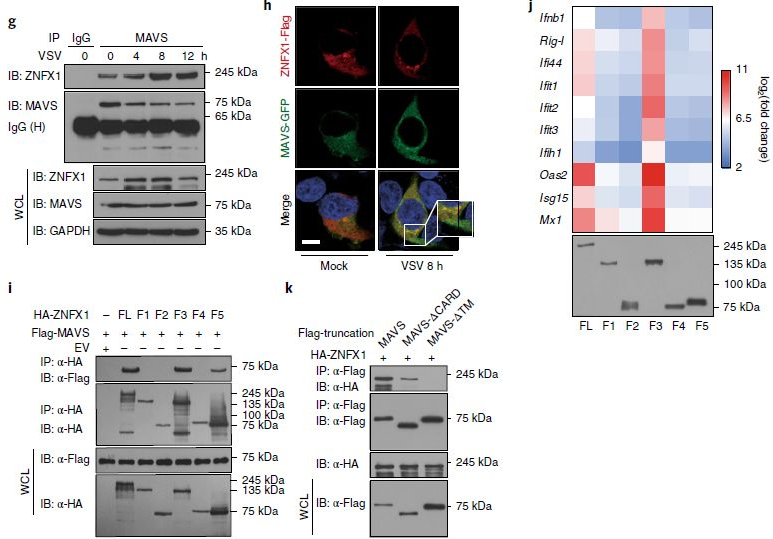
图6
7、ZNFX1介导的信号独立于RIG-1和MDA5
为了验证ZNFX1在产生独立于现有抗病毒传感器RIG-1和MDA5的抗病毒免疫反应中的作用,首先进行了共免疫沉淀试验,发现ZNFX1在静止或受VSV感染的细胞中既不与RIG-1也不与MDA5相互作用,qRT-PCR分析结果表明Znfx1缺乏并不影响RIG-1、MDA5和MAVS介导的Ifnb1表达的诱导(图7a)。此外,过表达的ZNFX1可以强烈诱导野生型和Mda5-/-细胞中Ifnb1和Ifit1的mRNA表达,在Rig-I-/-细胞中略有诱导,但在Mavs-/-细胞中则没有效果(图7b)。当分别用ZNFX1、RIG-1和MDA5过表达质粒转染细胞时,Mda5-/-细胞中VSV和EMCV的病毒载量降低(图7c)。同样,FACS分析表明,VSV-eGFP感染的野生型、Mda5-/-和Rig-I-/-细胞中的GFP+细胞百分比降低(7d,e)。通过进行poly(I:C)处理与否的Rig-I-/-A549细胞RNA-seq,观察到ZNFX1的过表达增强了poly(I:C)刺激下Rig-I-/-A549细胞中IFN和ISG的诱导(图7f)。分别用ZNFX1或RIG-I过表达质粒转染Znfx1和Rig-I双敲除细胞(DKO)中VSV和poly(I:C)诱导的Ifnb1和Ifit1表达增强(图7g,h)。此外,ZNFX1的siRNA敲低可以进一步增强Rig-I-/-细胞中VSV-eGFP的病毒载量(图7i)。DKO细胞中VSVeGFP的病毒载量远高于Rig-I-/-细胞中的病毒载量(图7j)。所有这些结果表明ZNFX1无需依赖RLR(视黄酸诱导基因/RIG-1样受体)即可发挥其抗病毒作用。
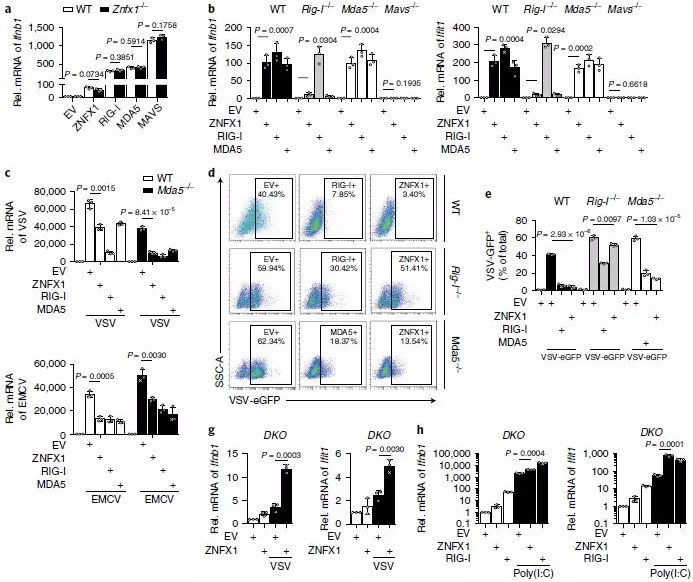
图7
小结
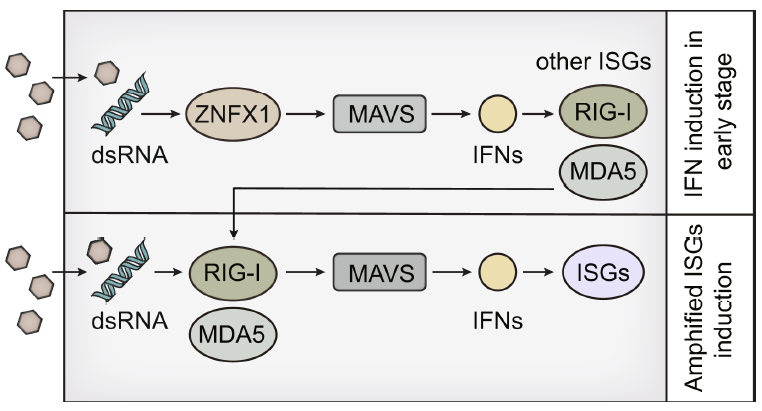
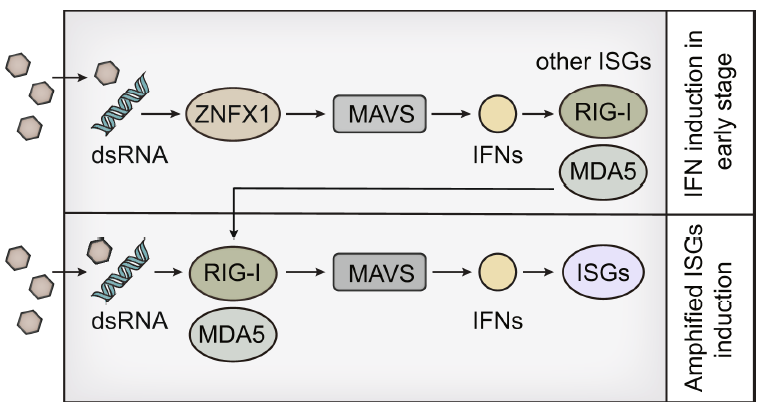
总之,作者分析了先前发表的水疱性口炎病毒(VSV)感染的单核细胞衍生巨噬细胞(MDM)体外转录-多聚腺苷酸化位点测序(IVT-SAPAS)数据,确定ZNFX1(解旋酶SF1的成员)为ISG和线粒体定位的dsRNA传感器。ZNFX1可以通过感测病毒RNA并与MAVS相互作用而在RNA病毒感染后立即启动IFN和ISG表达,而无需依赖RLR(视黄酸诱导基因/RIG-1样受体)。ZNFX1的鉴定不仅阐明了RNA解旋酶SF1在抗病毒免疫中的功能,而且为抗病毒治疗提供了目标。
图片文献下载:
https://international.biocloud.net/zh/article/detail/31685995
(复制链接到浏览器或点击阅读原文获取,如果没有云平台账号需要先注册一下)






 京公网安备 11011302003368号
京公网安备 11011302003368号