目的
- 动脉粥样硬化病变有着复杂的细胞成分,可以使用选定的标记分子进行研究。
- 在小鼠和人类动脉粥样硬化中,使用单细胞RNA测序的方法利于对免疫细胞展开研究。
- 对广泛的人类颈动脉斑块进行单细胞RNA测序,提供了各种细胞类型及其表型的详细细胞图谱,包括不同的内皮细胞和平滑肌细胞簇。
- 巨噬细胞和T细胞的染色质可及性在单细胞水平上被绘制出来,并确定了相关的转录因子结合位点。
- 将全基因组关联研究鉴定到的心血管易感基因映射到细胞亚群,确定了潜在的细胞特异性靶点。
 英文题目:Microanatomy of the Human Atherosclerotic Plaque by Single-Cell Transcriptomics
英文题目:Microanatomy of the Human Atherosclerotic Plaque by Single-Cell Transcriptomics结果
为了研究人类动脉粥样硬化斑块的转录组学,对18例患者(男性77%)的颈动脉内膜切除组织进行了酶消化,通过荧光激活细胞分选(FACS;图1A)分离出活的有核细胞,并制备了scRNA-seq文库。在根据报告基因的数量过滤细胞后,我们对3282个细胞进行了无偏聚类,确定了14个细胞群体(图1B和1C)。我们的scRNA-seq数据与大量RNA-seq数据的相关性,以及患者间群集分布的变异,证实了数据的一致性,但患者1除外。
我们观察到3个非免疫细胞簇(簇8,9和10;表达CD34和ACTA2[肌动蛋白α2,平滑肌])和11个白细胞簇(图1B和1D)。后者包括5个淋巴细胞簇(第0、1、3、4、11簇;表达CD3E、CD4、CD8、CD79A),5个髓系簇(第5、6、7、12和13簇;表达CD14、CD68、KIT),和1个没有明确的细胞类型表达谱的混合细胞的簇(第2簇),但与其他簇有相似的基因表达,似乎主要含有凋亡的髓系细胞和T细胞(图1B和1D)。T细胞是我们数据集中丰富的群体,占所有分析细胞的52.4%,而髓系群体占所有细胞的18.5%。
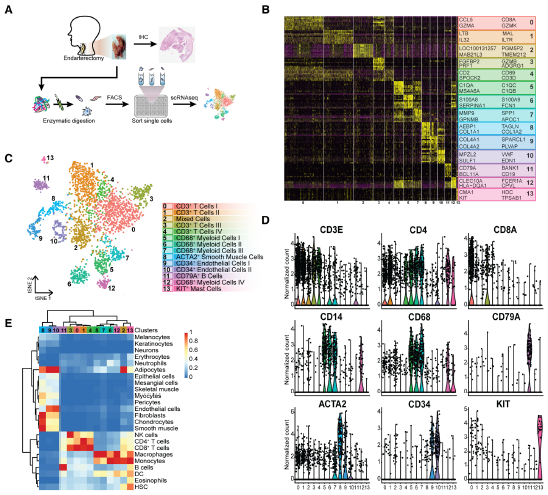
图1
对ECs群集进行分离和重新聚类后,发现了4个不同的子类(E.0-E.3,图2A)。我们通过标记基因将EC表型分为不同的亚类(图2B)。在E0小鼠中,ACKR1有明显的表达,ACKR1与静脉内皮细胞和血管相关,PRCP参与了血管生成和受损内皮细胞的再生(图2B和2C)。E.1表达细胞外基质基因,E.2表达细胞迁移标记FGF18和HEG1,这两个群体都表达VCAM1,它在激活的内皮细胞表达,促进白细胞(如单核细胞和T细胞)的黏附和迁移(图2C)。这表明E.0、E.1和E.2代表着激活的内皮细胞,它通过细胞黏附和新生血管以及介导白细胞外渗,积极活跃地加重晚期病变的炎症。值得注意的是,E.3亚群表达典型的SMC标记物,如ACTA2、NOTCH3和MYH11 (图2C)。
EC簇之间的聚集以及SMC相关通路的富集(图2D),表明这个亚群可能正在经历内皮细胞向间充质细胞的转变,或者反之亦然。为了验证这些发现,我们观察了ACTA2和CD34在连续的组织学切片上的表达(图2E)。
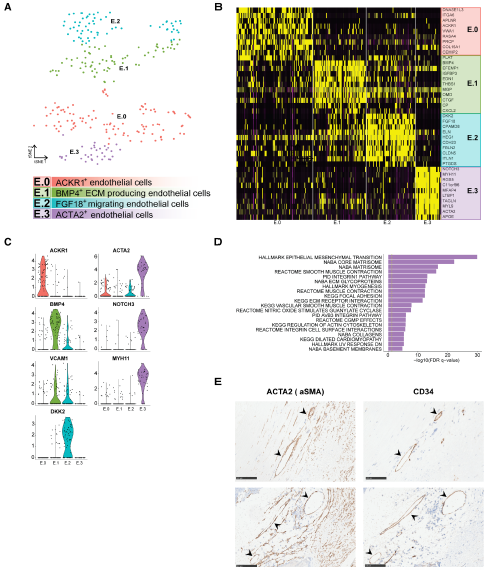
图2
第8簇代表SMCs,分为2个亚类:一簇具有收缩特性的SMC(簇S.1;表达MYH11、ACTA2和TAGLN)和一簇合成型的SMCs(簇S.0;表达COL1A1、MGP和COL3A1。S0簇中典型的SMC标志物的低表达和细胞外基质基因的上调表明,这些细胞一部分来自斑块已建立的帽状部分。这一簇中的有限数量的细胞是KLF4+,这表明血管平滑肌细胞分化为合成的或巨噬细胞样表型。
为了更详细地定义T细胞,我们分离和重新聚类CD4+T细胞,发现了5个亚类(CD4.0-CD4.4,图3A),其中主要的区别是它们的激活状态,而不是通常用于定义CD4+T辅助亚群的转录因子和细胞因子(图3B和3C)。CD4.0和CD4.1具有细胞毒基因表达谱,此外,这一簇中的基因表达证实了与适应性免疫反应相关的促炎通路的富集(图3D)。
根据经典标记物FOXP3(转录因子P3)、IL2RA(CD25)和CTLA4的表达(图3B),最终的CD4+亚类(CD4.3)被鉴定为调节性T细胞簇。对CD8+T细胞的分析揭示了3个亚类,它们与由激活状态不同定义的CD4+T细胞相似。这表明最近T细胞受体(TCR)被激活,表明CD8+T细胞亚群对斑块特异性抗原有反应,可能与动脉粥样硬化的发病机制更相关。
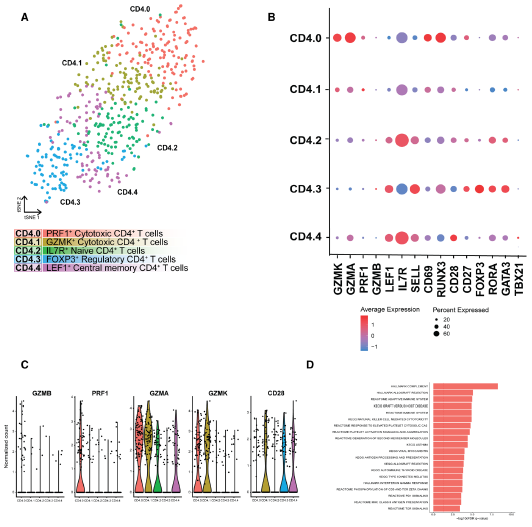
图3
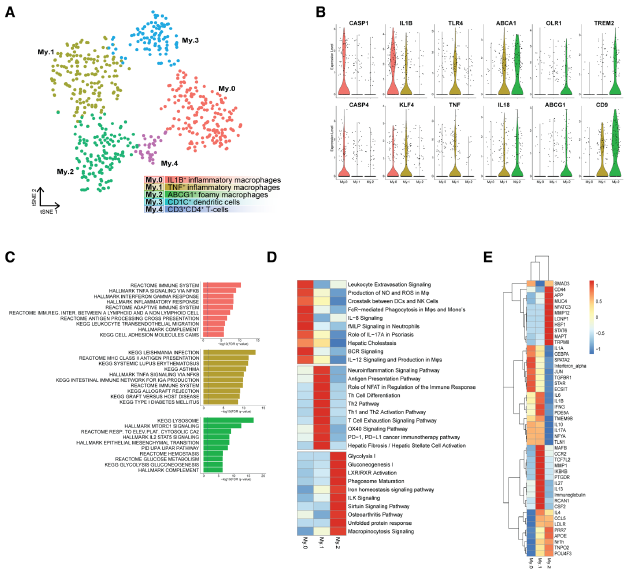
我们分离和重新聚类动脉粥样硬化性髓系细胞,揭示了5种不同的表型(My.0-My.4,图4A)。My.0、My.1和My.2很可能代表不同激活状态的巨噬细胞。促炎标志物基因(图4B)以及免疫和炎症通路的富集结果(图4C)表明,My.0和My.1亚类由促炎巨噬细胞组成。My.0显示了最近招募的巨噬细胞的特征(图4C,D),表明共表达的炎症体被激活(图4B)。与My.0和My.1相比,My.2缺乏明显的促炎标志物,并显示巨噬细胞和泡沫细胞的迹象。
为了进一步确定这3个亚类的特征,我们接下来通过独创性的通路分析(图4E)研究了每个群体差异富集的通路(图4D),以及可能管理这些群体的上游调节因子。My.0和My.1显示典型炎症和免疫通路的富集,清楚地表明细胞激活、募集和免疫细胞相互作用驱动了它们的表型。同时预测My.0和My.1主要受促炎因子控制,如IL1A、干扰素(干扰素)A、IFNG和IL1B。
总之,这证实了我们分别为My.0和My.1定义的最近迁移和嵌入的炎症表型,并与我们在My.2中看到的泡沫表型相匹配。它还展示了人类患者和小鼠模型在细胞类型多样性方面的良好一致性。
图4
接下来,我们基于CellPhone DB v2.0检查了不同细胞类型之间潜在的配体-受体相互作用,以预测病变内的细胞间通讯。淋巴细胞和肥大细胞的潜在相互作用的绝对数低,而髓系细胞、内皮细胞和平滑肌细胞的相互作用的绝对数高(图5A)。
随后,我们按髓系配体(图5B)和受体(图5C)明确地检查了髓系群体中独特的相互作用。发现了多种趋化作用,包括内皮ACKR1与髓系来源的CCL2、CXCL8、CCL8和CXCL1的相互作用,其中最后两个配体在My.1中特异性表达。我们还观察到在所有髓系亚群中的CSF1R,与在内皮细胞、平滑肌细胞、肥大细胞和髓系细胞中的CSF1有相互作用。
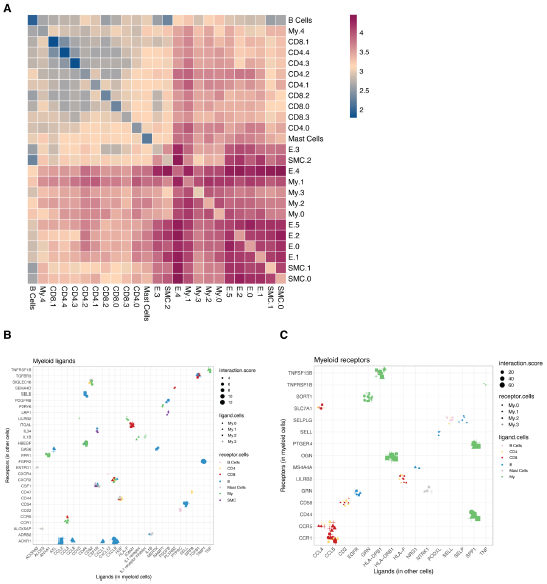
图5
利用scATAC-seq,我们检测了人类斑块中髓系和T细胞的开放染色质启动子和增强子图谱。我们用scATACseq鉴定了4个髓系细胞簇和5个T细胞簇 (图6A和6B)。巨噬细胞(CSF1R,IL1B)和T细胞特异性基因(NKG7)的开放染色质,以及巨噬细胞和T细胞(SPI155和ETS156)的细胞型TFs的motif的富集,明确了细胞类型之间的划分界限(图6C和6D)。转移的髓系群体被重新聚类,类似于scRNA-seq簇(图6E)。
IRF4已被证明是CD1c+树突状细胞特异性转录调节因子,其motif确实在My.3中富集(图6F)。与scRNA-seq数据一致,My.1显示了促炎因子motif的富集(图6F),这与在这些细胞中看到的促炎基因表达相匹配。在scATAC-seq数据中,My.0细胞特异性地富含NFATC3 的motif(图6F),这是一种先前被认为与激活的TLR通路信号有关的TF。My.2细胞富含抗炎的泡沫细胞相关的TFs,这和scRNA数据中是相似的。
我们观察到含有KLF4的motif位点的染色质可及性增加,被证明实现了抗炎巨噬细胞激活状态,并参与血管平滑肌细胞向巨噬细胞的转化(图6F)。
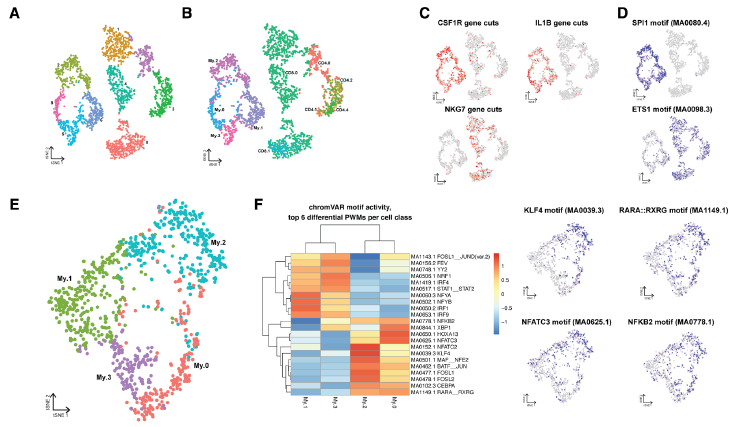
图6
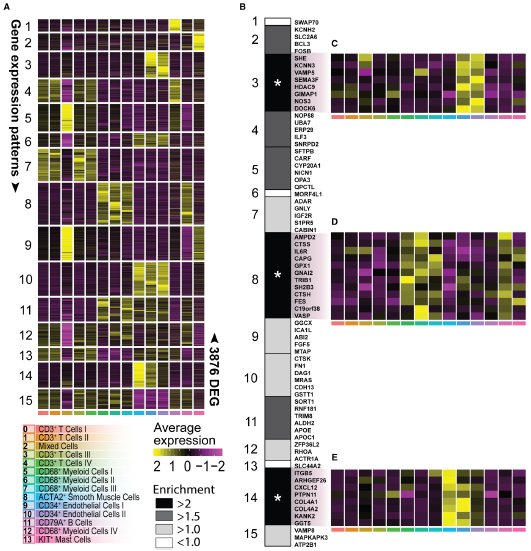
我们将317个CAD相关的基因与3876个差异表达基因进行了交集,共有74个基因。同时观察到GWA的连锁基因在3、8和14模式中显著积累(图7B)。模式3中的基因与EC簇9和10中的高表达相关(图7C),模式8的特点是有与4个巨噬细胞群相关的基因表达(图7A),包含AMPD2、CTSS、IL6R、CAPG、GPX1、GNAI2、TRIB1、SH2B3、FES、C19orf38和Vasp(图7B和7D)。模式14中基因的高表达主要与平滑肌细胞群8和CD34+EC第10簇群体相关(图7E)。我们的结果表明,巨噬细胞、平滑肌细胞和内皮细胞是功能测试的出发点。







 京公网安备 11011302003368号
京公网安备 11011302003368号