
研究背景
摘要
研究结果
1. 单细胞RNAseq分析揭示了癌症相关成纤维细胞不同亚群的存在
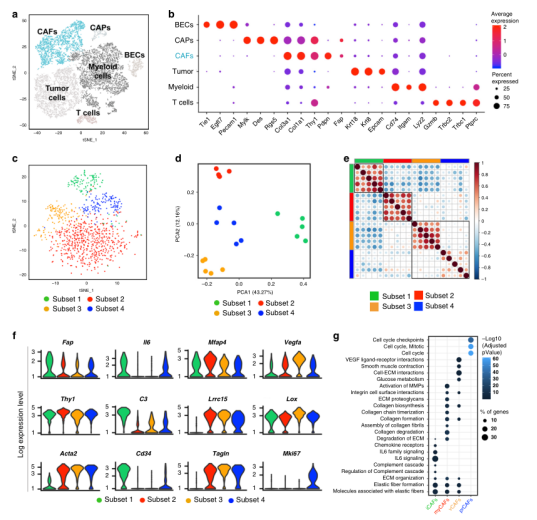
Fig.1 CAFs表型和功能的异质性
为了更深入地了解CAFs在肿瘤微环境中的异质性,作者对4T1小鼠乳腺癌基质富集的样品(一种具有高基质发生反应和免疫排斥的肿瘤模型)进行了单细胞转录组分析。通过数据分析发现了间质细胞缺乏内皮(Pecam1,编码CD31)和造血(Ptprc,编码CD45)细胞标记物,以及间质基因如Thy1和Fap的表达。为了进一步表征肿瘤成纤维细胞的转录多样性,随后通过t-SNE等方法预测了CAFs的构成,揭示了四个离散的亚簇的共存及每个CAF亚群的独特特征(图1)且存在功能差异性。同样,最近在人类胰腺癌和乳腺癌的成纤维细胞中也发现了类似的现象,这表明不同的小鼠和人类肿瘤类型存在相似性。
为区分每个CAF群体的基因及其作用,我们进行了差异基因表达分析。通过对四个不同亚群的基因进行分析,在每种类型的CAFs中鉴定出36-143个基因特异性上调 (图1g)。亚群1在炎症和免疫相关通路中显著富集,表明这一簇可能通过调节肿瘤微环境中免疫细胞的活性从而具有重要的免疫调节能力。亚群2中描绘了与ECM沉积和相互作用相关的通路特征(图1g),表明这些细胞可能在肿瘤框架的基质组成中发挥重要作用。亚群3被发现富集与代谢调节相关的通路,以糖酵解和碳代谢特征(图1g)。最后,亚群4被细胞周期相关的特征所支配(图1g),并表达许多与细胞周期进展相关的基因。总之,这些数据强调了CAFs之间的异质性,表明特定的成纤维细胞亚群通过非冗余功能影响肿瘤生长。根据观察到的表型和功能亚群特异性特征,这四个描述的亚群随后被称为炎性CAFs (iCAFs,亚群1)、典型肌成纤维细胞(myCAFs,亚群2)、VEGF + CAFs (vCAFs,亚群3)和增殖型CAFs (prCAFs,亚群4)。
3. TGFβ-阻断剂扰乱肿瘤微环境中的成纤维细胞活性
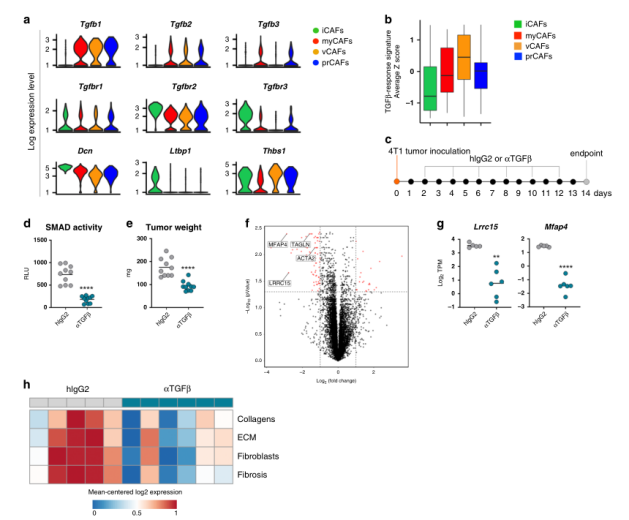
Fig.2 TGFβ中和作用调节TME中的CAF功能
在肿瘤微环境中,因CAF群体在表型和功能上具有不同但彼此之间共存,所以提出了亚群特异性特征可能来源于对微环境的替代反应的一种可能性。与这一假设相一致的是,最近来自胰腺癌的数据强调了不同的生长因子可能导致肿瘤中CAFs的多样化。其中,TGFβ被认为在形成CAF的过程中发挥关键作用,特别是考虑到它与肌成纤维细胞分化的联系和在肿瘤及其他纤维化疾病,以及抗肿瘤免疫中的功能。对TGFβ配体、受体和信号转导因子的分析显示,不同CAF亚型的表达模式不同(图2a),这进一步证实了TGFβ对不同CAF群体的影响可能不同。特别是,编码TGFβ蛋白的基因主要由Acta2 +亚群表达(myCAFs、vCAFs和prCAFs),表明这些CAF群体可能构成TME中TGFβ的主要成纤维细胞来源。通过对每个CAF亚组中建立的TGFβ应答信号进行分析,证实iCAFs中TGFβ诱导的信号水平较低(图2b)。
综上所述,这些数据促使我们研究TGFβ-阻断剂在体内对CAF表型和功能的相对影响。为此,6周龄雌性小鼠接种4T1肿瘤细胞,随后用TGFβ阻断抗体或同型对照处理,研究设计如图2c所示。结果表明这种肿瘤进展的延迟似乎不是由抗TGFβ对肿瘤细胞的直接作用引起的,更可能是TGFβ阻断后微环境变化的结果。事实上,使用TGFβ中和抗体可导致整体基因表达的显著差异,这在对大量冷冻肿瘤RNAseq分析中得到证实(图2f)。与这些发现一致的是,我们通过分析与胶原沉积和纤维化相关的基因特征,描述了抗tgfβ治疗小鼠肿瘤中整体促纤维化程序的显著减少(图2h)。综上所述,这些数据表明靶向TGFβ影响了肿瘤微环境中的成纤维细胞动力学。
4. TGFβ-阻断剂改变肿瘤胶原沉积和网状纤维的形成
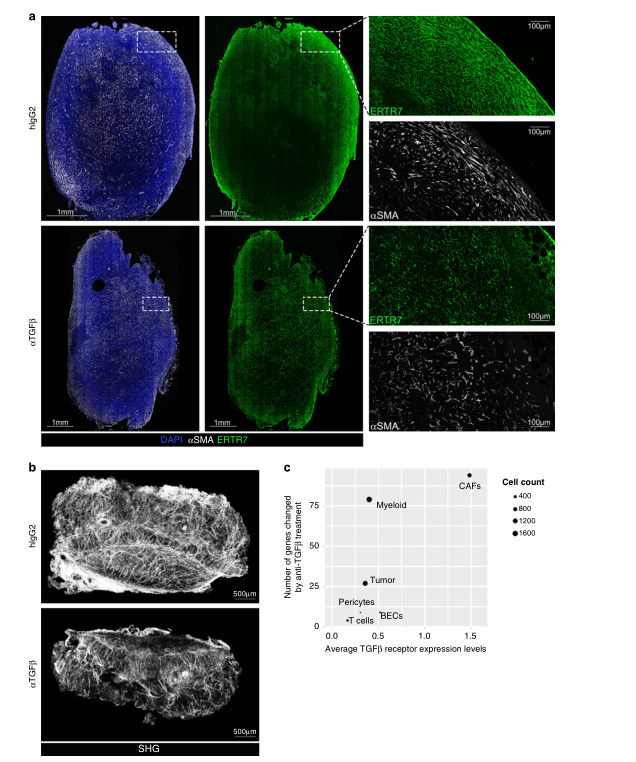
Fig.3 TGFβ-中和作用影响肿瘤ECM结构
根据观察到的基因表达变化,作者利用冷冻保存的肿瘤从同型或抗tgfβ处理小鼠切片,染色和共聚焦显微镜成像等方法确定了TGFβ-阻断是否对构成肿瘤建筑框架结构产生损伤。Acta2表达的镜像变化,肌成纤维细胞网络的显著改变,细长的纺锤形细胞稀少等揭示了瘤内结构组织的显著变化,表明TGFβ阻断抗体处理小鼠的高网状纤维网络丢失(图3a)。通过对全器官的断层扫描,进一步证实了胶原骨架形成的整体损伤,如图3b所示。单细胞RNAseq分析结果表明基因的数量受anti-TGFβ治疗明显更大 (图3 c),也与先前的结果一致。
5. TGFβ-阻断导致myCAFs的丢失和CD73 +成纤维细胞的出现
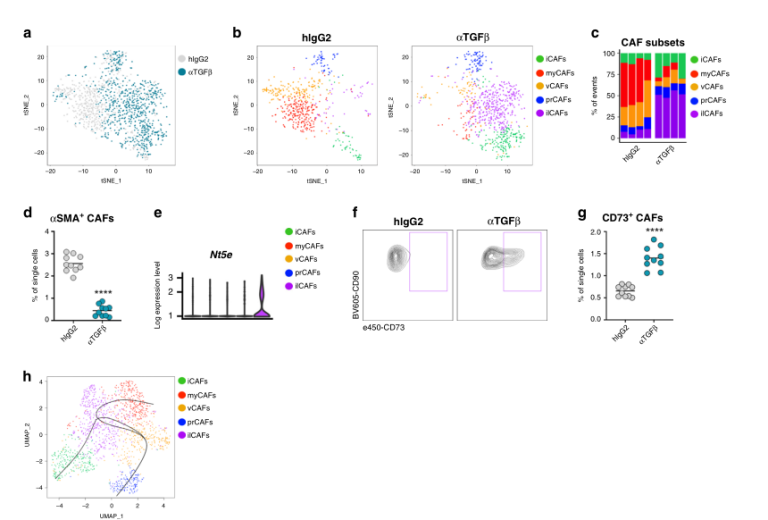
Fig.4 TGFβ阻断剂可以消除肌成纤维细胞并诱导CD73 + CAFs的扩张
考虑到TGFβ阻断是导致成纤维细胞活性和肿瘤基质结构变化的主要结果,作者随后通过测定TGFβ中和作用在CAF各亚群中诱导的相对转录变化确定了TGFβ是否对离散CAF亚群产生不同的影响。正如预期的那样,TGFβ中和诱导了CAF基因整体表达程序的显著变化,这可以从接受TGFβ中和抗体的小鼠t-SNE空间的CAF总体群体的视觉转移中看出(图4a)。通过对这些CAFs进行亚聚,可以观察到myCAFs和vCAFs明显减少(图4b, c),这表明这些亚群可能对肿瘤微环境中的TGFβ特别敏感。流式细胞分析α- sma表达的CAFs频率也显示肌成纤维细胞数量显著减少(图4d),提示TGFβ-阻断剂可能优先靶向肿瘤相关的肌成纤维细胞。
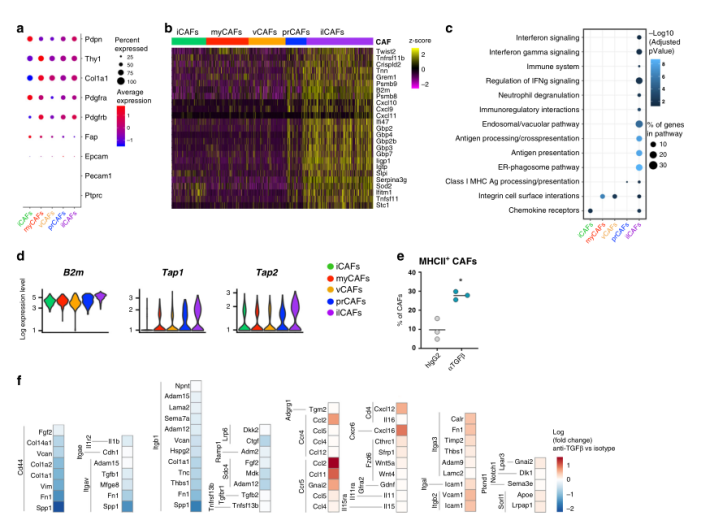
Fig.5 ilCAFs表现出免疫调节的转录组特征
值得注意的是,在TGFβ-阻断下肌成纤维细胞的丢失与一种独特的CAFs(后来被称为干扰素许可的CAFs, ilCAFs,图4b, c为紫色)的出现形成对比,揭示了肿瘤微环境更广泛的可塑性。ilCAFs很容易从其他CAF亚群中区分出来,因为与外切核苷酶Nt5e的基因及编码的蛋白CD73上调相关(图4f)。
目前尚不清楚,ilCAFs是来自现有的肌成纤维细胞的编程,还是在TGFβ信号缺失的情况下来自间叶细胞祖细胞的另一种轨迹。虽然转录动力学的伪时间分析预测了CAF亚群之间不同的分化轨迹(图4h),但ilCAFs和myCAFs仍然可能代表同一现存CAF群体的两种功能状态。需要进一步的研究来验证这一假设,并牢固地建立每个CAF集群的谱系关系。
6. TGFβ-阻断剂生成的成纤维细胞是ilCAFs
为了获得关于新鉴定的CAF亚群功能特性的更多信息,作者研究了这类亚群的转录特征。然而,对ilCAFs中差异表达基因分析发现,在干扰素(IFN)信号控制下许多鸟苷晚结合蛋白(Gbp)家族成员发生富集(图5b)。与这些发现一致的是,在区分ilCAFs与其他CAF亚群的基因中, ilCAFs中IFN信号反应上调,IFN水平调控的通路增强,包括抗原加工和展示(图5c)。编码MHC蛋白和MHC相关分子的基因在ilCAFs中高表达(图5b-d)。体内TGFβ-阻断后,在CAFs中检测到MHCII蛋白上调(图5e),也发现ilCAFs在肿瘤内对指导T细胞的转运发挥重要作用(图5b)。
为了确定区域祖细胞和分泌物的差异是否会影响基质微环境,我们分析了原位4T1肿瘤对TGFβ中和的反应。与4T1 s.c.类似,TGFβ-阻断剂轻度延迟了原位4T1肿瘤进展。在原位肿瘤中也发现了4T1 s.c.肿瘤中描述的相同细胞群,并增加了一群以Krt18和Slpi等基因表达为特征的乳腺细胞。在蛋白质水平上,也与s.c.模型数据有明显相似之处。在抗TGFβ治疗的原位肿瘤中,CAFs中α- SMA染色明显缺失,CD73同时上调。
为了进一步验证TGFβ-阻断剂对人CAF动力学的影响,我们利用单细胞RNAseq测试了人类结直肠癌(MSS-CRC)样本上的TGFβ-中和抗体。对CAFs中调控差异最大的基因分析揭示了与4T1肿瘤中产生的观察结果的相似性。特别是,治疗24小时后,已经检测到与成纤维细胞活性和ECM相关的基因下调,指出人类CAFs中肌成纤维细胞特征的减少。
总之,这些数据表明,TGFβ-阻断可导致小鼠和人类肿瘤成纤维细胞的重塑,暴露了一种独特的CAF群体的诱导,其特征是对IFN的明显反应和相当大的免疫调节潜能。
7. TGFβ-阻断剂增强T细胞的浸润和激活
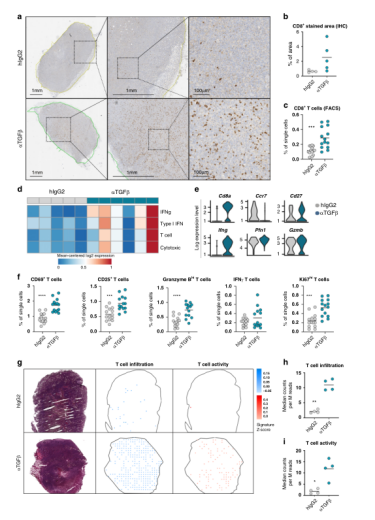
Fig.6 TGFβ-阻断剂促进T细胞浸润和激活
TGFβ-中和后CAF重塑,特别是具有潜在T细胞调节活性的CAF亚群的出现,促使我们确定TGFβ-阻断对建立抗肿瘤免疫反应的影响。由于ilCAFs中T细胞趋化分子基因表达升高,CD8免疫组化染色显示细胞毒性T细胞浸润在治疗组之间存在较大差异(图6a)。流式细胞分析证实了TGFβ-阻断作用下细胞毒性T细胞数量的增加(图6c),支持TGFβ-阻碍可能导致免疫细胞反应的全面觉醒。在单细胞水平上也证实了这些发现。为了评估这种与浸润T细胞组织分布相关的激活程度,我们随后通过空间转录组分析生成了与T淋巴细胞存在及其活性相关基因的肿瘤路图。
8. TGFβ中和增强体内PD1免疫治疗的疗效








 京公网安备 11011302003368号
京公网安备 11011302003368号