
摘要
- 对pB-ALL的遗传易感性形成了一个不同的肠道微生物群。
- 在缺乏感染性刺激的情况下,抗生素治疗导致微生物群缺失可在易患遗传携带者中引发白血病。
材料方法
文章结论
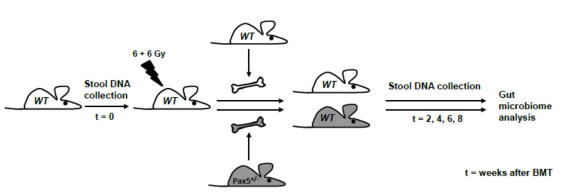
为了研究肠道微生物群在Pax5+/-小鼠PB-ALL发育中的作用,我们建立了一个由24只对照仔鼠野生型(WT)和24只Pax5+/-雌性小鼠组成的小鼠队列。每笼饲养6只小鼠,分别饲养在混合基因型笼子(每个基因型3只,笼子1-4)或相同基因型笼子(同一基因型6只小鼠,笼子5-8)中(图1A)。
为了分析肠道菌群,我们收集了移植到CF后1个月和10个月的所有小鼠的粪便颗粒。提取了DNA后,并对16S rRNA基因的V4区进行了扩增测序。对16S rRNA测序数据的分析不仅显示了小鼠的聚集性(蓝色的CF与红色的SPF),而且CF的微生物组成随着时间的推移发生了巨大的变化,但SPF没有变化(图1B)。在两种基因型(图1C和D)的β多样性结果中,根据动物设施的类型,表现出强烈的、统计上显著的差异(p=<0.005,PERMANOVA)。在接下来的9个月里,CF和SPF之间的差异变得更加显著(图1E和F)。在转移到CF时,小鼠出生6周(从断奶到成年),小鼠肠道微生物群应该是完全发育的,但仍然容易受到环境诱因引起的组成变化的影响。
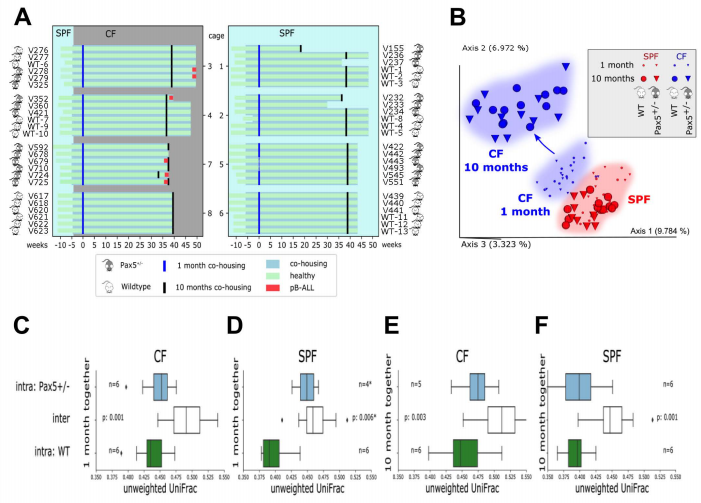
图1-1
我们通过独立地将机器学习方法应用于3983个ASV,进一步将基因型分离ASV的集合细化到只有40个。ASV根据特征重要性进行排序,由“随机森林”算法确定,41个ASV用50%的样本进行训练,并在剩余50%的样本上进行测试。这40个ASV足以准确(96.8%)预测小鼠基因型(图1G)。事实上,这种机器学习工具能够预测小鼠的基因型,这证实了Pax5杂合性形成了特定的肠道微生物群落。值得注意的是,16S rRNA全长测序使我们仅使用5212个全长ASV中的4个,就进一步提高了Pax5+/-和WT动物之间的基因型预测的准确性,准确率达到100%(图1H)。WT和Pax5+/-小鼠微生物群的主要区别在于Pax5+/-小鼠缺乏完整的共生菌。具体地说,在WT小鼠中可以检测到的Rikenellaceae、S24-7和Oscillospira属的成员在CF的Pax5+/-小鼠的微生物群落中缺失(图1I)。在SPF中,在Pax5+/-小鼠的微生物群落中没有检测到Rikenellaceae和Oscillospira属的成员(图1J)。
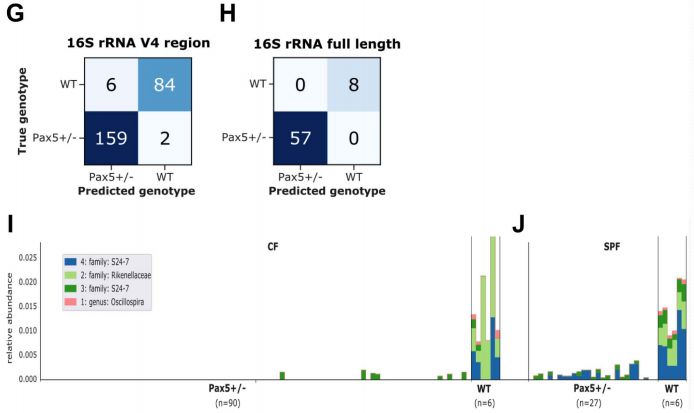
图1-2
Sca1-ETV6-RUNX1小鼠在SPF组10个月时和CF组3~4个月时进行微生物群分析。将这些数据与我们之前的分析相结合,证实了环境(设备)和基因型是形成肠道微生物群的关键因素(图2A,B)。SourceTracker2分析表明,Pax5+/-微生物来源在Sca1-ETV6-RUNX1微生物群的组成中也很突出(图2C),PERMANOVA分析结果证实,所分析的基因型形成的微生物群有统计学上的显著差异(图2D)。使用10个最重要的ASV(有1000棵树的随机森林),可以通过机器学习准确地预测易感基因型(图2E)。这些分析证实,在遗传上易患PB-ALL的基因型都有不同的微生物群,独立于外围的B细胞有缺陷。
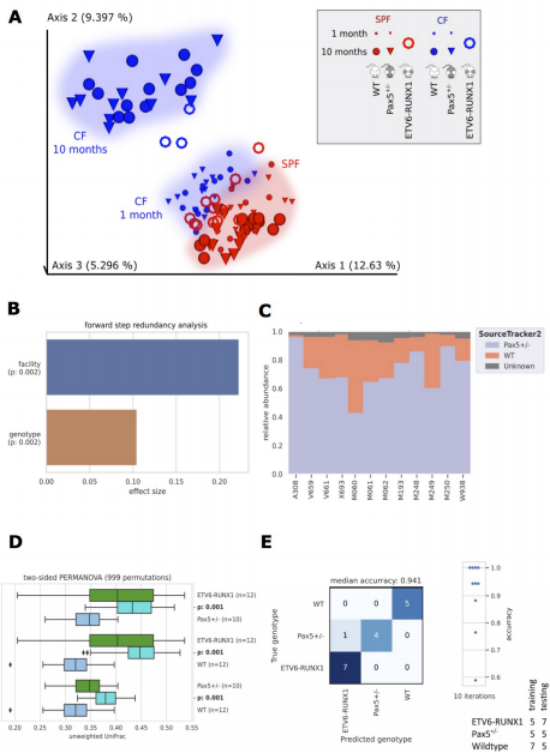
图2
我们设立了第二个小鼠队列,命名为“ABX”,并用抗生素治疗这些小鼠以清除细菌。这个队列由27只Pax5+/-和18只WT小鼠组成,我们在转移时(在服用抗生素之前)、抗生素治疗后4周和8周收集粪便颗粒,然后每两周收集一次,直到一只小鼠出现明显的PB-ALL症状或达到其自然寿命的终点。通过微生物分析、粪便DNA浓度分析和16S rRNA扩增序列测定(图S7),证实了抗生素鸡尾酒的杀菌效果。在抗生素治疗期间从小鼠身上收集的粪便样本主要包含来自它们植物性饮食的Read(平均82%的Read可以归类为叶绿体或线粒体来源)。当我们分析抗生素治疗对不同器官造血室的影响时,我们观察到抗生素治疗并不改变WT或Pax5+/-小鼠的B细胞发育。然而,在抗生素治疗后,我们观察到Pax5+/-小鼠外周血中成熟B细胞的减少,但未观察到WT小鼠中成熟B细胞的减少。
图S7
我们观察到,在抗生素治疗后通过细菌耗尽来改变微生物群并没有改变Peyer氏斑中B细胞的数量,但与未治疗的Pax5+/-小鼠相比,接受抗生素治疗的Pax5+/-小鼠的CD3+-T细胞数量显著减少(图S25)。CD3+-T细胞的减少与抗癌免疫力的降低有关。因此,我们想知道T细胞数量的减少是否与接受抗生素治疗的Pax5+/-小鼠的PB-ALL发展有关。我们将Pax5+/-小鼠与缺乏nu/nu小鼠的胸腺缺陷T细胞杂交。33只Pax5+/-;nu/nu小鼠中有5只(15%)观察到PB-ALL发育,而WT;nu/nu对照组小鼠(n=31)均未观察到PB-ALL发育。
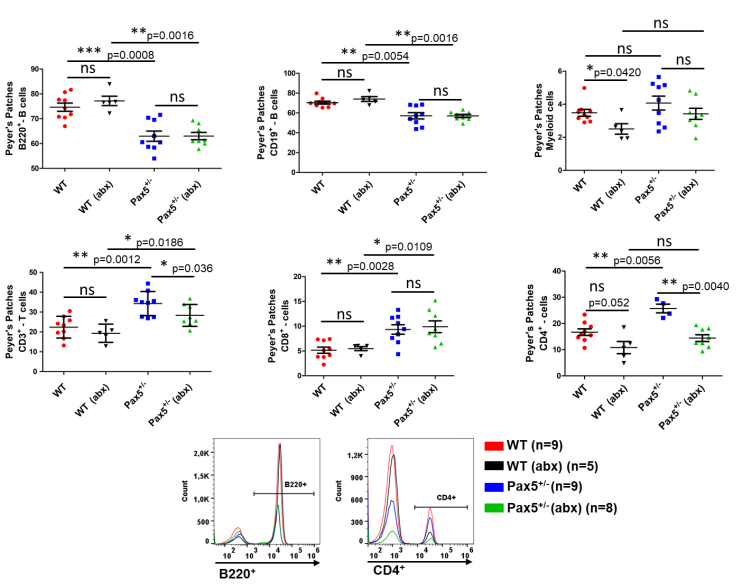
图S25
我们考虑了在SPF条件下肠道生理性微生物群的作用,以及在没有自然感染诱因的情况下,通过细菌枯竭来改变它是否会导致白血病的发生。为了测试这一点,另外一组出生在SPF的23只Pax5+/-小鼠没有被转移到CF,而是在整个实验过程中一直保持在SPF中。这些小鼠接受抗生素治疗。
在23只小鼠中,11只(47.82%)在11.4到20.7月龄之间出现了PB-ALL,而SPF中未经治疗的Pax5+/-小鼠(n=12)没有发生白血病(图4A-D)。这些白血病在表型、组织学、克隆性和遗传学特征上与暴露于自然感染的Pax5+/-小鼠中出现的白血病相似。这表明,完整的微生物群可以保护遗传易感的小鼠免受白血病的侵袭,即使在没有感染环境的情况下,通过抗生素治疗后的细菌枯竭来改变微生物群也可能引发白血病。
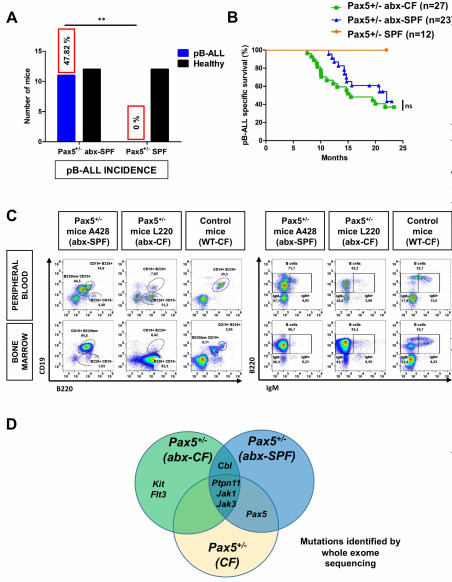
图4
我们首先证实,抗生素治疗后的微生物群落以一种依赖于基因型的方式再生,并且能够随着时间的推移而重建(图5A)。接下来,我们将Pax5+/-发展为PB-ALL的小鼠的肠道微生物群与在整个实验过程中保持健康的小鼠的肠道微生物群进行了比较。通过对所有时间点应用离散FDR,我们确定了3983个已鉴定的V4-ASV中的42个在白血病前期Pax5+/-小鼠(n=144,粪便样本)和健康Pax5+/-小鼠(n=164,粪便样本)之间差异丰富(图5B,C)。这些发现将遗传易感性和耗尽的微生物群与那些将患上感染驱动的PB-ALL的Pax5+/-小鼠联系在一起。综上所述,这些发现表明肠道微生物群有可能被用作早期生物标记物来识别易患白血病的遗传易感小鼠。
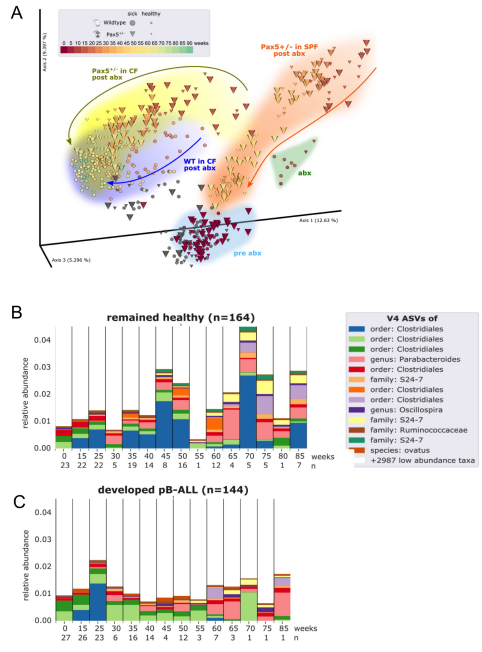
图5
接下来,我们调查了小鼠血清中的代谢体成分是否能帮助我们识别遗传性PB-ALL的易感性。为了验证这一点,我们用GC-MS分析了SPF饲养的WT(n=10)和Pax5+/-(n=10白血病前期,n=10白血病)小鼠的代谢组(图6A)。PCoA表示按基因型和健康状况进行聚类(图6B)。我们发现52种化合物中有6种在WT和白血病前期Pax5+/-小鼠之间差异显著(图6C)。与白血病Pax5+/-小鼠血清样本相比,健康的白血病前期Pax5+/-小鼠血清样本中有16种化合物含量显著不同(图6D显示了前6种化合物)。
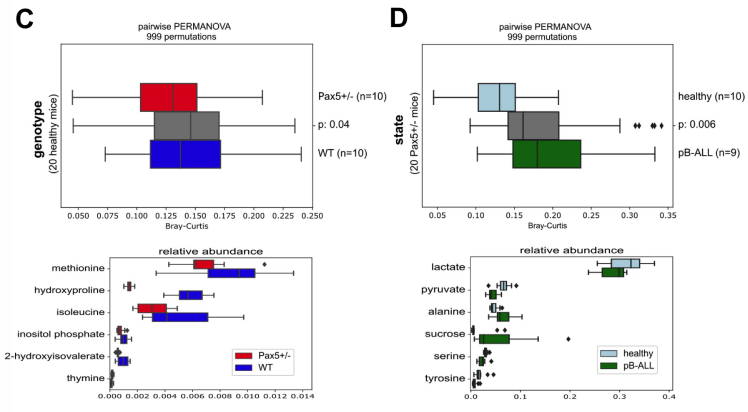
图6
总而言之,健康、白血病前期或白血病代谢组是不同的,并由几个因素定义(图7),而不是单一的特定代谢物或细菌种类。



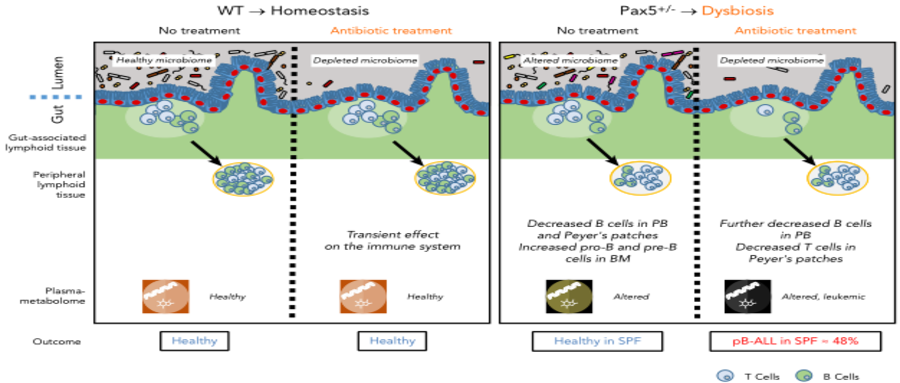
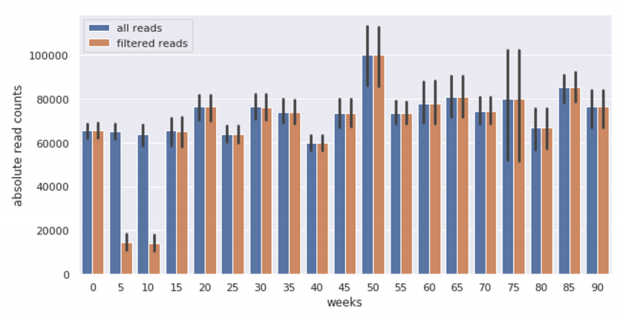
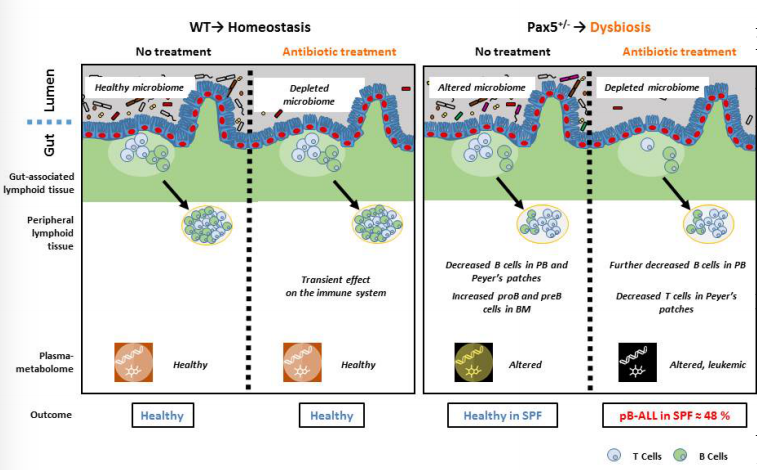 图7
图7



 京公网安备 11011302003368号
京公网安备 11011302003368号