
摘要
前言
研究结果
研究人员从代表了不同的发育时间和组织位置的17个单独的胚胎中收集了77个肠道样本绘制成单细胞图谱 (Figures 1 A和1B),数据集范围从8到22 PCW,跨越隐窝形成之前的时间点,直至成人状绒毛/隐窝形态的发展(FiguresS1A)。使用寡核苷酸标记抗体,产生了76,592个细胞 (Figures 1A 和 S1B–S1I; STAR methods)。
聚类分析将这些细胞分为9个肠道小室,以转录特征分别标注-上皮细胞,成纤维细胞,内皮细胞(EC),周细胞,神经(ENS),肌瘤,间皮,肌成纤维细胞和免疫(Figures 1C 和 1D),且具有明显的区位和发育时间差异(Figures 1E 和 1F)。基于关键标记基因进行的精细聚类注释进一步确定了区室中的101个亚群,并利用基于图的划分抽象方法描述了它们之间的关系(Figure 1G; Table S1;STAR methods)。接下来,对转录因子(TF)调控网络进行映射,以突出每种细胞类型的关键调控网络,并重建细胞命运的“决策树”(Figure S2A; STAR methods)。鉴定出了464个TF模块(如上皮细胞发育中的ARID3A(FDR<2.2e-16、coeff= 0.350),成纤维细胞中TCF21 (FDR<2.22e-16, coeff = 0.299),概述了已知的发育调节剂(例如用于肠内分泌细胞[EEC]分化的PAX4)以及306个发育发育阶段和44个不同位置的调控网络(例如,回肠末端的FOXD1 (FDR <2.22e-16,coeff = 0.026)(Figure S2B)。同样,绘制了所有101种细胞类型之间的串扰图,确定了成对细胞群之间的假定受体-配体(RL)相互作用(每个簇对多达179个旁分泌相互作用,包括2,252个RL对)(FigureS2 C; STAR methods)。
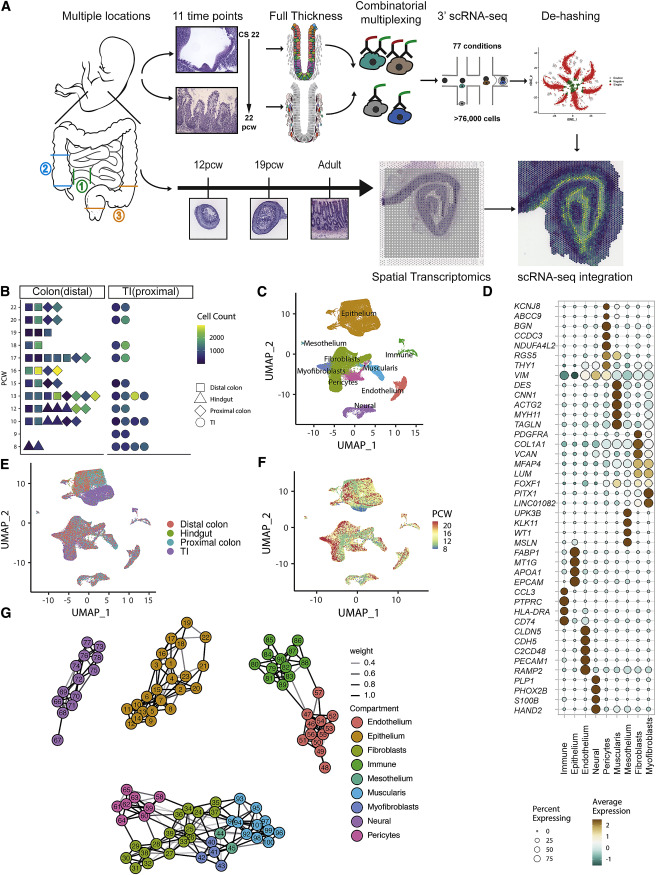

对跨肠发育的组织进行空间转录组分析(5个样品中的8个切片; 12 PCW,n = 5; 19 PCW,n = 1;成人,n = 2)(Figure 1A)。ST斑点的转录特征分析确定了每张幻灯片中的5-13个斑点簇,它们映射到离散位置(Figure2A)。使用单细胞图谱作为参考,利用因子分析来确定每个斑点可能的scRNA-seq组成,从而在空间上定位所有scRNA-seq簇。与此同时,利用成人上皮细胞进行scRNA-seq预测了成人和胎儿的空间细胞类型分布(GEO:GSE116222,GSE125970),基质(GEO: GSE114374) 和免疫(DUOS-000110) 。

来自成年细胞群体(如隐窝顶部结肠细胞和成肌纤维细胞)的转录组学特征也位于适当的解剖位置(Figure2B)。RET显示在肌间神经丛和粘膜下淋巴滤泡的PTPRC(CD45)有斑点特异性表达(Figure 2B)。
成对细胞类型信号相关性分析强调了几种细胞类型(如,BEST4 / OTOP2细胞和结肠细胞)的显著同点共现,与预期的原位细胞定位一致(Figure2Ci)。大多数ST斑点簇是分层分布的,突出了与组织深度相对应的转录/细胞空间变异性的*大决定因素。
研究人员鉴定了2,893个与深度相关的基因(<5%FDR),反映了不同层次的活跃途径(Figure Cii) -肌肉/神经过程(收缩/轴突形成)向吸收管腔功能(微绒毛组织和消化系统过程)发展的深度富集点,与细胞类型特征的顺序富集相符(Figure 2Ciii)。在胎儿ST显著的差异包括外肌层和内肌层在19个PCW时占据离散的空间层,而不是12个PCW时(Figure 2D)。
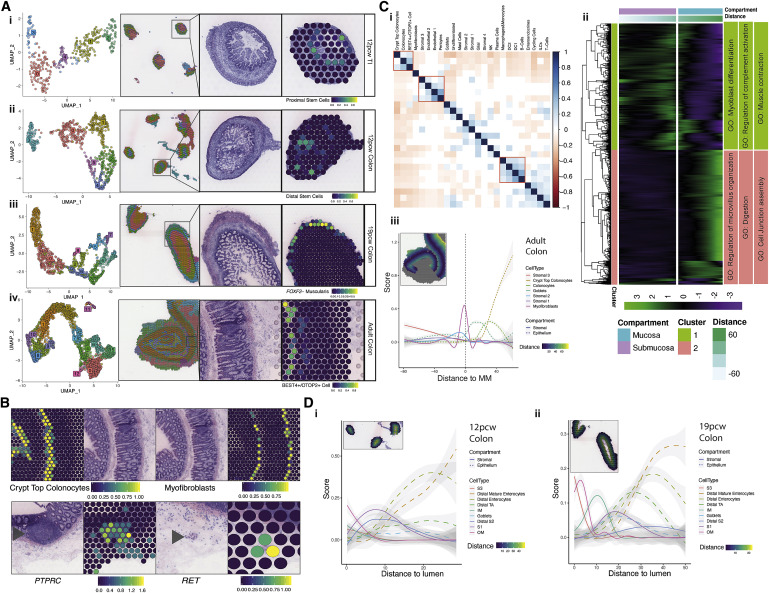
子宫上皮隐窝的形成建立了维持粘膜屏障的终生回路。该研究捕获了17,622个上皮细胞,这些上皮细胞易于区分其吸收性(肠上皮细胞和BEST4/OTOP2细胞),分泌性(EEC,杯状细胞和分泌性祖细胞),未分化(远距离扩增[TA]和近端TA)以及干细胞(近端和远端ISC)基因标签(Figure 3A;Table S1)。吸收性细胞基因的表达反映了类似于成人上皮的成熟光谱。研究人员观察到由高特异性基因表达(例如CCL25和APOE)(Figure3A和3B)划定的近端(小肠[SI])和远端(结肠)样品之间的位置差异很大,通过轨迹分析和几个TF模块进行了证实(FigureS3一种)。这表明,在隐窝形成之前,位置特异性转录程序就已经建立起来了。
研究人员观察到近端和远端ISCs随着时间的推移逐渐增加。这与ISC转录程序的早期位置差异形成对比,例如远端LEFTY1和近端FOXD1及其下游调控网络基因(Figure3C,3D和S3B)。这些差异由关键的位置信号转通路支撑,例如,结肠LEFTY1通过激活素A受体(ACVR2B)参与了假定的神经相互作FigureS3 C1)。在早期发育中(<12 PCW),研究人员发现了近端上皮干样祖细胞群,该细胞群发展为早期肠上皮细胞。这些细胞表现出许多原始功能,包括在中胚层分化重要的VTN基因高表达,与ISCs相比,LGR5表达较少,和ONECUT2表达参与上皮发育(Figure 3B和FigureS3 D)。这些细胞在SI中特异表达TF GATA4(Figure3Ei), SI是一种小鼠早期内胚层调节因子,在12 PCW后,其表达大部分丢失这些细胞高表达转铁蛋白(TF)( Figure3B和3F),证实了铁代谢在绒毛形成中的重要性。LGR5是一种典型的ISC基因,在妊娠早期(<12 PCW)的近端/远端广泛检测到低水平ISCs和干样祖细胞(Figure3B和FigureS3D)。原位杂交(ISH)证实了在10PCW处弥漫的LGR5表达,后来定位于隐窝碱基(Figure3G),类似于在鸡和小鼠发育中报道的Lgr5的行为。即使在隐窝形态建立之后(如19 PCW之后),ISC仍分别构成远端/近端样本中捕获的上皮细胞的18%–22%(Figure3C),高于成人结肠的scRNA-seq研究捕获的3%-4%。与此相符,研究人员发现ASCL2 TF模块(包括下游目标LGR5)随着发育时间的增加而显著增加(Figure3H)。
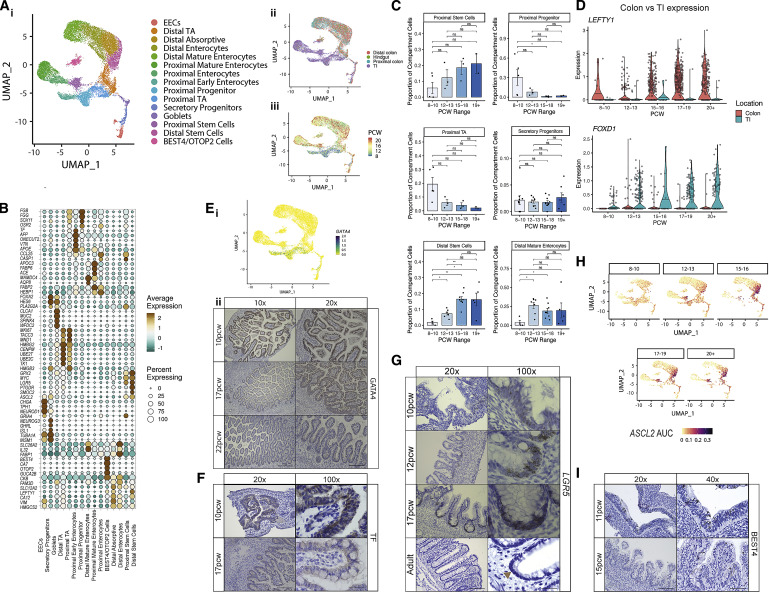

分泌型谱系细胞在12 PCW时出现,在8-10 PCW时检测到很少的杯状细胞。然而,12 PCW后的杯状细胞和EEC逐渐增加,反映出持续的成熟(Figure3A和S3E)。分泌细胞进一步细分为11个簇,反映了不同的EEC亚型(A/M,D和肠嗜铬/I/L/N细胞)以及SI特异性Paneth细胞,杯状细胞和NEUROG3 +祖细胞群(FigureS3 F;TableS1)。与其他EEC亚型不同的是,较早检测到Paneth细胞旁边的I细胞和A细胞(FigureS3F)。RL映射建立了核心EEC信号通路,如肠嗜chromaffin细胞,常见于结肠12pcw,通过多种途径与抑制性运动神经元相互作用,包括TPH1-HTR2B,一种已知的食欲/运动中的5 -羟色胺信号通路(Figure S3Cii)。因此,随着隐窝的形成,EEC多样性和相关网络在很大程度上得以建立。
相比之下,BEST4/OTOP2细胞在隐窝形成之前的时间点出现,转录水平已经不同(Figure 3I),并且随着时间的推移频率没有变化(Figure S3Gi),这表明它们的发育可能与正常的隐窝-绒毛回路无关。此外,RL分析预测BEST4/OTOP2与神经元细胞之间有很强的相互作用(同样在发育早期建立);例如,抑制性运动神经元表达神经递质VIP,通过受体VIPR1的表达介导分泌BEST4 / OTOP2细胞(Figure S3Gii)。
肠道发育需要三种胚层细胞类型之间的√确相互作用。研究人员鉴定了8个部分的78个非上皮细胞簇,根据它们的转录、时间和位置分类(16个成纤维细胞,4个肌成纤维细胞,2个间皮细胞,12个上皮细胞,8个周细胞,13个神经细胞,12个免疫细胞,11个肌肉细胞) (TableS1)。在这些细胞中,观察到协调的分化动态,一些群体首先发生变化,从而可能建立关键的生态位,为其他细胞铺平道路,而在其他细胞群中,共定位群体则同步进化。
转录标签通常对应于结构特征。在EC中可以清楚地看到这一点,将EC分为静脉,动脉和淋巴管类型,并通过血管大小进一步区分(Figure4 A;TableS1)。在发育过程中,观察到了从小血管到大血管的过渡,反映了肠道血管生成(Figure S4 A)。确定了驱动这种变化的TF网络,例如动静脉分化器HEY1和SOX13。成年ST的脉管系统很容易识别成年EC和胎儿EC信号(Figure S4 B)。与EC相对的,周细胞亚型由血管生成驱动因子(PRRX1,THBS4和ANGPT2)定义(Figure 4 B;table S1)。ANGPT2是EC-周细胞RL相互作用的关键调节因子,已证实其位于胎儿脉管系统中(Figure S4C)。尽管EC隔室与8 PCW处存在的大血管细胞截然不同,但周细胞种群显示出发育滞后。为了了解这些分化动力学,研究人员将G2M和S期周细胞与G1期细胞进行了比较,发现在较早时间点的大多数细胞是高度循环的祖细胞(Figure S4 D)。这些种群与成纤维细胞和原始的ACTA2 +细胞共享转录特征,这一结果受到轨迹分析的支持(Figure S4 E)。综上所述,提出了早期成纤维细胞向周细胞的转变,然后是来自未成熟WNT6表达细胞的第二波周细胞增殖-分化。16 PCW时,成熟的成肌纤维细胞表现出相似的发育滞后(Figure 4 Ci;table S1)。文献表明肠道成肌纤维细胞可能来自多种来源,并且图形抽象显示成熟的成肌纤维细胞类似于肌肉细胞,在特定基因(例如RSPO2,Figure 4 Cii)中存在明显差异。然而,肌成纤维细胞祖细胞却表现出来自成纤维细胞和周细胞的梯度谱;在19 PCW的ST中,它们占据了与过渡间质细胞相邻和重叠的层。(Figure 4 D和S4 E)。
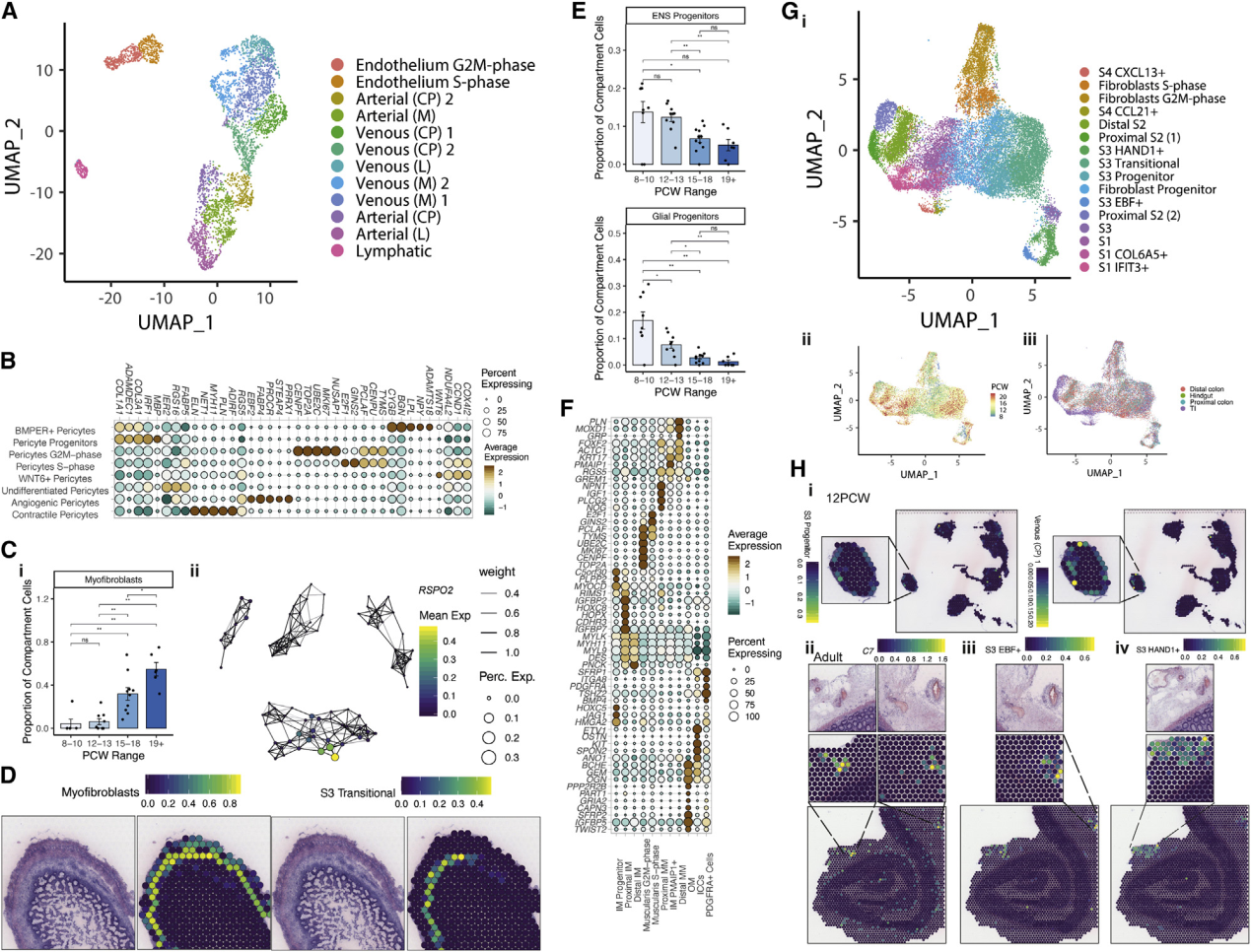

与PCW7-8晚期发展出现的细胞类型相反,肠神经嵴来源的细胞沿胃肠道的长度迁移,进入包含神经元和胶质细胞的粘膜下和肌间神经丛。本研究的时间点(Figure4E)确定了不同的神经元和神经胶质祖细胞,并捕获了5个神经胶质细胞和7个神经元簇(FigureS5 Ai;tableS1)。除了RL分析突出的不同ENS通路(图S3C),同时还表明ENS与其他部分相比相对成熟。在ST中,ENS成分也被清楚地看作是肌间神经(FigureS5 Aii)。
在成年肠道中,神经元丛被肌肉包围。祖细胞和分化的肠平滑肌细胞(iSMCs)分别由PLPP2和ACTA2等基因标记(Figure4 F;TableS1)。本研究确定了11个与iSMC相关的簇,包括PDGFRA +间隙细胞和Cajal间隙细胞的早期种群(FigureS5 B)。通过10 PCW观察到内(IM)和外(OM)肌肉的形成。这些层在胎儿肠中的发育顺序尚不清楚,有相互矛盾的报道表明两者同时发育或IM首先发育。与前者一致,观察到分化浪潮,结肠肌层滞后于较成熟的近端组织,早期样品以祖细胞为主,而分化的远端肌层粘膜(MM),OM和IM细胞在12岁后大量出现PCW(FigureS5 C)。在19 PCW处而非12 PCW处的结肠ST中,肌肉层是分开的并且在视觉上是不同的(FigureS5D)。确定了描绘肌细胞的关键TF网络。KLF7在肌肉中,TWIST2在间质细胞和OM细胞中(FigureS5E)。FOXF2在IM中具有特异性活性(Figure4F),这与前期的小鼠相关报道一致。此外,据报道,Foxf2 -/-小鼠胚胎致死,伴随有薄壁结肠,肠神经元数量减少,扁平的上皮细胞和未发育的成纤维细胞。这一发现与平滑肌介导的机械力是引发绒毛形成的可能性相吻合。
发育中肠道内不同的室间由间充质细胞支撑,间充质细胞是肠内*大的室间(24,081个细胞)。基于成人scRNA-seq中建立的命名法将成纤维细胞命名为stromal-1-4 (S1-S4)亚型。根据时间,位置和周期的差异进一步将它们细分为16个类(Figure 4 G;Table S1;STAR方法)。S1细胞的3个簇形成了黏膜下层结构细胞的主体,而S2细胞(由F3,NPY和FOXL1标记)表达的标志物与隐窝周围的细胞群相似,对上皮的发育和形成至关重要(Figure S6 A)。与成人相比,S3-like细胞不仅在子宫内形成了一个主要的成纤维细胞群,而且表现出更大的异质性。一些S3簇具有高表达的原始标记(HAND1、WNT4和DLK1),以及成人标记S3基因(C7和CCDC80)。轨迹分析确定了一个分支点,未成熟的S3-like细胞分裂为S3或S1/2/4谱系,这些谱系可以被谱系特异性的TF网络(如NR2F1)分化,NR2F1也在肌成纤维细胞中表达。研究人员发现S3-like祖细胞在增殖室中高度富集,表明这些细胞可能在这一时期产生大量分化成纤维细胞。
为了更好地理解S3亚型功能,研究人员研究了RL互作,注意到与EC的大量串扰预测(FigureS6D)。其中许多是通过调节结肠成纤维细胞中组织纤溶酶原激活受体LRP1介导的。为了在ST数据中证实这一点,研究人员进行了RL空间共表达分析,该分析确定了在空间上对隐窝顶部进行强空间共定位的RL对,例如CEACAM1和CEACAM5(FigureS6Ei)。在成人和胎儿组织中观察到LRP1与血管外基质的关键成分HSPG2配体的显著共定位(p = 2.17×10-112和p = 2.37×10-29(成人);p = 2.9×10-19和 p = 0.005(12 PCW) (Figure S6Eii和S6Eiii)。在胎儿ST中,研究人员将S3簇定位于与EC相关的深度和区域(Figure4Hi),将几种S3特异性基因(如FigureC7)的表达定位于成年组织中与脉管结构相邻的斑点,因为这些结构比胎儿切片更清晰可见(Figure4Hii)。将胎儿细胞类型标签转移到成人ST上,发现S3 HAND1 +和S3 EBF +细胞的成年配对体聚集在大血管周围(Figure4Hiii–4Hiv),突显了这些细胞在形成肠血管支持位支持生态位中发挥的作用,已通过成对细胞类型信号相关性分析证实,其中EC,周细胞和“S3”型成纤维细胞信号在同一ST点内相关(Figure 2Ci)。
引导肠道发育形态发生梯度的无偏映射
理解肠道发育的基本问题是局部形态发生梯度及其拮抗剂是如何塑造肠绒毛形态发生的。研究人员创建了一个涉及8条途径的基因形态发生图,用以阐明这些分子在空间和时间上的作用。利用共表达分析确定了11种细胞类型特异性和13种空间共定位的形态发生模块,在所有ST中对模块活性进行了评分(Figure5A和S7 A)。这些模块通常与ST中的组织深度对齐,空间模块3由来自EC、成纤维细胞和周细胞起源的形态发生子组成,包括LRP1,并且在组织深处(Figure5 Bi)。上皮特异性模块表达了Hedgehog通路(IHH)的基因,例如在Wnt信号中起重要作用的卷曲的共受体LRP5,并位于管腔附近(Figure5 Bii)。另一个含有肌纤维母细胞成分的细胞,具有形态发生原WNT2B和受体RSPO2,在12PCW时出现弥漫性,并在以后逐渐定位(FigureS7 B)。这与发现成熟的成肌纤维细胞在上皮成分后出现的发现一致,表明ISC-成纤维细胞信号传导回路直到隐窝形成后才建立。WNT2B由间皮表达,在成肌纤维细胞分化之前提供了配体的唯一来源(FigureS7B)。类似地,RSPO3,其可以用信号通知经由ISC的LGR5(FigureS7Ci)在间皮/肌层模块中很高,主要在12 PCW之前见到,然后随着时间的流逝随着组织深度的增加而消失(Figure5C)。这表明,随着肠的生长,原本可能因层间物理距离的增加而被打破的形态梯度,可以通过依次发育的细胞类型的表达而恢复。
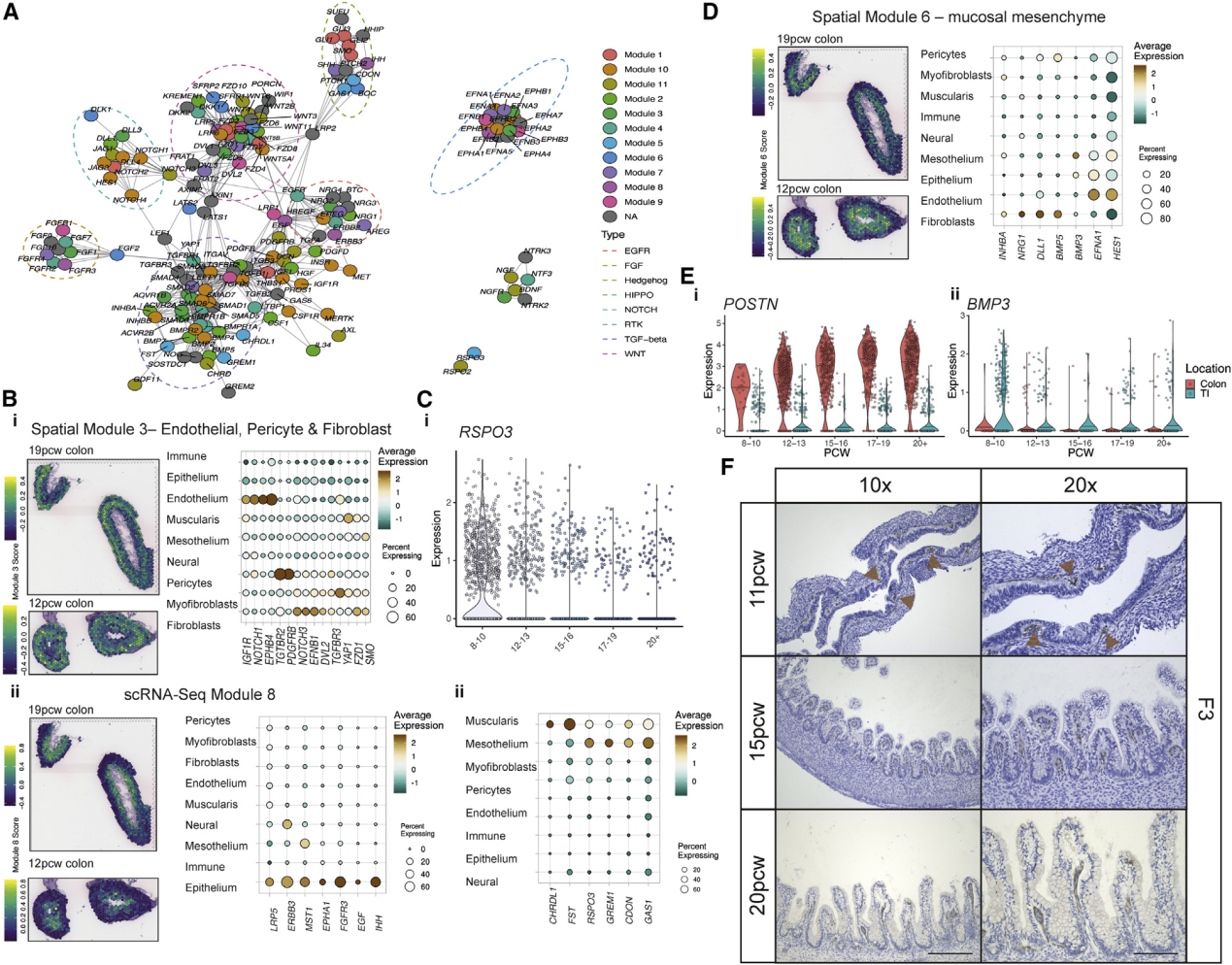

周围隐膜S2成纤维细胞或端粒细胞通过表达生长因子β(TGF-β)超家族配体和WNT通路来提供上皮支持。从TGF-β(BMP2,BMP4和BMP5)和非典型WNT通路(WNT5A和WNT5B)(Figure S6 A)。这些S2特异性基因形成了一个主要的粘膜下成纤维细胞形态发生模块(scRNA-seq模块2),该模块包含DLL1,BMP5和NRG1(Figure 5 D)。连同RL相互作用(例如DLL1 – NOTCH2(Figure S7 Cii))一起,这突出显示了S2细胞及其提供的富含形态原的利基在上皮细胞形成中的重要性。与其他成纤维细胞种群不同,TI和结肠S2细胞不同,有885个差异表达基因(<5%FDR)(FigureS7 D),包括POSTN或TI突出的PDGFRA的结肠特异性表达(Figure S7 D)。在10 PCW之前发现许多位置差异,这表示在隐窝/绒毛形式之前具有很强的位置同一性-例如POSTN和BMP3在它们各自的S2亚型中很早就被发现(Figure 5 E)。S2形态发生谱中的关键位置差异提示了一种机制,通过该机制可以发展出极大不同的上皮形态。
最后,研究人员证实S2标记F3在隐窝形成之前就已经存在,并且形成的小丘随着绒毛的形成而逐渐增加(Figure 5 F)。因此,在人肠道中,S2型纤维母细胞不仅是维持上皮隐窝位所必需的,而且可能在其形成中发挥积极作用。
人类肠道免疫力的发展
该研究中得到的图谱捕获了发育过程中来自6个谱系(巨噬细胞,单核细胞,树突状细胞,嗜酸性粒细胞,适应性和先天淋巴细胞)的2199个免疫细胞(Firgure6A和6B;Table S1;STAR methods)。免疫细胞在SI中(占捕获的所有细胞的3%–8%)比结肠(平均占1%– 2.5%)更为普遍,总体而言在孕早期之前尤其罕见。在10 PCW之前,研究人员观察到了髓样细胞富集(Figure S8 A),而在12 PCW时,涌入了大量的幼稚CD4+和CD8+T细胞,自然杀伤细胞(NK),1型先天性淋巴样细胞(ILC),以及3型ILC(Firgure 6C)。后者在胎儿肠道中的患病率比成人高得多,在某些晚期样本中占所有捕获的免疫细胞的30%。
胎儿ILC3表达IL7RA和ID2(TableS1),这对小鼠子宫Peyer’s斑块(PPs)的形成至关重要,因此将这些细胞区分为3型淋巴组织诱导剂(LTi)。PP的形成是一个LTi细胞、EC和基质细胞之间相互协调作用的过程。此外,鼠类研究显示其还需要RET/ARTN/GFRA3神经轴,而GFRA3缺乏会导致PP发育受损。肠道相关淋巴样组织(GALT)的形成被认为在出生前以PPs的形式出现在SI体内,而在出生后以结肠的形式出现。相反,在此,研究人员确定了一个独特的结肠而不是SI特异的神经胶质种群,它是发育过程中唯一的GFRA3来源,并在15 PCW时扩展(Figure6 D),表明在人类结肠发育过程中可能存在类似的神经免疫回路。
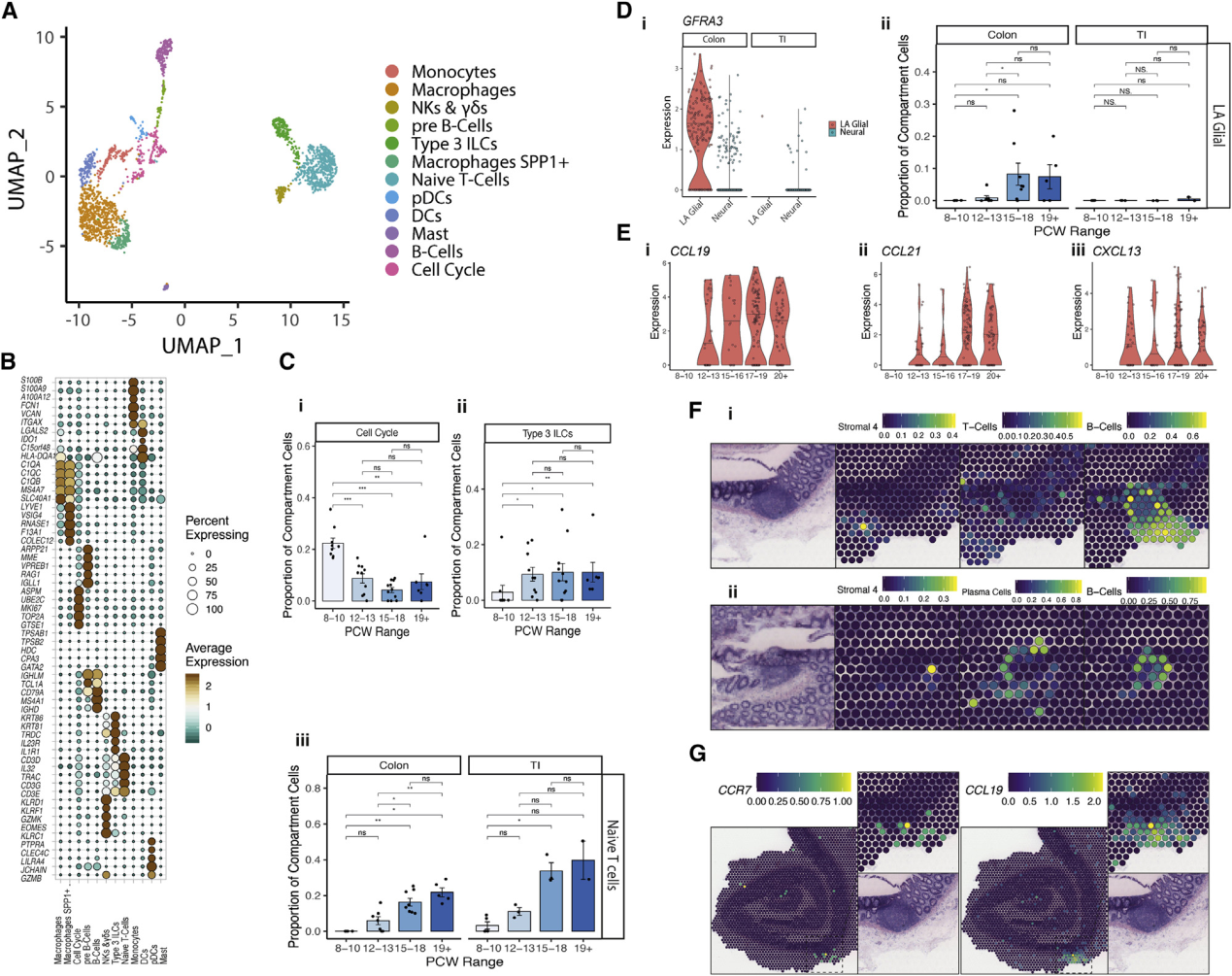
PP形成的其他关键介质包括通过CCL19,CCL21和CXCL13促进LTi组织归巢的基质组织细胞。研究人员发现这些特异性地定位于两个S4成纤维细胞簇,并且表达随着发育而增加(Figure6B和6E)。在S4簇中绘制RL相互作用的图谱突出显示了与各种免疫细胞的串扰,包括通过VCAM1 – ITGB7的ILC3信号传递(FigureS8 B)。这进一步支持了S4在淋巴样组织形成中的作用-这些粘附分子是GALT形成所必需的。LTi细胞和S4细胞还表现出通过IL7和CCL19/21与它们的受体IL7R/CCR7的相互作用(FigureS8C),如果小鼠中不存在,则会导致无法形成次级淋巴滤泡。

为了在空间上确认这些相互作用,研究人员研究了成人ST,其中粘膜下淋巴滤泡被视为独特的结构。S4和免疫细胞(例如CD3和CD19)的关键标记基因在这些卵泡中和周围表达,因子分析证实了各种成年免疫细胞(B细胞,T细胞和髓样细胞)和此处定位的S4细胞类型(Figure6) F)。研究人员还发现ST中关键RL对的显著共定位(包括CCR7 / CC19(1个点内p = 1.098×10 -10,半径内p = 5.59×10 -49)(Figure6G)。表明S4细胞是成年结肠中与卵泡相邻的成纤维细胞,在胎儿GALT发育过程中以时间依赖性方式出现。
两个S4簇在很大程度上都是SI特异的,维持PP的子宫发育,但不维持结肠GALT,并且在12 PCW之前完全不存在(FigureS8 D)。比较这两个种群的转录谱,发现S4 CXCL13 +亚型表现出许多隐性S2成纤维细胞的关键特征(POSTN,F3,PDGFRA和BMP5),并且是RANKL/TNFSF11的唯一肠道来源(FigureS8E)-其缺陷导致PP形成受损,并且是PP中M细胞分化所必需的。综上,PP中相同的隐周成纤维细胞起着上皮隐窝位支持细胞,淋巴组织形成的协调者和间质免疫串扰介体的作用,从而揭示了它们迄今未曾意识到的高度动态的作用。
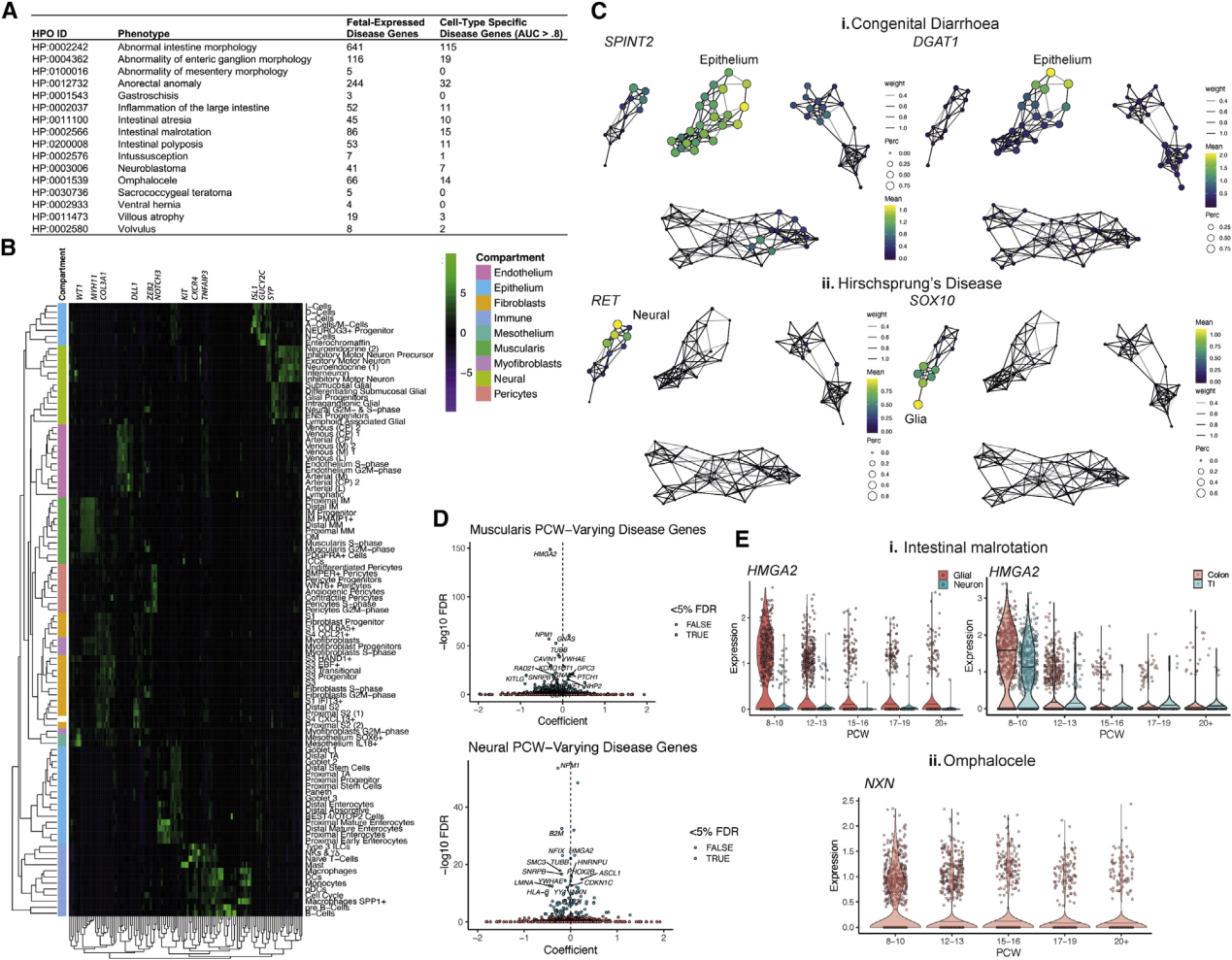
该研究在时间方面允许研究随着发育时间而变化的疾病基因(Figure7D),并可以提供与时间相关的信息,突出显示PCW前12胶质细胞和IM祖细胞表达的基因HMGA2(分别为FDR<2.2e-16)(Figure7Ei),与肠道旋转不良有关(12q14微缺失综合症,ORPHA:94063)。同样,早期抑制运动神经元特异的NXN的致病变体(Figure7Eii)会导致卵泡扩张(Robinow综合征,OMIM:618529)。在此发育时期,肠子回到了腹部,表明ENS细胞和肌肉祖细胞可能对该过程至关重要。








 京公网安备 11011302003368号
京公网安备 11011302003368号