导读
研究背景:
年龄老化使我们更容易感染慢性病和微生物感染的伤害。常见的老年相关疾病如心血管病(CVD)和慢阻肺病(COPD),是老年人死亡的第一大和第三大原因。2019年以来,新型冠状病毒引发的肺部感染(COVID-19)席卷全球,给人们的生命健康造成严重威胁。目前,该病毒全球累计感染6554余万人,其中死亡人数高达150多万。据美国疾病预防控制中心统计,住院死亡病例中超过70%为年龄65岁以上的老年人。新冠患者多表现为呼吸急促、心血管功能受损等一系列症状。与年轻群体相比,老年群体对新型冠状病毒(SARS-CoV-2)更加易感,且更易发展为重症、甚至死亡。但目前感染机制尚不清楚,所以我们迫切需要解决与高等哺乳动物衰老相关的细胞和分子机制。
方法与结果:
本文中,作者构建了年轻和年老的非人类灵长类动物的肺、心脏和动脉的单细胞核转录组图谱,这些是SARS-CoV-2靶向的主要组织。对细胞类型特异性衰老相关转录改变的分析显示,全身炎症增加和病毒防御受损是心肺衰老的标志。随着年龄的增长,肺泡上皮屏障、心肌细胞和血管内皮细胞中SARS-CoV-2受体血管紧张素转换酶2 (ACE2)的表达增加。我们发现白细胞介素7(IL7)在老年样本的心肺组织富集,并以NF -κB依赖的方式诱导ACE2在人类血管内皮细胞表达。此外,维生素C抑制了IL7诱导的ACE2表达。
结论:
作者描绘了年老的灵长类心肺系统的转录图谱,并提供了关于年龄相关的SARS-CoV-2易感性的重要见解,这表示神经保护策略可能降低老年人中COVID-19的严重程度。
中文题目:灵长类动物心肺衰老的单细胞转录组图谱
英文题目:Single-Cell Transcriptomic Atlas of Primate Cardiopulmonary Aging
发表期刊:Cell Research
影响因子:20
发表时间:2020.9.10
作者:huai Ma
材料与方法
作者以食蟹猴为研究对象,选取了4~6岁(相当于青壮年20岁)幼龄和18~21岁(相当于老年人79岁左右)的食蟹猴,通过单细胞核测序方法进行单细胞图谱的绘制;
方法:RNA-seq,单细胞核转录组测序(snRNA-seq)等
实验结果
分别对两组样品选取肺和心脏组织进行单细胞核测序(图1a)。与幼龄猴肺相比,老年猴肺的特征是肺泡增大、纤维化增加和脂肪沉积(图1b)。此外,在老年猴心脏中出现脂肪浸润。同时,衰老的肺和心脏表现出较高水平的半乳糖苷酶(SA-β-Gal)染色,而这个是细胞衰老的特征(图1c)。通过单细胞核测序,共获得150000个细胞,利用UMAP聚类分析,鉴定了具有不同细胞特征的19中肺细胞和18中心脏细胞。利用已知细胞特征进行再次鉴定,在肺中,鉴定到了AT1和AT2、纤毛细胞(CCs)、内皮细胞等,并鉴定出7中免疫细胞,包括AMs、IMs、B细胞、T细胞等(图1d)。在心脏中,鉴定了肥厚性心肌细胞(H-CMs)、心外膜细胞、两种神经传导细胞等,并鉴定出5种免疫细胞(图1g)。通过GO数据库注释和转录组分析显示,细胞类型在灵长类动物衰老过|中没有明显影响。研究显示作者的数据代表了年轻和年老灵长类动物肺和心脏的单核细胞转录图谱。
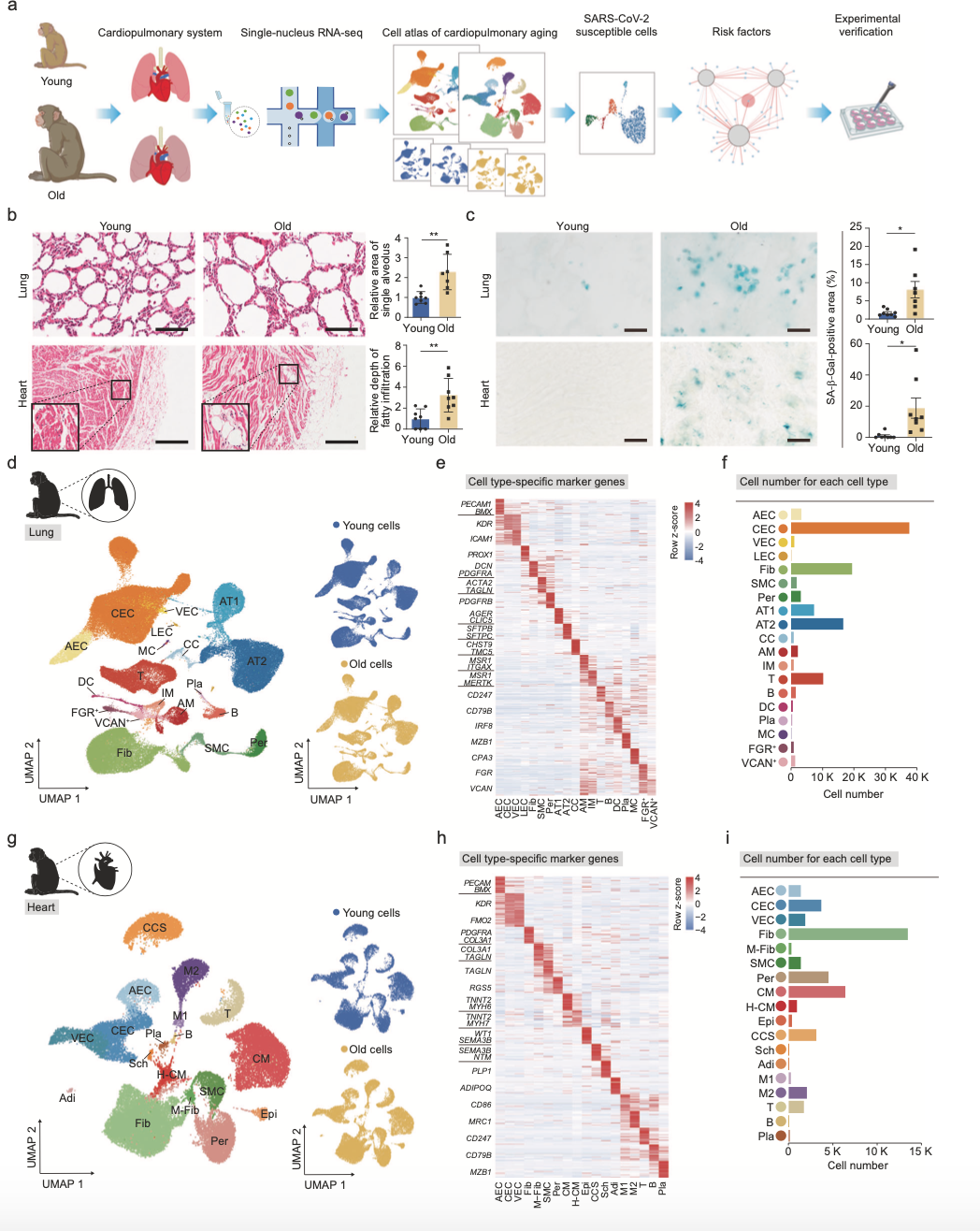
图1
为了阐明细胞水平上与衰老相关的分子机制,作者在个性肺细胞中识别和衰老相关的转录组变化。通过差异分析(| logFoldChange(logFC)| 0.25,调整后的P值<0.05)显示,共获得1356个差异基因(图2a)。衰老过程中受影响最大的细胞包括AMs、T细胞、成纤维细胞、AT1和AT2,在老年和青年肺亚型中分别有372、262、239、235和217个差异基因。通过数据库注释,这些基因包含了肺部疾病(COPD、肺炎、肺纤维化、哮喘等)的热点基因。下调的DEGs参与上皮细胞增值、止血和表面活性物质代谢(图2c),提示衰老过程中肺功能受损。此外,SASP相关基因在10中类型细胞中过表达(图2d),表明老年肺以细胞应激和慢性炎症为特征。具体来说,上调的DEGs与囊泡介导的转运有关(图2c),这可能构成病毒内化的一个贡献者。在蛋白水平上,通过免疫荧光分析证实了缺氧诱导的转录因子HIF1在老年肺中表达上调,提示老年肺可能发生明显的缺氧应激反应,这可能是导致深度衰老的原因之一。通过上皮细胞和免疫细胞的转录特征分析,观察到21个囊泡介导的转运相关基因在AT2细胞中,这可能与病毒的进入、组装等相关。因此,这些结果揭示了衰老可能导致肺泡上皮屏障功能衰退以及病毒防御能力受损。
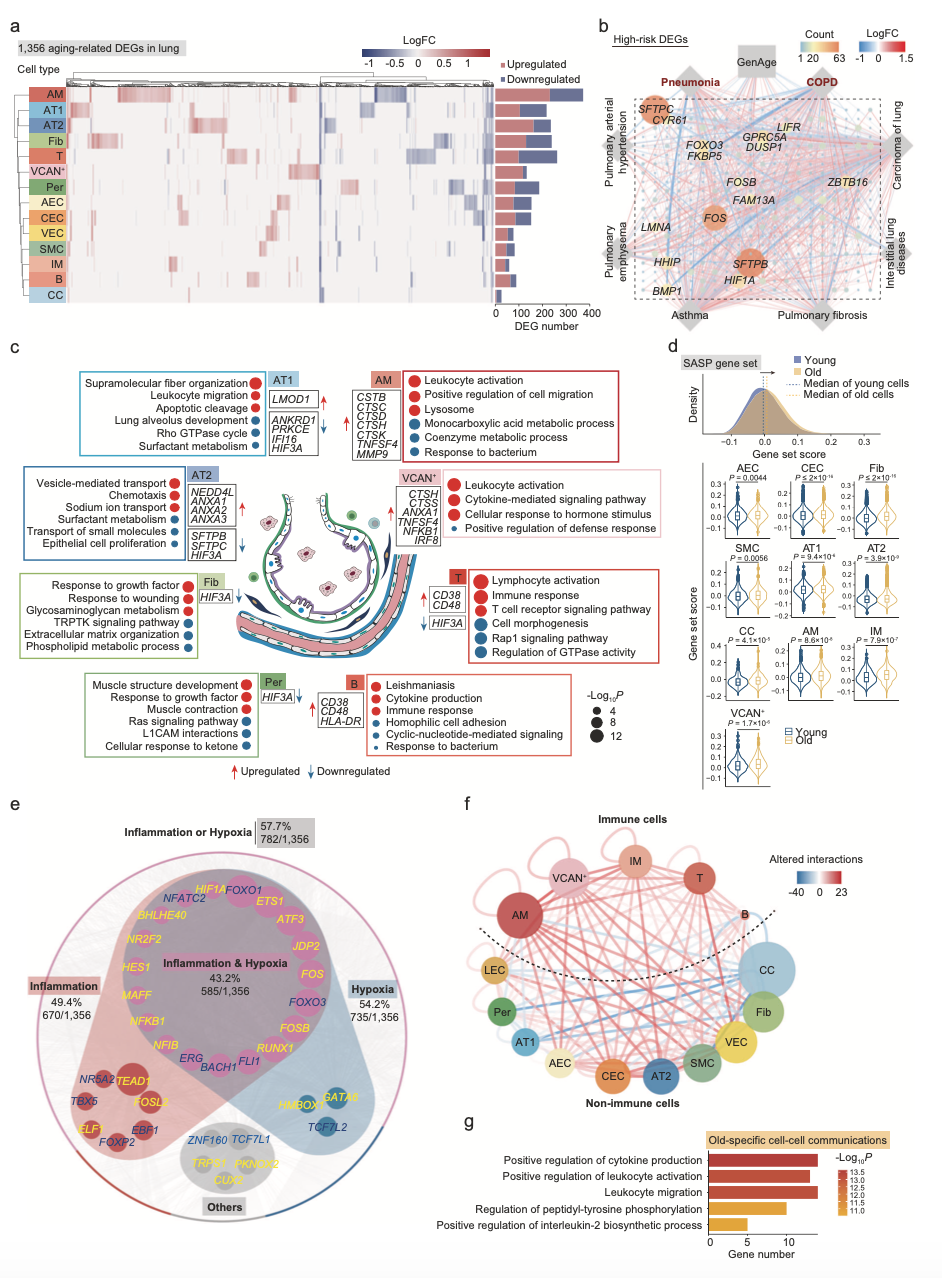
图2
总的来说,老年肺组织中许多免疫细胞类型的比例增加,包括肥大性细胞和浆细胞,他们分泌细胞因子和抗体导致年龄相关性炎症、慢阻肺病和肺纤维化的比例增加。 为了探索衰老心脏中细胞特异性的分子机制,作者筛选出了1857个差异基因(|logFC| > 0.25, P value < 0.05)(图3a),其中数十个基因是肥厚型心肌病的热点基因(图3b)。反映了心脏中与年龄相关的基因表达变化与老年人心脏病高发之间的紧密联系。
通过对免疫细胞分析,在衰老的心脏中,免疫细胞和外周细胞的整体通信频率增加,表明心脏免疫失调是心脏老化的一个重要特征。
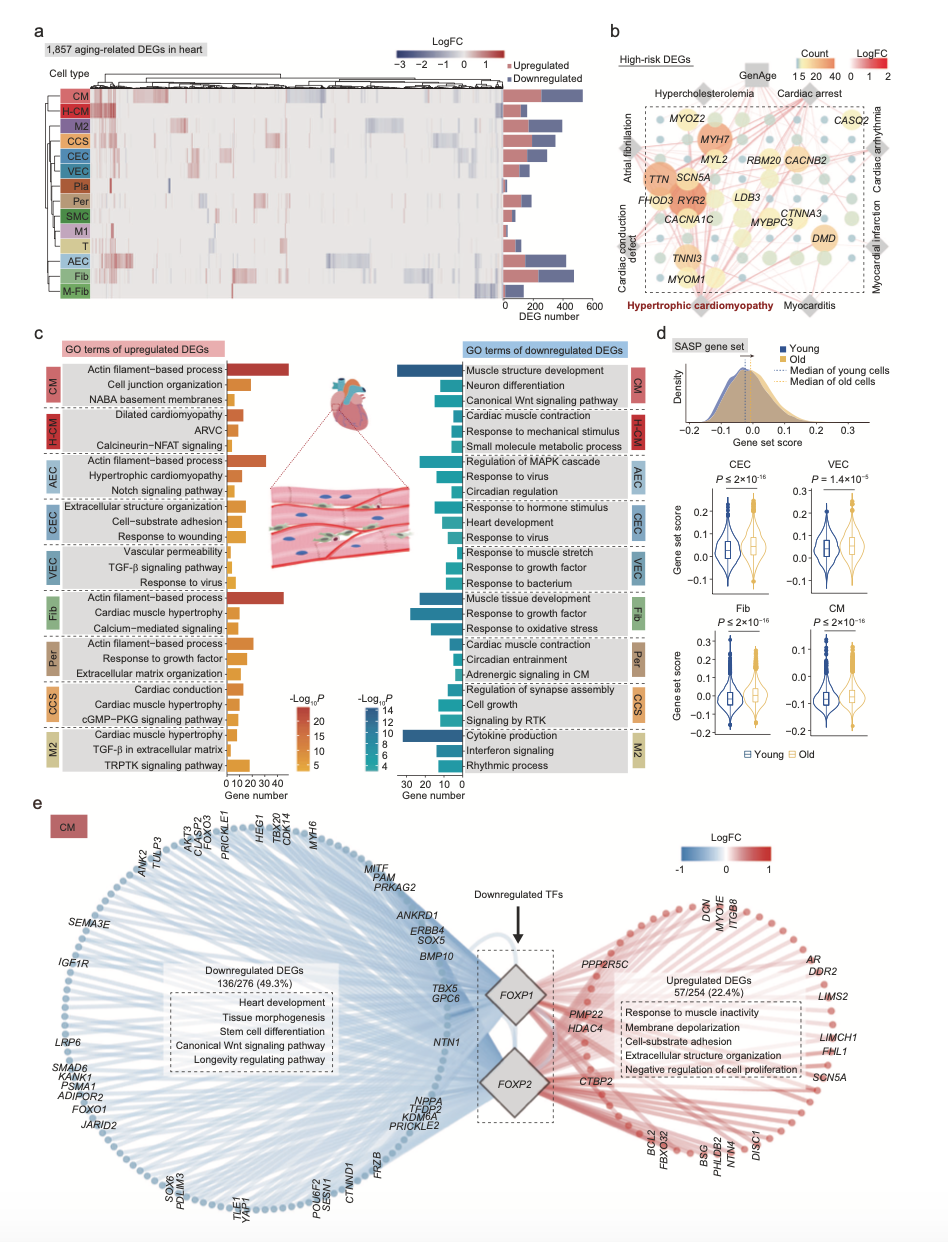
图3
为了识别可能被SARS-CoV-2靶向的细胞类型,作者分析了ACE2、TMPRSS2、FURIN和其他可能的辅助蛋白的细胞特异性的表达模式。在肺中,ACE2在AT2(7%)、AT1(1%)、纤毛细胞(3%)等类型中表达(图4b-d),另外还发现,一小部分内皮细胞表达ACE2、AECs、CECs均表达为0.2%,AT2和AT1中检测到大多数ACE2和TMPRSS2双阳性细胞。组织蛋白酶家族成员的FURIN、CTSB、CTSL等膜锚定蛋白酶与ACE2共表达。这些数据确认AT2和AT1是肺中COVID-19的易感细胞类型。有趣的是,衰老细胞中ACE2阳性的AT1细胞比例增加了约2倍。更重要的是,衰老过程中,NHP和人肺部的免疫染色均证实了肺泡周围ACE2阳性细胞的增加,提示随着年龄的增长,肺泡表面更容易感染SARS-CoV-2的细胞比例增加。
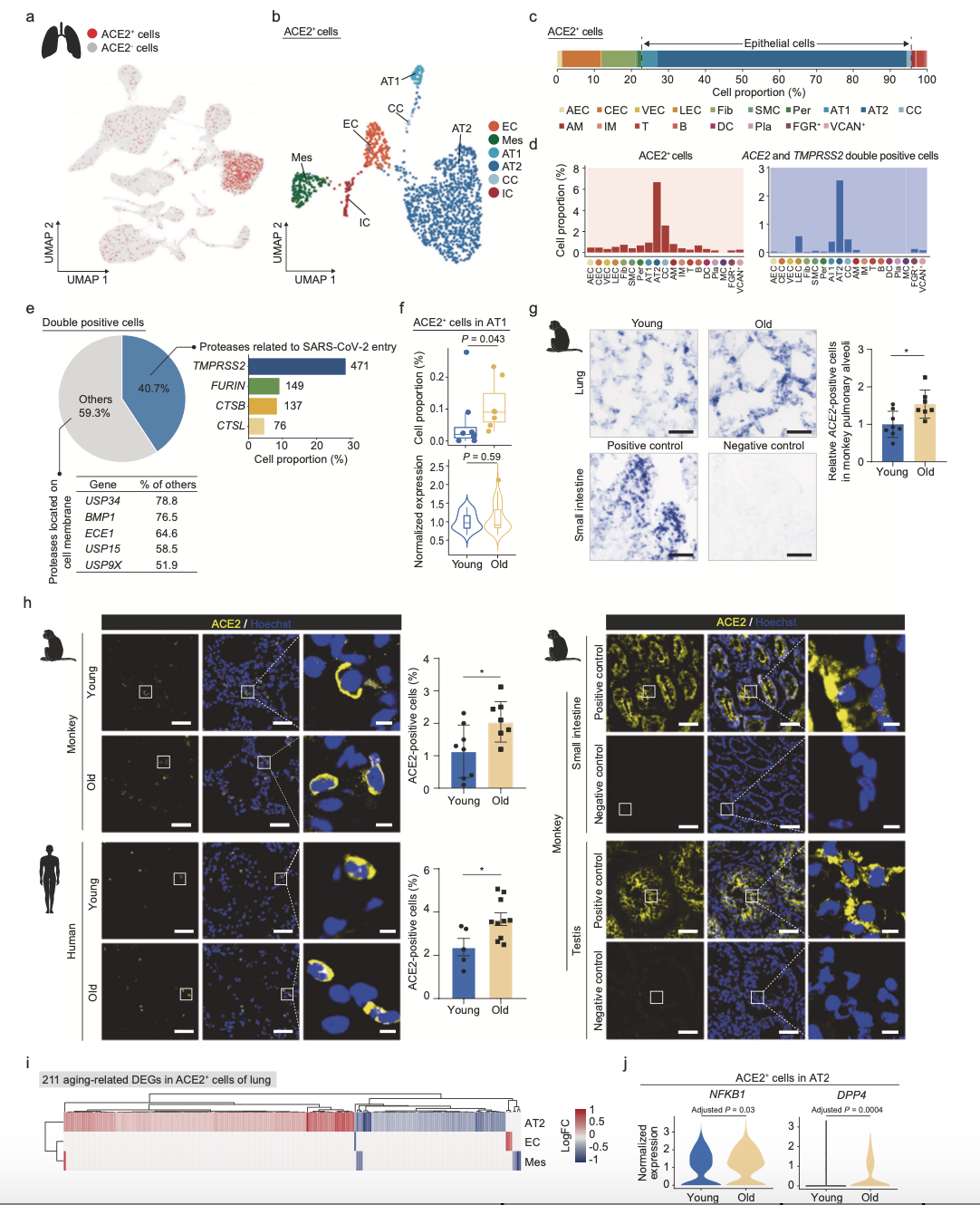
图4
最后,作者试图探索哪些与衰老相关的因素可能介导灵长类组织中ACE2的上调、因为大量RNA-seq分析显示,IL7不仅在老年人肺部、心脏和主动脉普遍上调,同时,也是导致COVID-19患者免疫过度反应的细胞因子之一。研究发现,IL7的刺激在测试的时间内上调了ACE2的表达,在药物治疗后两天达到了最高的记录。另外,IL7对HAECs的处理通过Western blot分析显着上调了ACE2的表达水平。因此,这些结果表明,IL7在灵长类动物衰老期间,至少在HAEC中,在上调ACE2表达中起关键作用。而维生素C的预处理会使HAEC中IL7诱导的ACE2表达减弱。
总结
在这项研究中,研究人员分析了老年灵长类动物呼吸道和心血管组织的单核转录组图谱,以了解其易受年龄相关疾病和COVID-19侵害的细胞和分子基础。发现灵长类动物肺部和心血管衰老的关键特征包括受损的组织稳态和病毒防御能力以及激活炎症反应。提出将抗神经保护剂重新用于COVID-19治疗,尤其是对于弱势老年患者,可能是预防和治疗策略之一。另外阻断IL7信号传导可能有助于降低全身或局部ACE2水平并缓解SARS-CoV-2症状。







 京公网安备 11011302003368号
京公网安备 11011302003368号