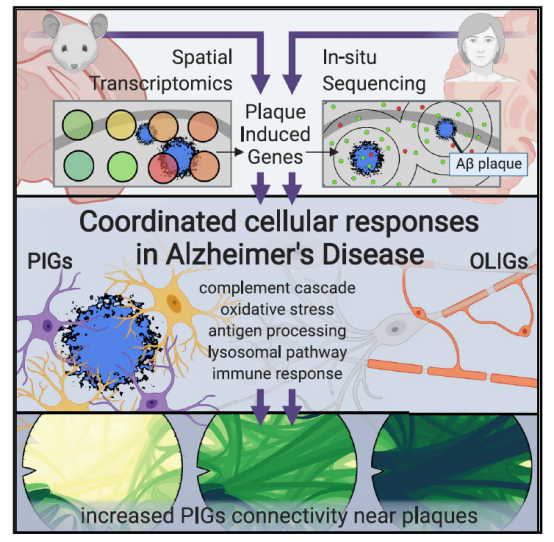
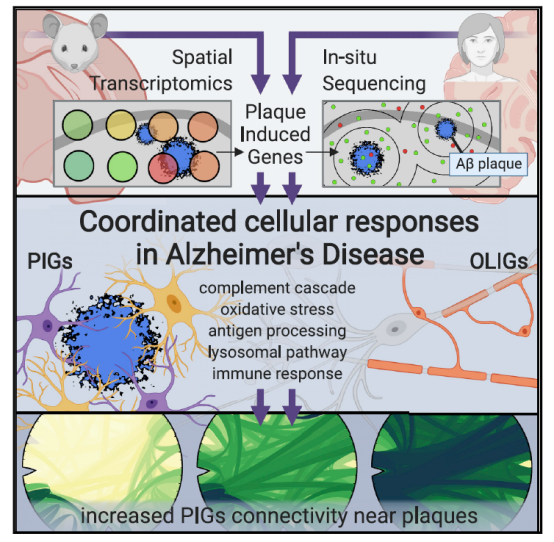
在AD的过往研究中,大家发现淀粉样斑块周围存在复杂的炎性样改变,但我们对这种反应的分子变化和细胞间的相互作用知之甚少。本文利用空间转录组技术研究一个AD小鼠模型,可以分辨淀粉样斑块周围直径为100μm的组织结构域转录变化。实验数据证实了一个早期髓鞘和OLIGs富集的基因共表达网络变化,以及一个涉及补体系统、氧化应激、溶酶体、炎症的PIGs多基因共表达网络。作者进一步通过人鼠大脑切片的原位测序在细胞水平证实了观察到的大部分改变。可以说全基因组空间转录组分析为AD和其他脑部疾病提供了一种方法来解密致病特征附近的细胞网络异常。
研究背景
NGS技术飞速发展,在生理和病理方面定义细胞状态得到巨大进步。例如,在AD领域,我们现在知道小胶质细胞对β-淀粉样蛋白(Aβ)斑块表现出典型的活化反应。神经元、星形胶质细胞和少突胶质细胞比小胶质细胞更难分离,但单细胞核是一个合适的选择。这些细胞的胞质mRNA不能很好的展示,而且解离手段诱导了人为的表达改变。基本的问题还是,丢失了大部分的空间信息,包括细胞和淀粉样蛋白斑的关系。而空间转录组可以解决这一问题,它的空间标签阵列可以记录测序分子的空间位置,无偏地分析组织上的转录本信息。
目前AD研究的一个中心问题是淀粉样蛋白斑和神经退行性进程的关系。这个斑块可能是AD的触发器或者驱动器。遗传分析表明,散发性AD的风险与小胶质细胞中表达的对淀粉样蛋白沉积有响应的基因有关,但是星形胶质细胞、神经元、少突胶质细胞也对蛋白斑有分子响应。“AD的细胞相变”研究致力于综合地了解这些细胞间渐变的复杂相互作用,这也确定了Aβ沉积引发的致病结果。然而,我们对淀粉样斑块附近细胞中发生的分子变化依然知之甚少。
研究方法
一、 实验材料
人组织:AD晚期和正常对照大脑,女性(75岁左右)
鼠: AppNL-G-F KI、C57BL/6J,雄性
空间转录组测序、原位测序
实验结果
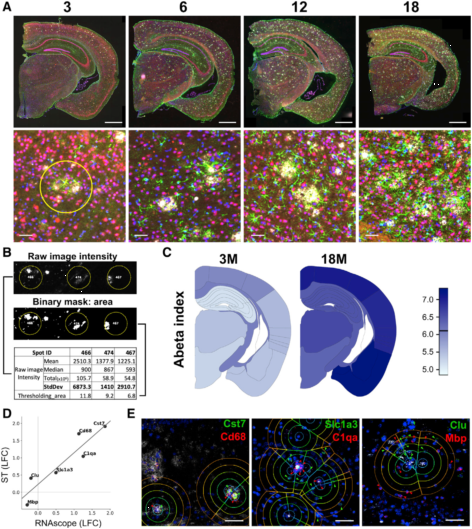
作者使用3、6、12、18月龄的AppNL-G-F和C57BL/6小鼠大脑进行冷冻切片,每只切三片,外侧做免疫组化,中间做ST(图1A)。每个冠状切面包含500多个TDs的转录谱,20个切片合计10327个转录谱。并对每个TD进行了空间、病理和细胞信息的注释。实验中每个TD检测到31283± 7,441个唯一分子标签和6,578 ± 987唯一基因。作者将每个冠状切片与艾伦小鼠大脑图谱鉴定的14个解剖大脑区域进行匹配(图1B),并且每一个TD都被分配其中。TDs的数量介于112(内嗅皮层ENTI)和2114(丘脑TH)之间(图1B)。最后将三张切片整合,用Aβ负荷(6E10染色)、反应星形胶质细胞(GFAP)、神经元(NeuN)以及细胞核(DAPI)对其进行注释。
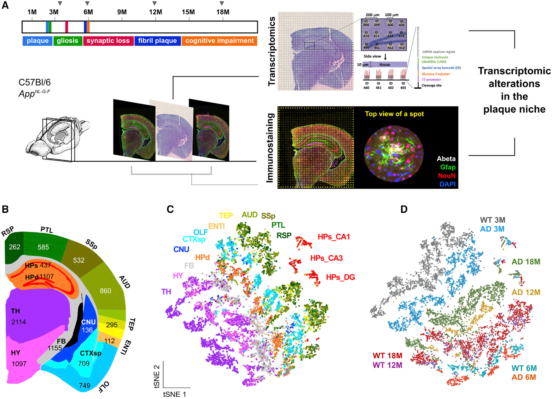
图1 | 成年小鼠大脑的空间转录图谱
一、 成年小鼠大脑的空间转录组结果
作者对10327个转录谱进行t-SNE分析聚类(图1C),并且对年龄和基因型也进行了很好的区分(图1D)。分区结果表明了ST技术可以清晰地分辨出大脑解剖区域。野生型(WT)的斑点在12月龄和18月龄有所重叠(图1D紫色和红色),而AppNL-G-F的转录谱在这两个时间点一直改变(黄色和绿色),这也与这段时期的病理进展一致。
二、 将基因表达变化与Aβ沉积进行关联
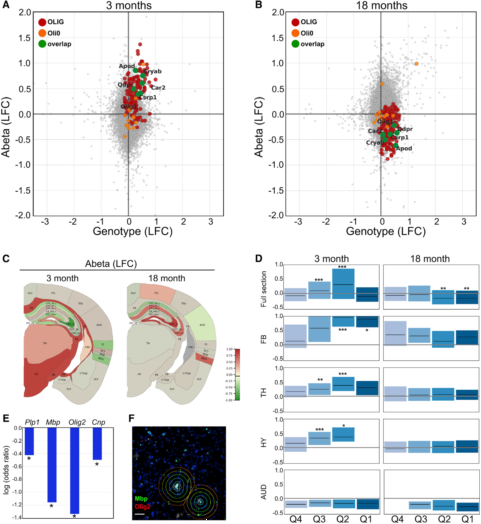
AppNL-G-F小鼠的淀粉样沉积从3月龄左右开始(图2A)。在18月龄的切面上,78.5–4,950 μm2区域内有1,565 ± 167个斑块。单个TD的直径是100 μm,切片厚度也是100 μm。因此,有理由认为中间切片的细胞接触到了邻近切片检测到的淀粉样斑块。作者使用一个TD上的Aβ像素荧光强度的标准偏差作为Aβ指标。这种方式可以区分轻微的和强烈的Aβ堆积(图2B)。作者平均了每个脑区TD的Aβ指标(图2C),这与Aβ免疫染色一致,说明Aβ从背部往腹部皮层、丘脑、海马区进展。
为了解基因表达的变化,作者进行了两个差异表达分析。首先比较AppNL-G-F 和 C57BL/6(基因模型),其次是Aβ沉积对基因表达的影响(Aβ模型)。作者使用6个转录本进行经典的RNA原位杂交实验来验证Aβ模型(图2D&E),根据模型,18月龄的AppNL-G-F,Cst7,Cd68,C1qa,Slc1a3,Clu和Mbp表达异常。在图2D中可以看到,ST的数据和RNA原位杂交数据高度相关,这也证实了本方法的有效性。
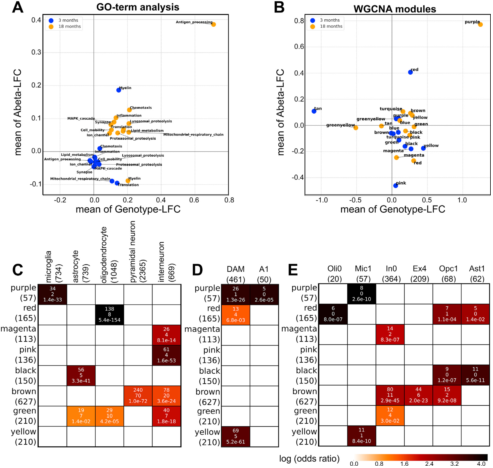
具有相似表达模式的基因很可能拥有相似的功能,因此可以通过加权基因共表达网络分析(WGCNA)进行模块聚类。作者研究了10327个转录谱中变化程度*大的50%的基因,识别出12个模块,并使用GOrilla提取了可能的生物学功能、Aβ暴露的表达变化、3月龄和18月龄的基因型、细胞特征、受影响的脑区。
三、 PIG模块的鉴定
WGCNA分析中紫色的模块被称为PIGs,在18个月龄时,它在Aβ和基因型轴上*活跃(图S3B)。这个模块包含57个基因,开始时微微上调(图3A),6-12月时在整个大脑中急剧增加至一种稳定的状态(图3B)。18月龄AppNL-G-F小鼠的所有TDs在Aβ沉积和PIG中间存在一个中等但显著的相关性(图3C),说明PIG表达随着整个大脑中Aβ的沉积逐渐增加。
根据GO分析,作者得出该模块参与了经典补体级联,以及补体级联触发的效应机制,如内吞作用,溶酶体降解、抗原处理和递呈、免疫应答和氧化还原过程。
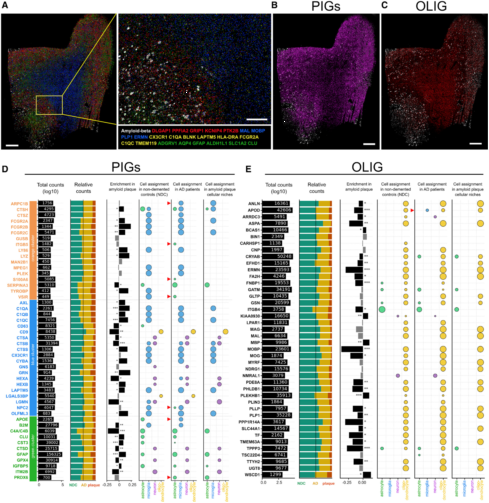
作者进一步研究了PIG模块的细胞学特征,鉴定出其与激活的小胶质细胞(疾病相关DAM或者激活响应的ARM)和炎性星形胶质细胞(A1)有关联(图S3D)。重点突出了5个与A1标记重叠的PIGs和15个DAM/ARM 基因(图3D)。另外36个PIGs以前并没有被定义为疾病相关的神经胶质基因。激活的小胶质细胞和星形胶质细胞参与了前十的联系*紧密的枢纽基因(图3D,红色)。作者评估这些PIGs是否可以在人数据库中被鉴定出来。在41个细胞亚群中,与PIGs*相关的是AD相关的小神经胶质细胞(Mic1,图S3E)。作者通过参与Aβ暴露和基因型的人Mic1 Marker基因的同源序列来放大基因表达变化(图3E&F,橙&绿)。对小鼠的分析表明,人脑中的Mic1反应是对淀粉样蛋白斑块的大量的多细胞协调反应的一部分,而且这种反应会随着时间的推移而演变。
图S3 | GO分析和WGCNA共表达网络分析
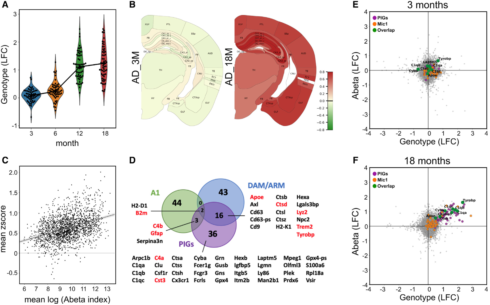
图3 | Aβ斑块诱导基因(PIGs)的鉴定
ST展示了淀粉样蛋白斑周围的多细胞反应,作者寻求一种正交独立方法从单细胞分辨率下进行验证。原位测序(ISS)可以在一个反应中使用许多靶向特异的原位标签。作者使用了特制的探针来绘制PIGs表达以及细胞类型标签(Itgam、 Cx3cr1、Csf1r对应小胶质细胞;Slc1a3、Gfap 、Clu对应星形胶质细胞; Syp对应神经元; Plp1对应少突胶质细胞;图4A-C)。ISS实验中,对AppNL-G-F和两只18月龄WT小鼠各构建两个文库。用每个基因的荧光点数目来量化基因表达,并将荧光点聚类到淀粉样蛋白斑周位的5个同心圆上(图4D)。51/54个PIGs在圈1上明显富集,而C1qb在圈1上明显减少(图4E)。ISS的结果与ST的结果线相关性非常好(图4E)。
作者开发了一种算法来检测PIG网络的细胞特征,通过计算5μm半径内的细胞类型Marker斑点的富集来匹配每个斑点到细胞型。通过预测每个Marker基因的细胞类型来验证这个算法(图4G)。很明显,PIG响应Aβ,这主要是因为小胶质细胞,小部分由于星形胶质细胞(图4H)。而一些PIGs在多种细胞类型中明显富集。例如,Cyba在小胶质细胞和少突胶质细胞中表达。
最后,作者使用RNA原位杂交,验证18月龄AppNL-G-F的补体部分(C1qa、C4、 Clu)表达。实验证实了C1qa在Itgam阳性细胞(小胶质细胞)中表达,Clu在 Slc1a3阳性细胞(星形胶质细胞)表达,C4在Mbp阳性细胞(少突胶质细胞)表达,这些细胞紧挨淀粉样蛋白斑。这三个补体部分的细胞特征经过RNA原位杂交检测,与ISS分析结果一致。
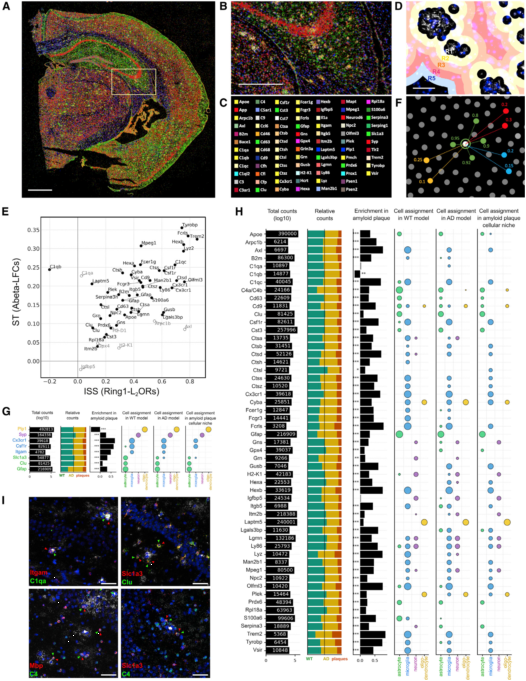
图4 | ISS鉴定的PIGs细胞标签
五、 PIG模块中小胶质细胞基因和星形胶质细胞基因的共表达
为了探究PIGs在不同细胞中表达的相关性在多大程度上是由累积的Aβ病理驱动的,作者仅在PIGs上使用WGCNA分析,根据Aβ标签分离所有ST的TDs为WT和四个AD分位数(图5)。WGCNA生成了一个连接矩阵,表明每个基因的改变是如何与其他所有基因的关联的。图5展示了随着Aβ暴露,共表达网络逐渐形成。
在WT中,所有PIGs的关联相对较低,PIG被分为三个簇(图5,绿、蓝、橙)。ISS实验(图4H)证明了在绿色簇中,星形胶质细胞基因(7/12)富集,而蓝色(14/23)和橙色(14/28)簇聚集了小胶质基因中表达的PIGs。在WT中,橙色的PIGs几乎不关联,而AppNL-G-F小鼠中,在接触增长的Aβ后,这些PIGs的基因被招募。随着Aβ指标增长,PIGs内部和相互之间的关联增强。在Q4-Q1中,随蛋白斑积累程度增加,互作关系明显增加。
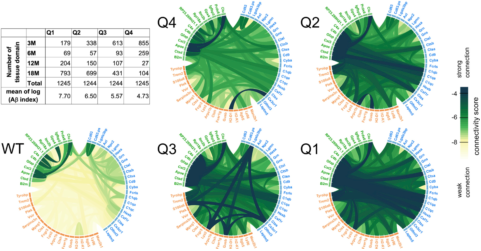
图5 | 随Aβ沉积,PIGs逐渐共表达
第二个变化比较大的模块(红色),在WGCNA(图S3B),由165个基因构成,他们主要在少突胶质细胞中表达,因此命名为“OLIG模块”。这个模块最富集的功能种类是GO:0007272包膜神经元、GO:0043209髓鞘、GO:0008366轴突包膜以及GO:0042552髓鞘形成。模块最富集的10个基因是髓鞘相关的转录本:Plp1、Mbp、Mobp、Cldn11、Mal、Apod、Cnp、Trf、Fth1、Plekhb1。比较OLIG与过往发表的小鼠单细胞数据,少突胶质细胞关联很强(图S3C),活化小胶质细胞(DAM/ARM)轻度关联(图S3E)。OLIG与人AD相关的少突胶质细胞Oli0关联密切(图S3E)。作者突出标记了20个人类Oli0 markers同源序列(图6A&B,橙色、绿色)。几个Oli0同源序列与OLIG模块同步上调和下调。
类似于髓鞘类(图S3A),与3月龄和18月龄的WT小鼠相比,AppNL-G-F小鼠在OLIG模块的基因型轴线全脑范围上全部上调(图6A&6B)。这种基因型效应可能反映了小鼠大脑对人源和突变的App基因的整体反应。但是,从基因型中把Aβ暴露(Aβ轴)分理出后,作者发现了一个OLIG模块的有趣变化:在3个月时,全部呈正相关,在18个月时为负相关(图6A&6B)。在不同的大脑区域,这种反应也有明显的差异(图6C)。比较图2C中淀粉样蛋白斑和OLIG表达,可以明显发现OLIG表达的主要驱动因素不是Aβ指标而是大脑区域本身(图6C)。在3月龄时,作者发现在纤维束(FB)、丘脑(TH)和下丘脑(HY)中显著的OLIG-Aβ正相关,而在内嗅皮层(ENTI)和几个海马体皮层中存在显著负相关。在18月龄时,作者在听觉区域(AUDS)发现了OLIG-Aβ存在明显负相关,而在ENTI和海马体中存在显著正相关。
作者进而更详细地从Aβ指标和OLIG表达的关系方面分析这些区域的不同。在图2中,Aβ沉积随疾病的进展而不同。甚至在3个月时,有些TDs暴露于Aβ(图5,Q1中179个TDs)。随着Q4-Q2中TDs的Aβ缓慢增长,OLIG表达增加(图6D)。但是,三月龄有着*高Aβ暴露(Q1,比Q4中Aβ高21倍)的TDs中OLIG的表达存在一种降低的趋势。另外,低Aβ暴露的TDs中OLIG模块的基因对的连接强度之和*强。为了进一步证明发现,作者对三月龄AppNL-G-F小鼠的整个冠状切片,设计四个OLIGs(Plp1、Mbp、Olig2和Cnp)探针做RNA原位杂交(图6E&F)。结果显示,在三月龄小鼠稠密的淀粉样蛋白斑周围,这4个OLIGs明显减少。可以推测,在轻度Aβ暴露下,OLIG模块高表达和相互连接,但在高密度Aβ积累的微环境中表达减少。因此,部分OLIG模块的区域差异与不同的Aβ暴露有关。
作者使用3名AD患者和3名正常对照组死后的人脑样本进行实验。AD大脑处于淀粉蛋白斑C阶段和神经元纠缠V-VI阶段的疾病进展期。研究描绘了与AD相关的额上回组织谱,总共报告了222个基因表达谱,包括45个人PIGs同源序列,OLIG模块中42个斑块反应基因的同源序列,以及一系列细胞类型Marker。这些细胞Marker很好地在细胞分辨率下描绘了大脑区域(图7A)。PIG模块(图7B,紫色)和OLIG模块(图7C,红色)基因如预期的在大脑灰质和白质中富集。
作者使用分析小鼠ISS数据的方法来研究对照组中人PIGs和AD大脑同源序列的分布。大部分PIGs在AD和对照组中相同的细胞类型中表达。在对照组中,PIG模块中3个子模通过星形胶质细胞(绿色簇)和小胶质细胞(蓝色和橙色簇)表达(图7D)。然而,作者依然在神经元中发现了9个富集的PIGs(LGMN、HEXB、HEXA、CTSB、CTSA、GNS、GPX4、CTSD和ITM2B),两个在少突胶质细胞中富集(LGALS3BP和CD9)。PLEK、CYBA和LAPTM5在小鼠的少突胶质细胞中显著富集,而在人类的小胶质细胞中显著富集。作者最终确定18/45的个PIGs在淀粉斑细胞位上明显富集,包括9个小胶质细胞PIGs,5个星形胶质细胞PIGs以及5个多细胞类型表达的PIGs。有趣的是,作者发现APOE和ARPC1B在小胶质细胞中显著表达,NPC2、 S100A6、ITGB5、PRDX6和VSIR在AD患者星形胶质细胞中显著表达,而在对照组中没有,提示在AD患者中疾病相关的胶质细胞激活。
作者使用类似的方法,从OLIG模块中差异表达*高的基因选出42个人类同源序列的细胞进行细胞特征分析(图7E)。淀粉样斑块细胞生态位中有22个基因显著缺失,5个基因在淀粉样斑块细胞生态位中显著增高表达。有趣的是,通常由少突胶质细胞表达的APOD在大脑中表达,并在AD中上调,在AD患者的小胶质细胞中也显著富集,但在对照组中没有。
对比人和小鼠的数据,需要顾及物种差异,在鼠中,只有淀粉样斑块诱导的病理进行了研究,然而,AD的后期阶段,Tau蛋白、坏死性凋亡等等对病理的额外贡献导致病理情况变得复杂,并没有出现在小鼠模型中。小鼠模型反映了疾病的早期阶段,而人从淀粉斑出现到最终发展为痴呆需要长达20年的时间。人类疾病发生的过程会更加复杂,不过小鼠中鉴定出的PIG和OLIG模块会在AD晚期有重要作用。
图7 | 通过ISS使人脑中PIG和OLIG模块可视化
文章总结
本文使用空间转录组在数百个微小组织区域(TDs)进行原位测序,发现了淀粉样蛋白斑诱导的全基因组转录组改变。同时使用正交的原位测序方法在单细胞水平分析了数百个重要基因。进而绘制了响应Aβ沉积的两个基因共表达网络—-PIGs和OLIG。分析数据发现淀粉样蛋白斑并不是简单的“发病结果”,还会诱导一系列的基因变化 ,影响疾病进展。










 京公网安备 11011302003368号
京公网安备 11011302003368号