发表杂志:Nature Communications,2020年4月
影响因子:12.121
同济大学生命科学与技术学院高绍荣团队与江赐忠团队在Nature Communications杂志发表了Hi-C互作的相关研究成果。他们采用经过优化的少量细胞全基因组染色质构象捕获技术(sisHi-C),对小鼠SCNT胚胎发育过程进行连续采样,详细描绘了SCNT植入前胚胎染色质高级结构的动态变化过程。
研究背景
研究方法
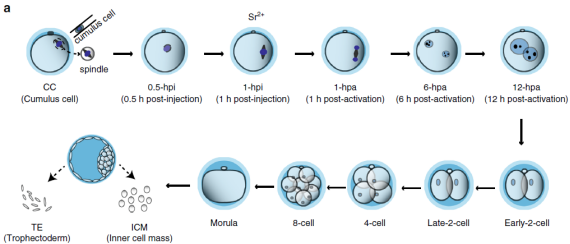
样本:不同时期的胚胎细胞及SCNT流程见(图1a)
测序方法:sis Hi-C测序、RNA-seq和ChIP-seq
图1a SCNT的流程和不同时期的细胞样本
研究结果
1.SCNT胚胎三维染色质结构
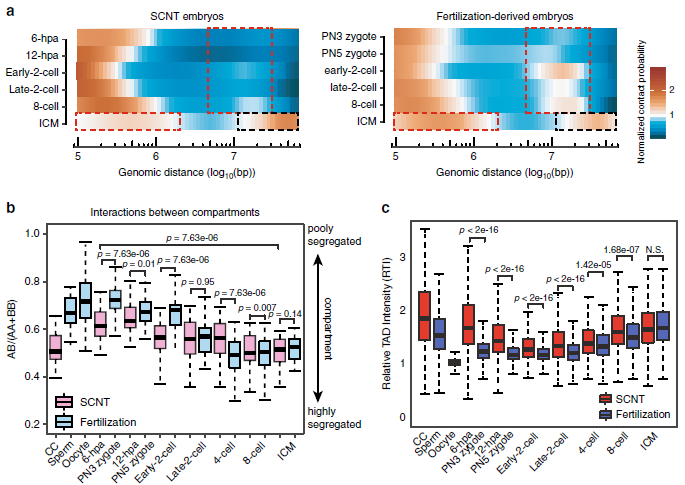
不同时期的胚胎的染色质三维构象见下图,图中分别展示了分辨率为100kb和40kb时的Hi-C互作矩阵。将CC(Cumulus cell)核注入无核卵母细胞后,染色质结构TADs和Compartments迅速溶解,并在6-hpa胚胎中部分恢复。令人惊讶的是,1-hpi和1-hpa单细胞胚胎远端相互作用明显较少,并显示出一致的相互作用模式,这与中期染色质组织状态高度相似。
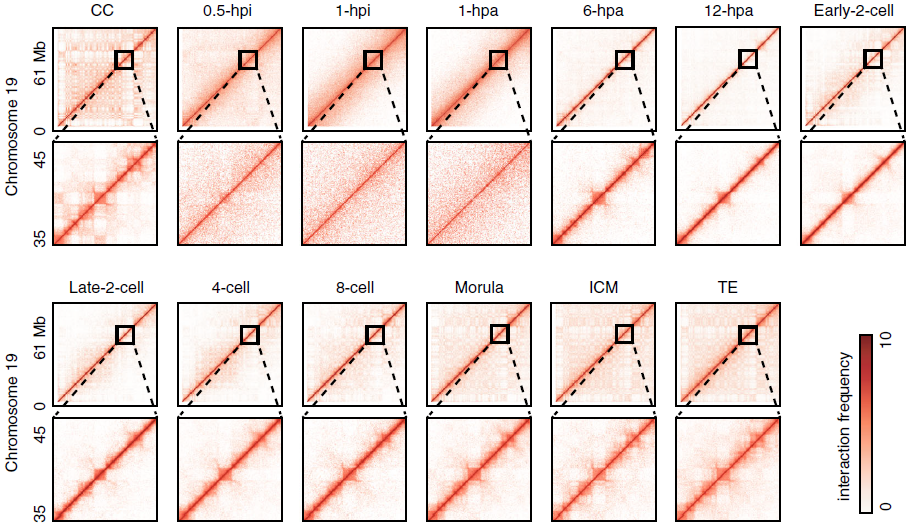
图1b
免疫荧光染色在1-hpi和1-hpa胚胎中检测到纺丝装置凝聚的染色体,这与其他阶段胚胎中带有核膜的间期染色质形态不同(图2a)。进一步分析表明,1-hpi胚胎的P(s)曲线与小鼠ESC中期相似,在10Mb时迅速下降,而1-hpa胚胎的P(s)曲线与小鼠MII卵母细胞相似,在4Mb时突然下降(图2b)。这表明当供体细胞在去核卵母细胞中被人工激活1个小时(1-hpa)后,基因组经历了从类有丝分裂中期向类第二次减数分裂中期的转变。
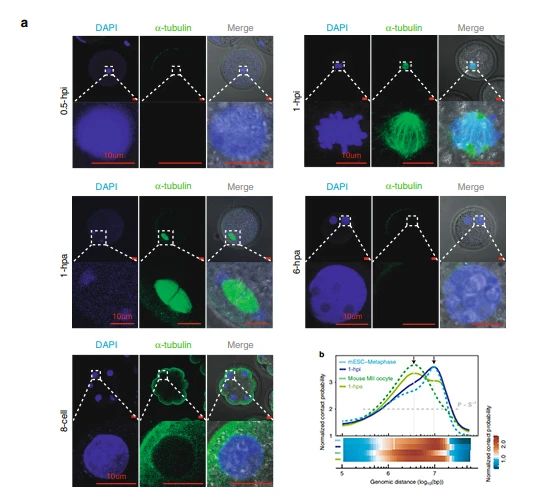
图2 有丝分裂中期向类第二次减数分裂中期的转变
2.SCNT胚胎发育过程中Compartments和TADs的重编程
除了1-hpi和1-hpa阶段外,在所有阶段的相关热图中均观察到染色质相互作用的明显格子图案(图3a),每个热图下面的PC1以红色和蓝绿色分别指示Compartments A和Compartments B。

图3a SCNT胚胎发育各个阶段的Compartments强弱变化
SCNT胚胎发育6小时(6-hpa)进入拟原核期(对应正常受精胚胎PN3时期)后,出现了较弱的TADs(拓扑相关结构域)信号,并持续减弱至早期2细胞期,在2细胞晚期到8细胞卵裂期逐步重新建立,直到囊胚期成熟。
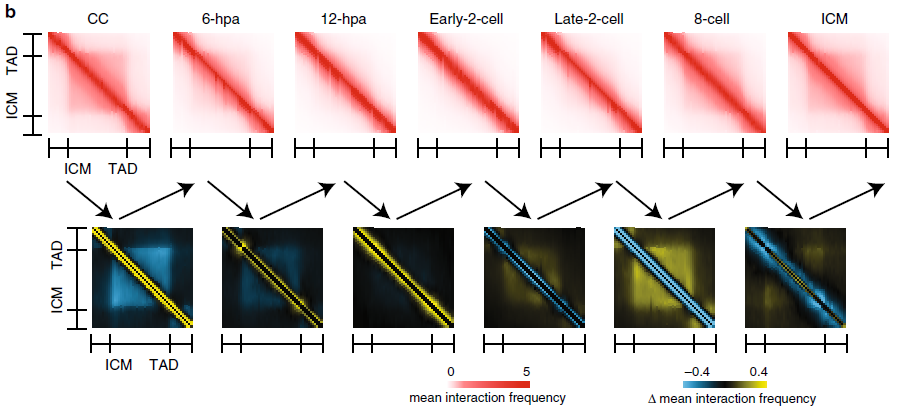
图3b SCNT胚胎发育各个阶段的TAD强弱变化
作者将小鼠SCNT与正常受精胚胎发育Hi-C公共数据集进行分析,发现SCNT胚胎在二细胞期的远距离(>2 Mb)相互作用较正常受精胚胎明显降低。同时,早期(2到8细胞期)正常受精胚胎与SCNT胚胎的Compartments及TADs也存在着明显的差异。
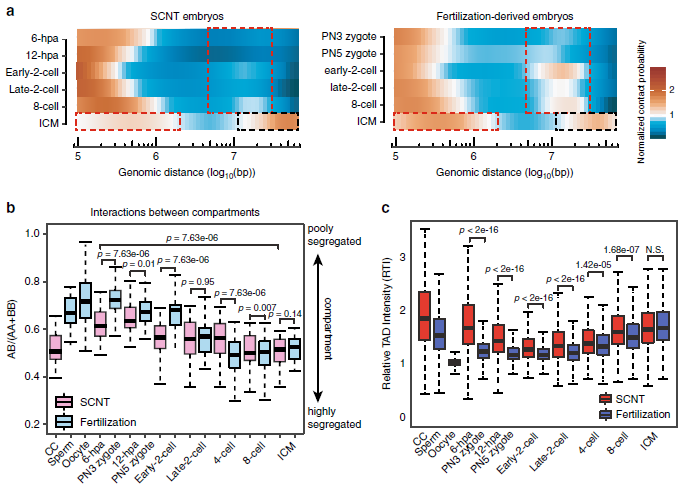
图4 正常胚胎和SCNT胚胎染色质结构重组的差异
研究表明小鼠SCNT胚胎在合子基因组激活(ZGA)时期有大量的基因未能被正常激活。于是,作者探究了染色质空间结构的异常是否会导致增强子与启动子之间的相互作用无法成功建立。在早2细胞胚胎,发现关键基因Zscan4d的启动子与上游的超级增强子的SE-P相互作用在受精卵中很明显,而在SCNT胚胎中则不存(图5)。
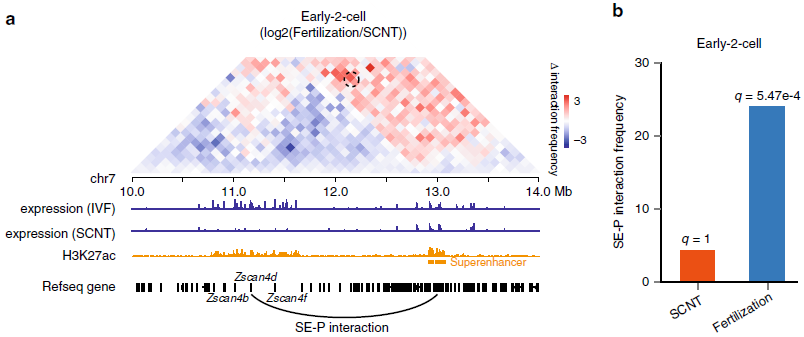
图5 SE-P互作异常影响ZGA相关基因表达
研究证实这是由于供体细胞基因组中持续存在的H3K9me3修饰无法被正常擦除造成的,通过在SCNT胚胎中过量表达甲基化酶Kdm4d来降低H3K9me3修饰水平,SCNT胚胎的染色质空间构象会趋向正常受精胚胎,且Zscan4d的启动子与超级增强子的互作也得到了部分的修复(图6e)。
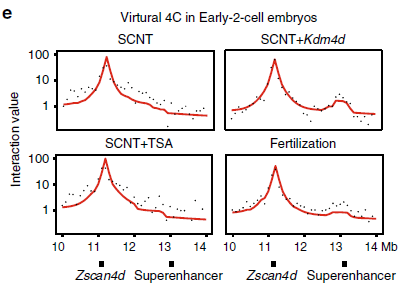
图6e Zscan4d启动子与其相邻区域的相互作用频率
讨论
SCNT胚胎CCs表现为有成熟的Compartments和TADs,注入去核卵母细胞后Compartments和TADs迅速溶解。Compartments和TADs在1-hpi和1-hpa胚胎的有丝分裂和次级减数分裂中期分别缺乏,在早期2细胞胚胎中出现,后期存在,在ICM期成熟。H3K9me3修饰是SCNT胚胎中染色质高级结构重编程的重要障碍,染色质结构的重编程差异导致了对发育至关重要的调控基因的SE-P循环的丢失。
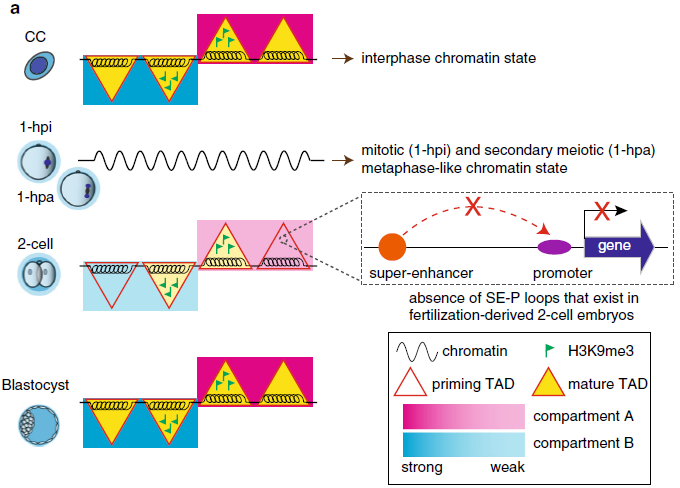
图7 SCNT胚胎发育过程中染色质三维动态结构的原理模型
参考文献
Chen Mo,Zhu Qianshu,Li Chong et al. Chromatin architecture reorganization in murine somatic cell nuclear transfer embryos.[J] .Nat Commun, 2020, 11: 1813.







 京公网安备 11011302003368号
京公网安备 11011302003368号