
本研究使用一组基因敲除的人类胚胎干细胞(ESC)系,利用二代和nanopore三代DNA甲基化测序技术,分析了DNA甲基化转移酶reader和DNA去甲基化酶eraser对DNA甲基化景观的独立和组合影响。比较了14种不同的人ESC品系野生型(WT)和敲除型的全基因组甲基化水平,发现TET酶被集中招募到整个基因组中成千上万的体细胞增强子,但是只要存在DNMT3,TET酶就在多能细胞中保持高度甲基化。TETs在整个基因组中也具有更广泛的活性,需要DNMT3表达来维持稳态甲基化水平。总之,不同类别的酶在基因组局部和整体是竞争关系。
研究背景
哺乳动物基因组通常显示高水平的CpG甲基化,除了大多数CpG密集的启动子区域,以及某些在发育上重要的增强子区域。体细胞DNA甲基化态势总体稳定地传播,而与衰老和疾病相关的全局模式发生了变化。相反,细胞分化过程中CpG甲基化的发育调节通常反映了对转录因子结合的局部重编程。
从头DNA甲基转移酶DNMT3A和DNMT3B负责添加甲基以生成5-甲基胞嘧啶(5mC),而DNMT1则主要用于传播预先建立的DNA复制修饰。相比之下,TET酶(TET1,TET2和TET3)氧化5-甲基胞嘧啶,生成5-羟甲基胞嘧啶(5hmC)或进一步的氧化物,去除甲基基团。从头甲基化和去甲基化对于正常发育都是必不可少的,敲除会导致胚胎或产后早期致死。每种酶似乎发挥特定角色作用,例如,DNMT3B优先募集到卫星重复序列和转录活跃基因;DNMT3A似乎在低甲基化增强子的周围,被称为“峡谷”的延伸的低甲基化结构域和发育平衡的启动子上,TET1和TET2起相反作用以维持低甲基化状态;TET2可能还具有调节转录延伸的功能。
尚无研究直接比较丧失所有去甲基酶和甲基转移酶化对转录和基因组调控以及细胞活性的影响。为了检查去除所有DNA甲基化活性调节蛋白的分子后果,作者生成了在DNMT3A和-3B以及所有3个TET蛋白均缺失的五元敲除( pentuple-knockout,PKO)人类ESC进行相关研究。
研究方法
构建DNMT 2个蛋白和TET 3个蛋白分别敲除或共敲除的人胚胎干细胞系ESC;
二代WGBS:检测CpG甲基化水平以及与WT相比分析差异甲基化区域DMR,鉴定DNMT3A/3B敲除ESC中保守的DMR:c-DKO-DMR;TET敲除ESC中c-DKO-DMR分析;TET敲除后重新过表达TET分析甲基化水平;小鼠ESC相关细胞系检测甲基化分析保守性;
nanopore三代DNA测序分析甲基化和结构变异SV:评估纯合L1Hs元件DNA全长序列甲基化状态;
全基因组氧化亚硫酸氢盐测序(oxBS)分析5hmC甲基化修饰;
ENCODE和其他公开发表chip-seq数据分析组蛋白修饰等染色体分布;其他已发表甲基化数据辅助分析;
DKO细胞RNA-seq 分析c-DKO-DMR与基因表达关系;
hairpin亚硫酸氢盐测序分析是否双链对称甲基化;
研究结果
1.DNMT3缺失时TET驱动基因组全局去甲基化
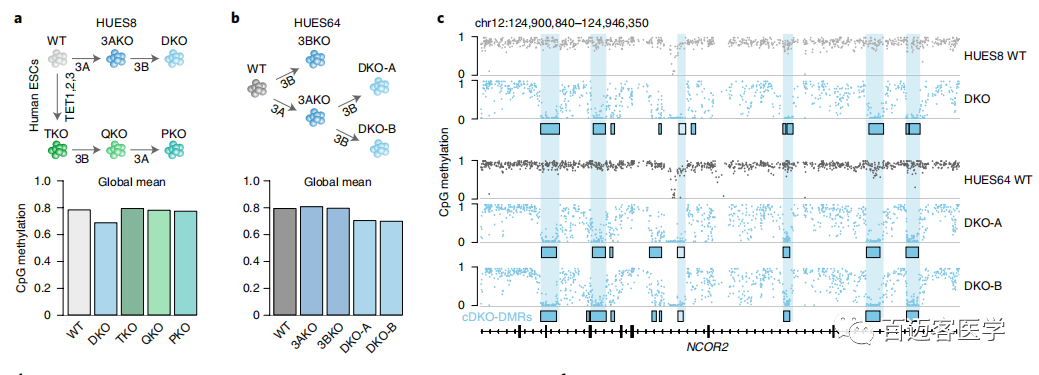
图1上
2.多能细胞中DNMT和TET之间的局部竞争
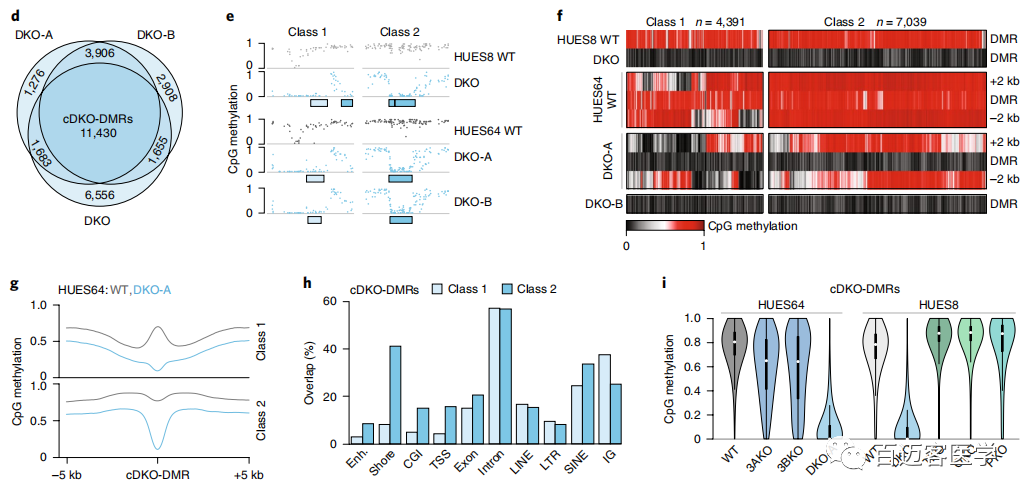
为了进一步研究这种甲基化缺失,接下来从另一个人类ESC系(HUES64)(包括2个独立的DKO克隆(A和B))WT和DKO细胞进行了甲基化测序,并将甲基化水平与先前衍生的18个单DNMT3A-/-(3AKO)和单DNMT3B-/-(3BKO)敲除数据作比较(图1b)。两种不同的雄性WT ESC似乎具有可比性,具有相似的整体甲基化平均值(HUES64,0.79;HUES8,0.78),并且在1kb分辨率上具有较高的相关性(Pearson系数=0.93)。有趣的是,尽管第22代的单DNMT3基因敲除仍保持高度甲基化(3AKO,0.81;3BKO,0.79),但2个HUES64 DKO克隆仅经过3代后甲基化降低至0.70(图1b)。当我们以碱基对的分辨率检查数据时,观察到2个不同的动态类别:0.1-0.2的细微下降,影响了整个基因组范围内约10%的CpG,以及,在CpG岛内局部发生的甲基化几乎完全丧失的CpG位点(图1c)。使用严格的标准(甲基化差异> 0.6,P <0.01,F检验)来定义差异甲基化区域(DMR)。DKO-DMR在3个DKO谱系上都非常一致(图1c,d)。因此,定义了在所有3个样品中均被甲基化的“一致性”的11,430个cDKO-DMR,cDKO-DMR始终保持较低水平(平均WT,0.749;DKO,0.086),平均长度为688个碱基对(bp)。WT ESC中大约三分之一cDKO-DMR邻近低甲基化区域,例如CpG岛和转录起始位点(称为“1类”),而其余的cDKO-DMR则位于其他高度甲基化的区域(内含子或基因间),具有明显的高甲基化边界(称为“第2类”;图1e–h)。几乎所有的cDKO-DMR(93%)都被DNMT3A或-3B甲基化,仅在DKO中被完全去甲基。
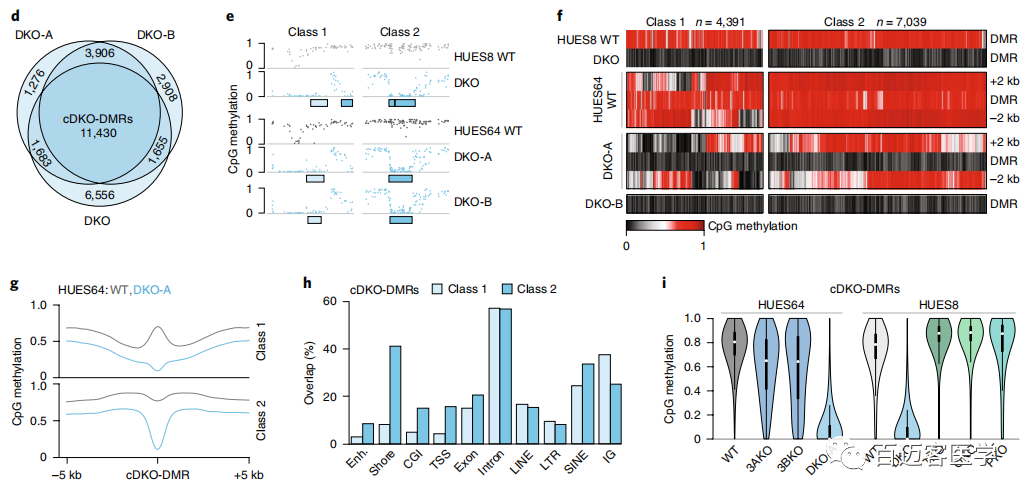
图1下
由于这些结果强烈暗示了一种主动的去甲基化机制,作者研究了在TET敲除的HUES8细胞系(TKO,QKO和PKO)中cDKO-DMR的甲基化水平。在没有TET的情况下,先敲除DNMT3B,然后再敲除DNMT3A,不会导致cDKO-DMR去甲基化(图1i)。即使经过20次传代,PKO细胞中cDKO-DMR甲基化水平也仅微弱下降。此外,在TKO细胞中,许多1类cDKO-DMR周围的区域获得了甲基化,这进一步暗示了局部去甲基化过程中的TET活性。总之,人类多能性细胞中有一些依赖于DNMT3A或-3B的独特且高度甲基化的区域,这些区域在缺少它们的情况下会经历快速的TET介导的去甲基作用。
3.TET在cDKO-DMR处显示持续的活性
为了验证cDKO-DMR是否依赖并持续诱导TET活性,利用PiggyBac转座将外源TET1(短isoform简称TET1s)、TET2和TET3重新引入PKO细胞中,并使用WGBS测量了总体甲基化水平(图2a)。在异位表达每种蛋白质后,PKO细胞的总体平均甲基化水平从第20代的0.73明显降低到了异位表达每种蛋白质后的0.61、0.59和0.54,而仅用转座酶转染的对照细胞保持稳定(平均值=0.70;图2b)。重新引入任何TET酶可在很大程度上恢复TKO细胞中异常高甲基化的区域,诱导快速的cDKO-DMR去甲基化(图2c-e)。从机理的角度来看,TET1s亚型缺乏CXXC结构域,无法募集至未甲基化的CpG密集区域,但TET1和TET2 rescue结果之间无明显差异,支持了CXXC结构域无关的募集机制。TET及其作用相反的酶在cDKO-DMRs上的持续动态也得到了已发表的染色质免疫沉淀的支持,随后进行ChIP-seq,该数据表明WT ESC中DNMT3B和TET1均富集,尽管富集在比相当狭窄且定义明确的cDKO-DMR边界更宽区域。最后,进行了全基因组氧化亚硫酸氢盐测序(oxBS),并在WT细胞中发现了5hmC的显著局部富集(平均cDKO-DMRs,0.07;背景,0.01;图2f)。
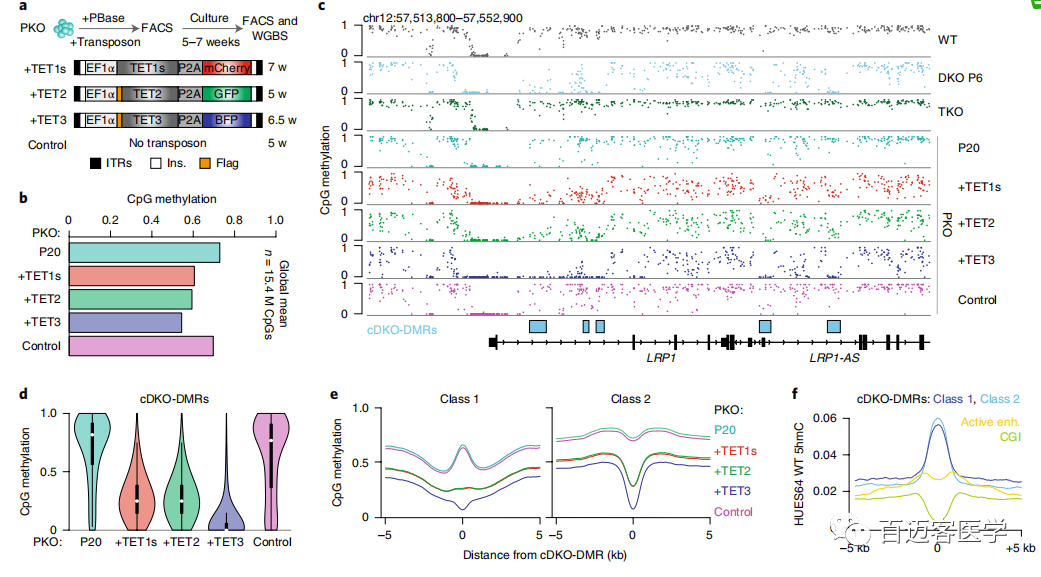
图2
综上所述,这些结果证实,TET酶被持续招募到整个基因组中成千上万个基因座,并且如果不存在DNMT3活性,则可以指导快速、局部去甲基化。
4.进化上年轻的反转录转座子中动态募集DNMT-TET
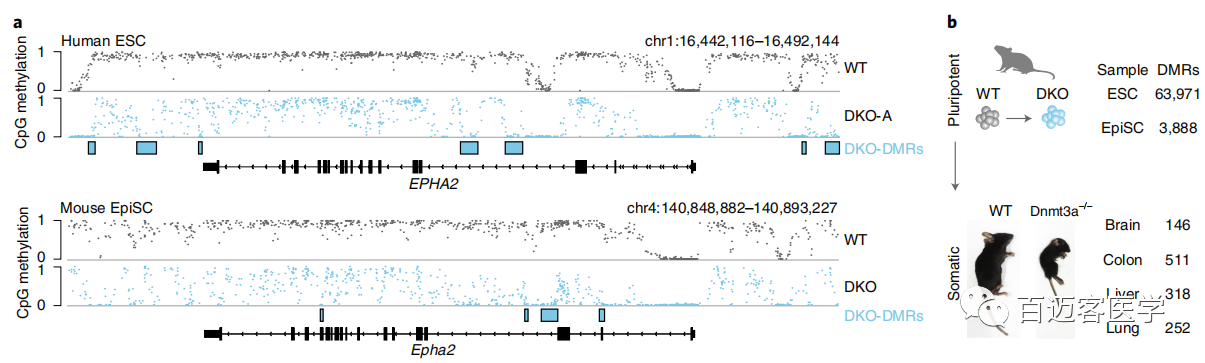
cDKO-DMR改变稳健而√确地改变其甲基化状态方式表明它们可能与调控元件重叠。一个小的子集包括L1Hs或L1PA长散布的核元件(LINEs)的5’非翻译区(UTR),它们充当其功能启动子,DNMT3敲除后通常显示出进化年龄和CpG密度依赖性去甲基(图3a,b)。这些区域在WT ESC中还显示出高于预期的5hmC富集,支持连续的TET募集(图3b)。为了进一步研究,专注于人类特异性的L1Hs元件,并使用牛津纳米孔的MinION平台生成长reads(平均长度=8.9kb),从而能够z确比对和评估HUES64 ESC WT和DKO,以及HUES8 ESC WT,TKO和PKO的LINE特异性甲基化状态。(用nanopolish检测了甲基化以及sniffle软件分析SV,sniffile鉴定到的L1Hs元件有纯合、杂合或缺失,只有纯合且长度至少为6kb的用于后续分析。)在野生型细胞中,7%的L1Hs 5’UTR(每个样品中全长覆盖reads条数为207)已经被低甲基化(图3c)。尽管经常没有通过严格的DMR判断标准,但在DNMT3A和DNMT3B敲除后91%的WT甲基化元件被去甲基(图3c)。去甲基化依赖于TET表达,只有一小部分在PKO细胞中显示丢失(图3c)。根据它们的甲基化动力学划分单个LINE后,无法查明与甲基化状态一致的任何单核苷酸多态性,这表明DNMT/TET募集背后的机制更为复杂。值得注意的是,在DKO ESC中保持甲基化的17个L1Hs 5’UTR具有较低的CpG密度和GC含量,这可能表明较高的CpG密度有利于TET募集和去甲基化。似乎LINE 5’UTR对DNMT3/TET表达高度敏感并且可以快速切换甲基化状态,甲基化状态对于表达DNMT3的多能细胞中的大多数元件都是有利的。
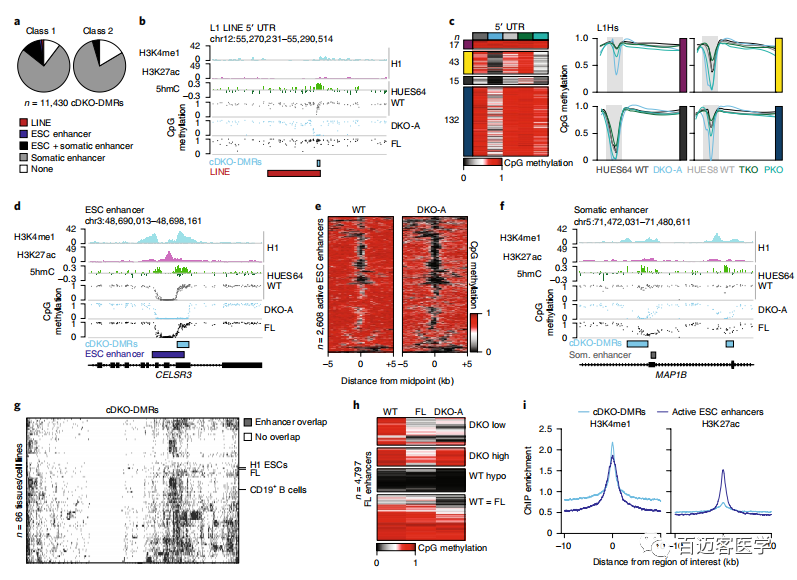
图3
5.体细胞增强子被多能细胞中的DNMT3和TET活性靶向
尽管TET可以募集到LINE 5’UTR,但它们更频繁地定位于启动子或活性增强子,使它们保持低甲基化状态。的确,有7%的cDKO-DMR与低甲基化的活性增强子相邻,支持了先前的证据表明DNMT3s保护了增强子的边界免受扩展的低甲基化作用(图3a,d,e)。考虑到TETs在活性增强子中的典型作用,作者认为也可能代表仅在其他细胞状态被激活时才经历去甲基化的调节元件。令人惊讶的是,有85%的cDKO-DMR与至少一种先前定义的组织特异性增强子重叠,并且在相关的细胞类型中被特异去甲基化(图3a,f,g)。尽管cDKO-DMR几乎总是体细胞增强子,但事实并非如此:许多体细胞增强子已经在ESC中甲基化,在其相关组织中保持高度甲基化,或者尽管在其他发育过程中失去了甲基化,但在ESC中并未显示出TET依赖性去甲基化(图3h)。为了探索DMR的稳定性,进一步传代了HUES64 DKO克隆A细胞并进行了WGBS。在经过28次无DNMT3活性的传代后,鉴定到增加了59,618个DKO-DMR,其中79%与推定的组织特异性增强子重叠。在后期传代的DKO细胞中,约有三分之一的体细胞增强子仍保持甲基化状态。为了检查增强子去甲基化的能力是否与发育时期相关(它们在发育过程中被激活时),利用最近发表的数据集,详细介绍了从HUES64 ESCs到胰岛分化的9个阶段中增强子的激活和甲基化动力学。有趣的是,在分化的每个阶段,相似比例的增强子与DKO-DMR重叠,在末端分化的阶段,其频率略高。尽管是推测性的,与ESC分化之间缺乏明显联系表明,一部分胚胎和成年组织特异性增强子可能以依赖于DNMT3和TET的持续和相反功能的状态存在。
6.ESC中体细胞增强子的DNA甲基化缺失影响基因表达
作者想知道如何将TET募集到这组高度甲基化的体细胞增强子中,以及失去主动DNMT3募集的影响会是什么。cDKO-DMR具有高于背景的CpG密度(3.2%),但这尚未分类,因为大多数具有匹配CpG密度的1-kb区域在DKO细胞中不会丢失甲基化。当在WT ESC中寻找cDKO-DMR与选定的表观遗传特征之间的关联时,发现它们通常更富集在开放染色质和H3K4me1富集区域,而不是H3K27ac富集区域,后者通常与参与转录的“活性”增强子相关(图3i)。尽管经常重叠,但H3K4me1富集仍然不足以预测cDKO-DMR。此外,仅约10%的富含H3K4me1的体细胞增强子也富含H3K27me3,表明不存在经典的“平衡”染色质状态。尽管可以确认这些区域在分化后受到组织特异性转录因子的束缚,但并未发现ESC增强子相关转录因子的富集。然后,将查询扩展到其他ESC表达的转录因子,包括来自WT HUES64 ESCs34的8个ChIP-seq数据集和H1 ESC细胞系ENCODE中63个ChIP-seq数据集。即使在更大的转录因子集上,也未在cDKO-DMR边界内发现任何明显的富集,也未观察到任何已知因子的一致序列基序motif。因此,TET的募集可能取决于上述集合中未包括的转录因子或替代策略,例如通过非编码RNA,或者它可能涉及更复杂的调节机制或相互作用,尚待阐明。
最后,探讨了是否可以将DKO-DMR定位于基因并评估潜在的调控作用。平均而言,cDKO-DMR位于距转录起始位点48 kb处,并且可以通过接近6,594个基因进行分配,这不允许进行有意义的通路或相互作用分析。相反,进行RNA测序(RNA-seq),以识别这些体细胞增强子的甲基化缺失是否影响基因表达。实际上,晚期传代DKO细胞与分化相关的基因显著上调(n=2,455),例如EOMES、SOX17、TGFB2、MSX2、SOX1和SIX1。尽管无法区分是直接作用还是间接作用,但到第6代,这些基因中已有526个已经显示出显著的差异表达。在第28代,与差异表达基因相关的DKO-DMR基本上更接近其基因,另外三分之二的差异表达基因与至少一种DKO-DMR相关。这些趋势还支持了靶向调控元件的去甲基化与基因表达上调之间的潜在联系。
7. cDKO-DMR是保守的,与多能性有关
为了探索这种局部调节的动态甲基化的保守性,在小鼠表皮干细胞(EpiSCs)中突变了Dnmt3a和Dnmt3b,因为它们代表了与人类多能细胞最接近的发育和分子类似物。在第4步对WT和DKO细胞进行了WGBS测序,并鉴定了3888个与人类DKO-DMR具有相似特性的DMR,与82%的推定体细胞增强子重叠。虽然数量、√确序列和坐标未直接在物种之间map,但小鼠DKO-DMR出现在非常相似的位置且与直系同源基因接近(图4a)。因此,在体细胞增强子处甲基化转换的机制和这些区域的调控模式都看起来非常保守。
图4
由于体细胞也表达DNMT和TET,是否DNMT3/TET在体细胞增强子上的相互作用是多能性所独有的,还是在分化后仍能保留?研究了发育各个阶段中缺乏DNMT3活性:这些包括在血清/白血病抑制因子(LIF)中培养的小鼠ESC,它比EpiSC代表更幼稚的多能状态。在大多数体细胞不表达具有催化活性的DNMT3B的前提下,还检查了纯合Dnmt3a-/-小鼠的组织,因此DNMT3A的丢失将产生缺乏从头甲基转移酶活性的“ DKO样”细胞(图4b)。然后,在第4代对WT和DKO ESC以及8天龄WT和Dnmt3a-/-小鼠的脑、结肠、肝和肺组织进行了WGBS(图4b)。与EpiSCs相比,ESC的DKO-DMR多了10倍(n=63,971),而在组织中(大脑,146;结肠,511;肝脏,318;肺,252;)减少了十倍。因此,cDKO-DMR的动态调节似乎仅限于多能细胞状态,随着发育的进行,TET靶向基因座的数量大大减少。在每种情况下,73-82%的DMR与先前定义的小鼠组织特异性增强子重叠。体细胞Dnmt3a KO DMR优先偏爱位于CpG岛和shores附近的1类亚组,这表明在这种情况下,TET在很大程度上起到了保护未甲基化区域边界的作用。
为了补充小鼠数据,重新分析了从HUES64 WT和DNMT3A KO人类ESC分化为有丝分裂后运动神经元的WGBS数据,在该系统中,细胞在第2天失去DNMT3B的蛋白质表达,从而在存活的3AKO细胞中产生DKO样状态。细胞在约12天内没有DNMT3活性,即便连续不断地表达TET1-3但是cTKO-DMR仍保持高度甲基化,这进一步暗示了参与该过程的关键因素可能仅以多能状态表达。
8.TET酶也在整个基因组中广泛地去甲基化
在确定DNMT和TET以多能性特异性方式调节一部分体细胞增强子元件后,在DKO和PKO品系中观察到全基因组逐渐去甲基化。为避免将总体测量结果与上述目标DNMT3或TET活性混淆,排除了任何一对样品之间鉴定出的所有低严格DMR(n=238,497)。作为所有体细胞增强子区域。值得注意的是,在存在或不存在TET的情况下,DNMT3的丢失仍然导致每次传代的总体平均甲基化降低分别为0.0028和0.0037(图5a)。随后,估计每个细胞周期DNA甲基化模式的保真度为99.75和99.64(估计每传代6天和每传代4天,DKO和PKO细胞的群体倍增时间,细胞在培养条件下生长时其数目倍增所需的时间,分别为28.8h和24h)。
异染色质内的甲基化缺失被认为是由于低DNMT1保真度和有丝分裂所致。为了支持该模型,观察到了仅表达DNMT1的PKO细胞在异染色质区域内甲基化的优先缺失。相反,DKO细胞在常染色质中表现出优先的甲基化缺失,这暗示着来自全基因组TET活性的其他贡献(图5b)。低5hmC信号分布在整个WT ESC的基因组中,包括在惰性的基因间区,其在常染色质中的含量较高(图5b,c)。因此,当没有从头甲基化的DNMT时,甲基化在WT 5hmC高的区域中减少*多(图5d,e)。
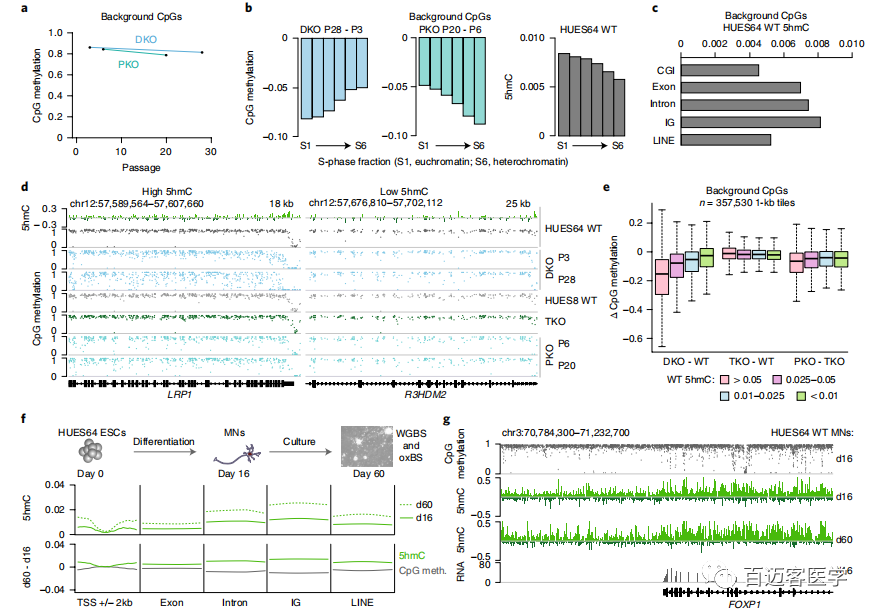
图5
将WT HUES64 ESC分化为有丝分裂后的运动神经元,其中5hmC不能通过分裂被动稀释,以更具体地跟踪TET的参与度和催化活性。培养60天后,基因(特别是表达的基因)和基因间基因座内富集了5hmC水平,其中*大的增加发生在惰性染色质内,支持了TET的广泛氧化(图5f,g)。因此,TET通过运动神经元以及ESC的基因组保持了广泛氧化甲基胞嘧啶的能力。
通常,如果不被DNMT3A或DNMT3B抵消,这种活性将导致胞嘧啶修饰的连续转换和整体甲基化的降低。在这种范式下,人们可能会期望ESC在TET丢失后显示出整体甲基化增加,因为这将使平衡向DNMT3活性转移。与期望相反,并且如先前在癌细胞中所指出的,与匹配的WT相比,在缺乏TET的细胞中也观察到了轻微的下降。与WT相比,这可能与TKO细胞的生长速率增加有关,这也可能影响甲基化维持。
为了解DNMT和TET的竞争活性是否有助于甲基化异质性,如先前怀疑的富含H3K4me1的增强子区,进行了hairpin亚硫酸氢盐测序,以测量同一分子CpG二聚体上对称的胞嘧啶甲基化。在没有从头DNMT和TET的情况下,发现了较少的半甲基化二倍体(PKO中为4.48%,WT细胞中为8.89%),这表明DNMT和TET共同作用以在单个基因座上产生表观遗传变异。(在哺乳动物中,DNA甲基化通常以对称的方式出现在CpG核苷酸中,即如果一个CpG上的一个胞嘧啶(C)出现甲基化,那么其互补链上的相应胞嘧啶(C)也会被甲基化)。全基因组TET活性的随机性似乎会在细胞群体内产生甲基化异质性。






 京公网安备 11011302003368号
京公网安备 11011302003368号