英文题目:Deregulated lncRNA expression profile in the mouse lung adenocarcinomas with KRAS‐G12D mutation and P53 knockout
中文题目:KRAS-G12D突变和P53敲除小鼠肺腺癌lncRNA表达
发表期刊:J Cell Mol Med
影响因子:IF=4.658
合作单位:复旦大学医学院
研究背景
非小细胞肺癌(NSCLC)是最常见的肺癌类型,包括腺癌、鳞癌和大细胞癌。腺癌是最常见的非小细胞肺癌类型,目前约占所有肺癌病例的40%。近年来发现了非小细胞肺癌(NSCLC)的基因改变,KRAS、EGFR和ALK是肿瘤基因组驱动因子的最常见癌基因。此外,在约50%的人类癌症中,P53肿瘤抑制基因发生突变或缺失。野生型(WT)P53通过调节参与细胞周期、凋亡、干细胞分化、衰老、DNA修复和代谢的基因的表达,帮助维持基因组的完整性和细胞内稳态。
长链非编码RNA(Long Non-Coding RNAs,lncRNAs)是一种长度超过200个核苷酸的转录RNA分子,在细胞核或细胞质中不能翻译成蛋白质。研究表明,lncRNAs在表观遗传调控、细胞周期调控、细胞分化调控等生命活动中发挥重要作用,并在多种肿瘤中异常表达。lncRNAs的异常表达可作为肿瘤的促进剂或抑制剂。研究表明,lncRNAs通过改变多条信号通路在肺癌的发生发展中发挥重要作用,目前已鉴定出一些与肺癌相关的lncRNAs,如H19、MALAT、MIR31HG、HOTAIR、DGCR5、 AFAP1-AS、SNHG1和RMRP。然而,对其他肺癌相关lncRNAs的鉴定仍有待研究。
研究方法
样本选择:LSL-Kras-G12D C57小鼠、Kras-G12D小鼠和P53敲除小鼠。(用表达Cre重组酶的慢病毒颗粒鼻腔滴注8周龄小鼠进而诱发肺腺癌。肿瘤开始6周后,收集肺腺癌样本和相应的正常肺样本。病毒感染后第6天,获得NONMMUT015812-基因敲除的KP细胞(shRNA-2)和阴性对细胞(sh-Scr)。
测序技术:转录组测序和微阵列芯片。
研究结果
1.KRAS-G12D突变和p53基因敲除小鼠肺腺癌中LncRNA的表达
使用芯片技术检测lncRNA,差异表达lncRNAs的散点图和聚类图显示了肺腺癌和正常肺样本之间有明显区别(图A、B)。重点研究了在人和鼠之间具有较高差异倍数且保守的lncRNAs,当FC>8,P<0.05时,鉴定到729个lncRNA。根据染色体位置保守性和序列保守性,筛选出210个具有潜在人类同源物的lncRNA用于后续验证,其中129个上调,81个下调(图C、D)。根据其基因组位置,将210个lncRNA分为u(基因间)、i(内含子)、x(反义)和o(正义重叠)四大类。已鉴定的lncRNAs大部分属于i类,有101个(48.09%)(图E)。
2.与p53、Kras及缺氧相关的lncRNAs分析
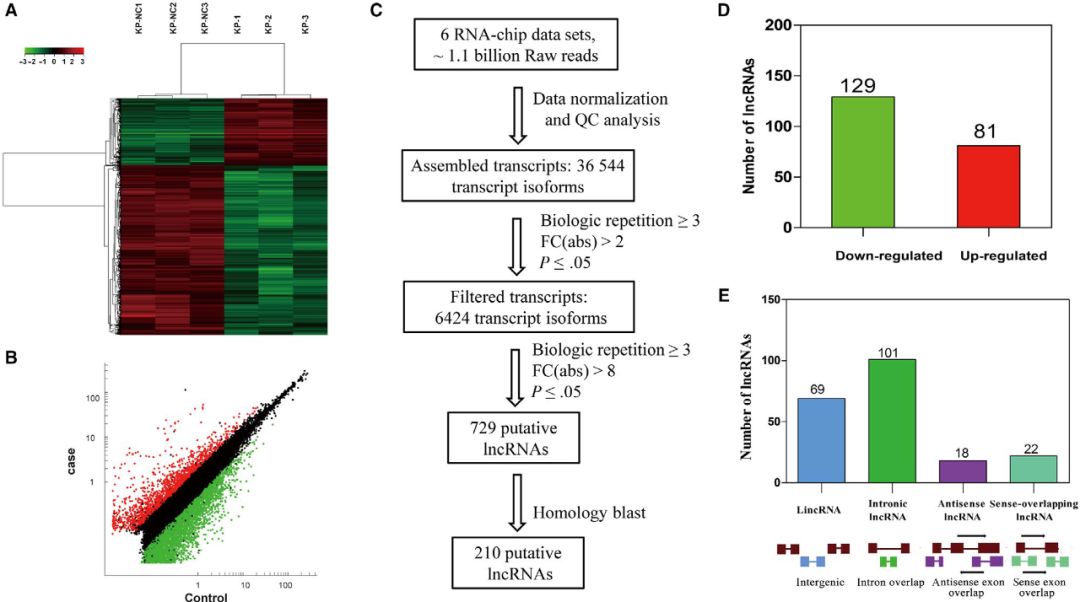
p53是临床肺癌中最常见的突变抑癌基因,在我们的肺腺癌小鼠模型和KP细胞中均被诱导完全敲除。因此,作者探索了所选择的210个保守的lncRNAs的非调控表达是否与p53的缺失有关。携带p53基因的慢病毒颗粒可在KP细胞中重新表达p53。如下图A所示,p53在稳定感染的KP细胞中有效地重新表达。qPCR结果显示,p53再表达显著改变了11个lncRNAs的表达(FC≥1.5),且差异倍数与上述p53缺失的肺腺癌组织芯片数据相反(图B),表明p53的再表达对LncRNAs的表达有显著影响。
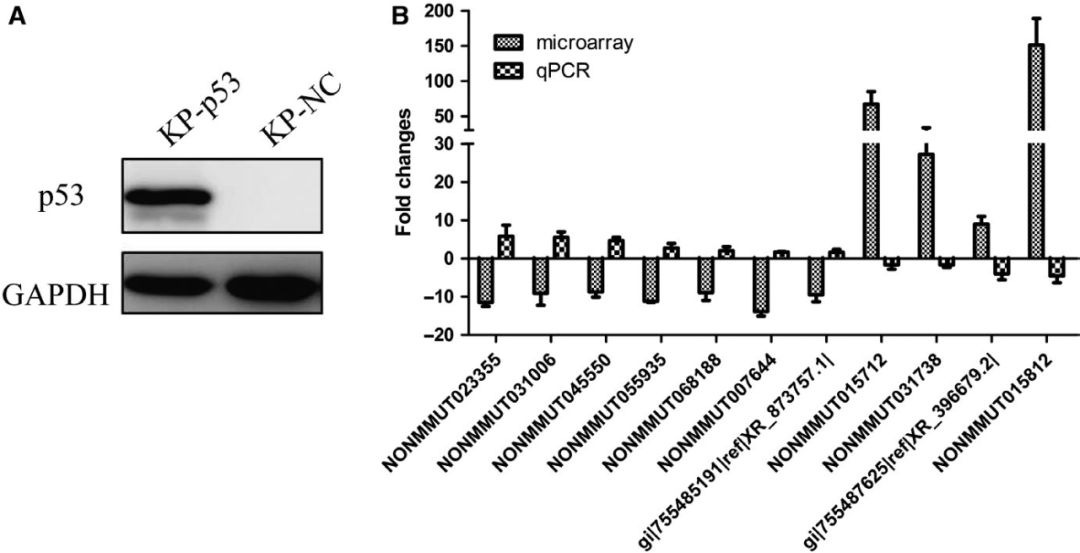
Kras在肺腺癌小鼠模型和KP细胞中被激活,为了确定与Kras基因相关的lncRNAs的表达量,利用Crispr/Cas9敲除其在KP细胞中的表达。qPCR结果显示,Kras基因缺失改变了33个lncRNAs的表达(FC≥1.5),且差异倍数与Kras被激活的肺腺癌组织芯片数据相反(图B)。
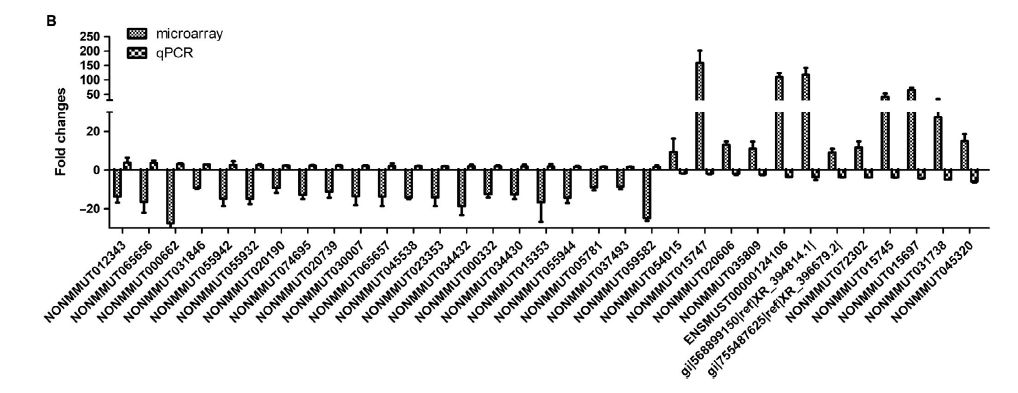
缺氧是实体肿瘤的一个显著特征,低氧肿瘤通常对传统的癌症治疗有抵抗力,且肿瘤低氧与晚期恶性肿瘤和转移相关。作者进一步研究了低氧调节的潜在的lncRNAs。将KP细胞在常氧(20% O2)和缺氧(1% O2)中培养48h,WB结果显示缺氧可有效上调KP细胞HIF1α的表达(图A)。RT-PCR结果显示,缺氧诱导的KP细胞中有13个lncRNAs表达下调,4个lncRNAs在缺氧诱导下表达上调,其表达变化方向与小鼠肺腺癌组织芯片中的表达变化方向一致(图B)。
芯片筛选出的210个LncRNAs中,有52个LncRNAs的表达变化与p53、Kras或缺氧有关。其中,2个受p53调控的lncRNAs也受Kras调控,2个受KRAS调控的lncRNAs和1个受p53调控的lncRNA在缺氧条件下也可以被调控(图A)。选择19个FC>3.5的lncRNAs,采用定量RT-PCR方法进一步验证其在6例肺腺癌组织和6例正常肺组织中的表达。定量RT-PCR结果显示,19个lncRNAs的表达与微阵列结果一致(图B)。构建与上述19个lncRNAs相关的lncRNA-lncRNA共表达网络(LLCN)。网络图显示,在19个lncRNAs中,有6个lncRNAs与其他lncRNAs无显著共表达,有13个lncRNAs与其他lncRNAs显著共表达(图C)。
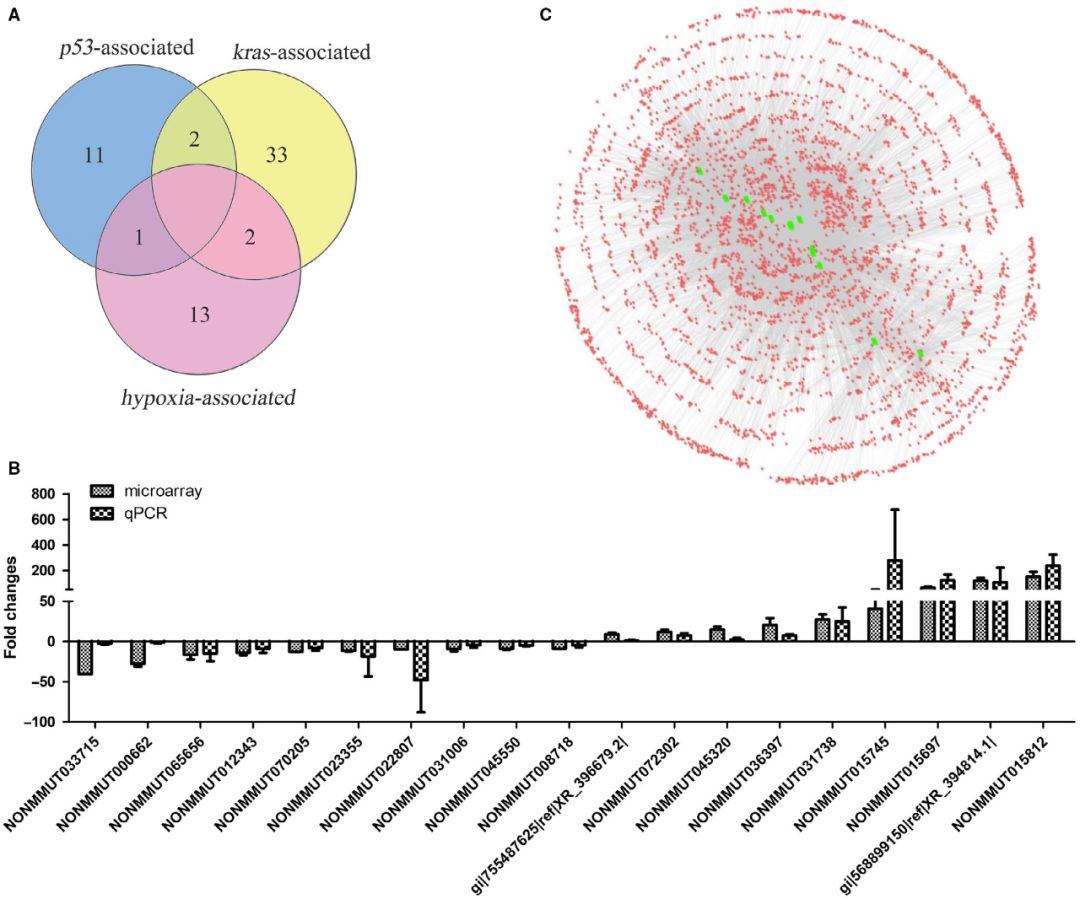
3.NONMMUT015812基因敲除对KP细胞增殖和迁移的抑制作用
在已鉴定的lncRNAs中,NONMMUT015812非常有趣。(a)其在小鼠肺腺癌组织中的表达增加约150-187倍。(b)其表达与p53呈负相关。(c) NONMMUT015812基因位于反转录转座子样蛋白1基因和甲状腺素5-脱碘酶基因之间的染色体上,其中包含几个在人和小鼠中表达差异的lncRNAs。
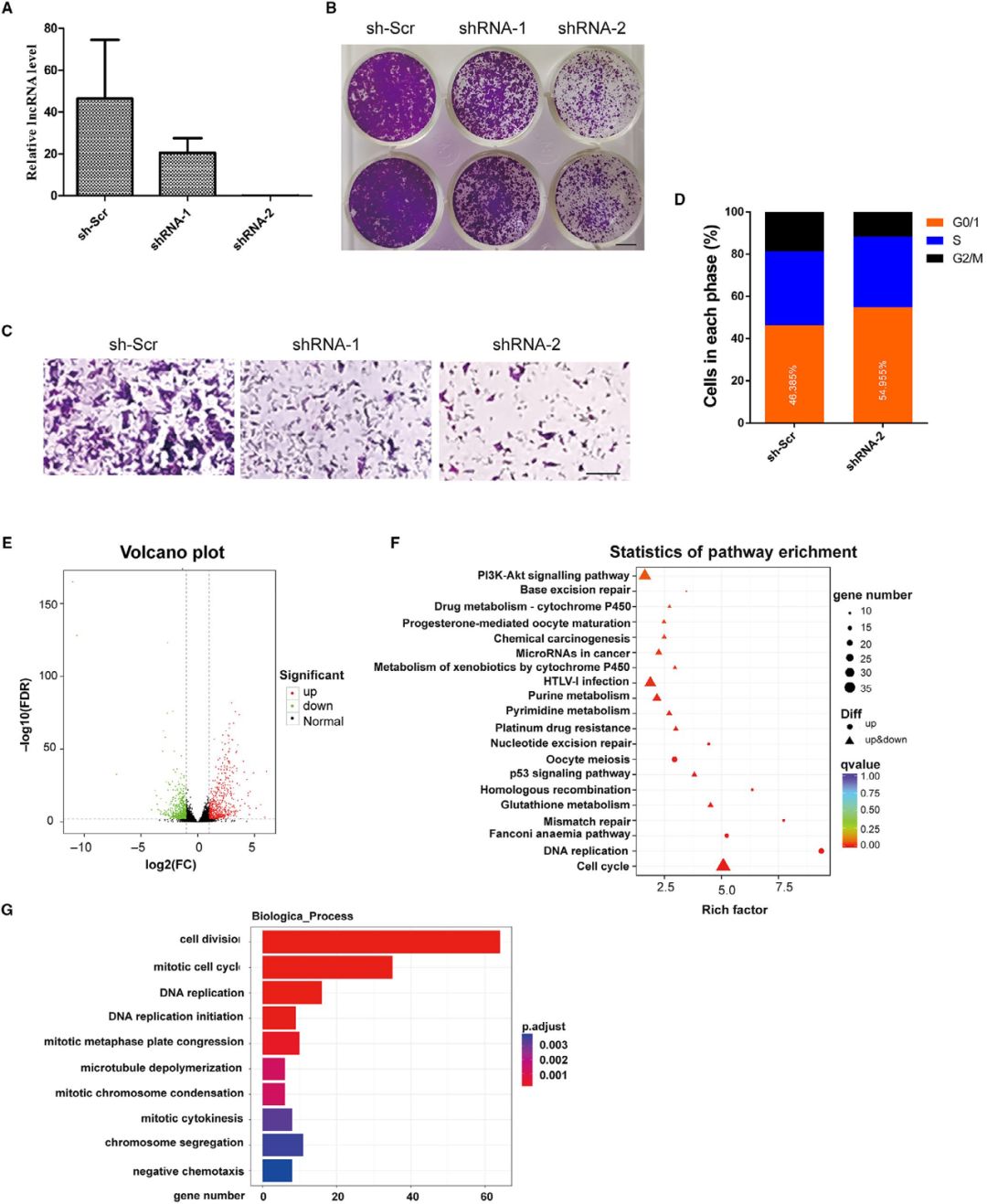
通过设计慢病毒介导的shRNAs来下调NONMMUT015812的表达,qPCR结果显示其可使KP细胞中NONMMUT015812的表达减少80%以上(图A)。克隆形成实验显示,NONMMUT015812基因的敲除显著抑制了KP细胞的生长(图B)。此外,在Transwell实验中,稳定的NONMMUT015812基因敲除的KP细胞与对照细胞相比迁移明显减少(图C)。流式细胞术分析表明,NONMMUT015812基因敲除导致KP细胞明显阻滞于G0/G1期,G2/M期细胞数量减少(图D)。而NONMMUT015812基因敲除对细胞凋亡无明显影响。
RNA-seq检测NONMMUT015812基因敲除细胞基因表达的变化。与阴性对照相比,共鉴定出1281个差异表达基因。在这些基因中,610个基因表达上调,671个基因表达下调(图E)。KEGG通路分析表明,NONMMUT015812的下调影响了几个与细胞生长相关的通路,包括细胞周期、DNA复制和PI3K/Akt信号通路(图F)。有趣的是,KEGG通路的富集还包括p53信号通路和几条DNA修复通路,这意味着NONMMUT015812可能是p53通路的重要下游调节因子。与流式细胞仪分析结果一致,未发现凋亡信号通路。GO分析还表明,许多差异表达基因主要集中在细胞分裂、有丝分裂细胞周期和DNA复制过程中。
小结
本文研究了p53基因敲除和Kras-G12D突变的小鼠肺腺癌中lncRNAs的异常表达。结果显示,210个lncRNAs(FC≥8)中,原代KP细胞中分别有11个受p53调控,33个受KRAS调控,13个受缺氧调控。在小鼠肺腺癌中显著上调、受p53再表达负调控的NONMMUT015812,分析其细胞功能,结果表明,shRNAs敲除NONMMUT015812可降低KP细胞的增殖和迁移能力。在小鼠肺腺癌中异常表达的lncRNAs中,NONMMUT015812是一个潜在的促肿瘤基因。然而,已鉴定的lncRNAs在肿瘤发生中的功能和分子机制及其在人肺癌组织中的表达有待进一步研究。
文献原文下载:
https://international.biocloud.net/zh/article/detail/31410985







 京公网安备 11011302003368号
京公网安备 11011302003368号