6月新鲜出炉的公司合作文章中浙江大学医学院的研究者借助转录组测序技术,探究了Tfr1基因对棕色/米色脂肪组织产热能力和组织分化方面的功能,为肥胖与代谢疾病的治疗策略提供了新方向。
文章思路快速get
本文首先从3个组学( RNA-seq、Chip-seq、蛋白组)的数据着手,从不同层面找到变化较大的基因,找到关键的候选基因。再通过构建候选基因敲出小鼠模型,从表型、组织、mRNA、蛋白到机制,层层递进,逐步由浅到深解析。
基因对米色脂肪细胞分化、产热的影响。对后续棕色和米色脂肪细胞的分化、调控糖脂代谢功能,以及肥胖与代谢疾病的提供了重要的依据。
研究背景
人体内存在着白色脂肪组织(white adipose tis sue,WAT)、棕 色 脂 肪 组 织(brown adipose tissue, BAT)和米色脂肪组织。WAT具有储能的作用,过量积聚可导致肥胖;棕色脂肪为产热脂肪。米色脂肪是白色脂肪组织在寒冷、运动、药物等作用下发生“棕色化”形成。米色脂肪具有不同于白色脂肪和棕色脂肪的形态和功能,具有增加机体产热、促进能量消耗,抑制肥胖形成的发等作用。因此近几年来促进米色脂肪生成成为肥胖症等代谢疾病治疗的研究热点。
技术平台
RNA-seq、Chip-seq、蛋白组
研究材料及思路
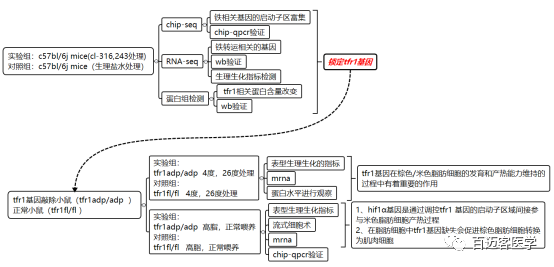
研究结果
1. 多组学锁定研究目标-Tfr1基因
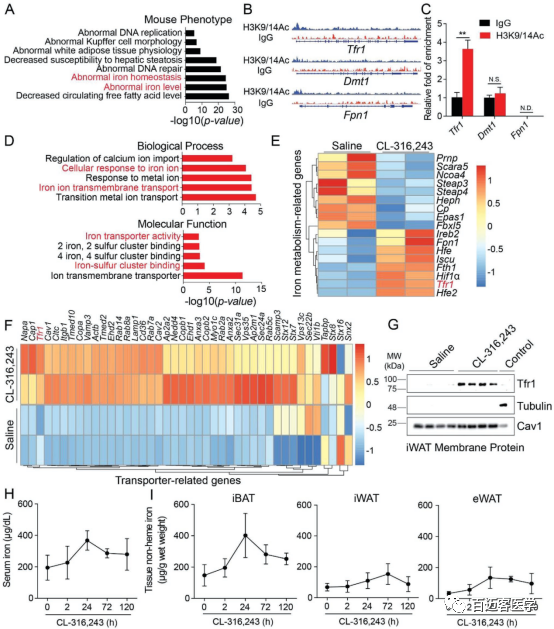
Fig 1 在CL-316,243处理的小鼠中Tfr1基因对铁稳态起着至关重要的作用
本研究首先利用Chip-seq (Fig 1A/B)、RNA-seq(Fig 1D/E)、蛋白组三种技术手段,从转录调控、mRNA、蛋白质三个不同层面发现在实验组(C57BL/6J mice)中与铁转运相关的启动子 、基因、蛋白均有明显的富集。为了验证结果的准确性,对与铁转运相关的启动子进行用Chip-qPCR(Fig 1C)的方法验证,对铁转运相关的蛋白做了WB验证(Fig 1G),结果都显示Tfr1基因在实验组(C57BL/6J mice)中的表达量明显增加。综上所述,Tfr1基因在CL-316,243处理的小鼠中Tfr1基因对铁稳态起着至关重要的作用。
2. Tfr1基因在米色脂肪组织和棕色脂肪组织的形成和产热能力方面有重要作用
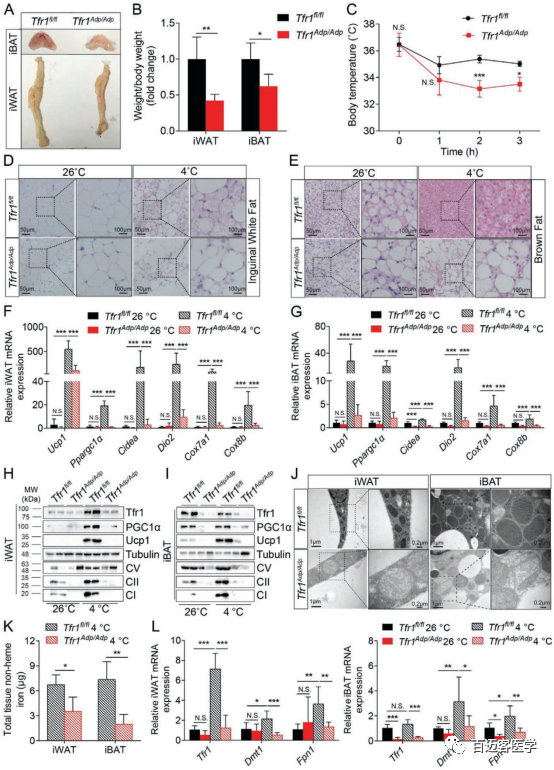
Fig2 Tfr1基因缺失可减少冷诱导的脂肪组织产热
为了探究Tfr1基因在脂肪细胞的中有哪些作用,本研究构建了Tfr1 敲除小鼠(Tfr1Adp/Adp )和Tfr1 野生小鼠( Tfr1fl/fl )。对Tfr1Adp/Adp和Tfr1fl/fl的表型生理生化的指标、mRNA、蛋白水平进行观察,发现相对于对照组来说Tfr1Adp/Adp 小鼠虽然在整体体重上没有改变,但是其白色脂肪组织和棕色脂肪组织的重量明显降低(Fig2 A/B)。经过冷处理后对照组能很快维持温度恒定(Fig2 C),形成更小的小脂滴(多房脂质),但是实验组维持温度的能力明显降低,也不能形成更小的小脂滴(多房脂质)。在mRNA水平和蛋白水平,冷处理的实验组中产热相关基因、脂肪分解相关蛋白改变的程度都没有对照组中明显。这些现象表明Tfr1基因在棕色/米色脂肪细胞的发育和产热能力维持的过程中有着重要的作用。
3. Tfr1基因在米色脂肪组织的产热方面的机制
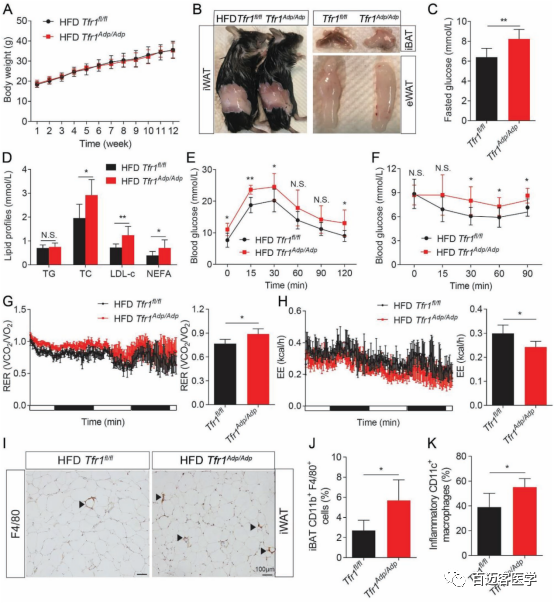
Fig3 Tfr1基因对血脂稳定、胰岛素敏感性、局部炎症的影响
为了进一步探究Tfr1基因在棕色/米色脂肪细胞的发育和产热能力维持的过程的作用机制。分别对Tfr1Adp/Adp和Tfr1fl/fl 进行高脂肪、正常喂养,并对4组样本分别进行葡萄糖耐量、胰岛素抵抗、呼吸速率、能量消耗、CD11b+F4/80巨噬细胞、CD11c+巨噬细胞的比例等实验。数据表明在高脂肪处理实验组 中,整体体重(Fig3 A)、白色脂肪组织(Fig3 B)大小都没有明显的差异。然而在高脂实验组中棕色脂肪组织完全转化为白色脂肪组织(Fig3 B)。同时小鼠空腹血糖、血脂、非酯化脂肪酸脂肪酸的含量明显高于高脂对照组。高脂喂养后,尽管血液中血糖含量没有太大的变化,但是验组中葡萄糖耐量、胰岛素抵抗的值都要高于高脂对照组(Fig3E/F)。这说明高脂实验组中糖耐受性受损可能是导致空腹血糖升高的原因。而呼吸速率、能量消耗的实验表明缺失Tfr1基因后呼吸速率会增加,能量消耗能力降低(Fig3G/H)。在正常喂养的实验组中白色脂肪组织相对于正常对照组来说明显减少。 上述数据表明,能量消耗降低并没有导致高脂喂养实验组小鼠体重增加,可能是由于Tfr1缺失对白色脂肪细胞的内在的影响。
通过免疫组化和流式细胞术实验发现在高脂喂养的实验组中巨噬细胞的数量在白色脂肪组织和棕色脂肪组织中都有增加,棕色脂肪组织中CD11c+ 巨噬细胞的数量要高于高脂对照组(Fig3J/K),同时棕色组织中也产热相关的基因也发生较大的变化。透射电镜的结果显示高脂喂养的实验组中线粒体会更小,颜色更深。这些结果均表明Tfr1 基因在脂肪细胞能量消耗扮演很重要的角色。
为了进一步挖掘Tfr1 基因作用的机制,对转录组数据再次进行挖掘。在基因富集分析(GSEA)中发现与低氧相关的基因具有明显的差异, Hif1α基因与同家族的其他基因在表达趋势以及表达量上都有明显的差异。在冷处理后,Hif1α蛋白和Tfr1蛋白的表达量都有上升。通过免疫荧光的结果显示Hif1α位于细胞核内。构建了Hif1α基因敲除小鼠,并对冷处理下Hif1α基因表达量、蛋白水平、组织形态等结果进行分析,发现Hif1α基因并非米色脂肪细胞产热必要的基因。HIF1α ChIP-qPCR实验发现Hif1α基因是通过调控Tfr1 基因的启动子区域间接参与米色脂肪细胞产热过程。
4. 在脂肪细胞中Tfr1基因缺失会促进棕色脂肪细胞转换为肌肉细胞
对Tfr1Adp/Adp和Tfr1fl/fl 进行转录组测序分析,发现在基因敲除小鼠中,棕色脂肪组织标志性的基因明显下降,白色脂肪组织标志性基因明显上升。但Lep基因却例外,只有在冷处理后的实验组中,表达量上升。基因富集分析表明,有部分肌肉细胞的标志性基因、干细胞标志性基因、及肌源性标志性基因均有上调,而与氧化磷酸化、脂肪生成和脂肪酸代谢相关的基因却明显下调。免疫共沉淀的结果也显示脂肪相关的蛋白含量降低,而肌纤维标志蛋白含量明显增加。上述结果表明,在脂肪细胞中Tfr1基因缺失会促进棕色脂肪细胞转换为肌肉细胞。
5. 总结
运用多组学的技术综合研究发现Tfr1为米色脂肪细胞生热调控重要的候选基因。研究表明当小鼠米色脂肪细胞缺乏Tfr1会破坏产热,胰岛素抗性增加、同时伴有铁缺乏性慢性炎症和线粒体功能障碍。米色脂肪细胞冷处理可以维持HIF1a的稳定,激活Tfr1基因,Hif1α基因可以减少产热基因的表达,却不改变米脂细胞体内核心的温度。值得注意的是,Tfr1在肩胛间棕色脂组织(iBAT)缺失会导致棕色前体脂肪细转换为向白色脂肪细胞和肌肉细胞。相反,在tfr1缺失个体中,如饮食中长期缺乏铁则不能转化出现上述的转化。此外,如果Tmprss6缺失也会小鼠腹股沟白色脂肪组织和肩胛间棕色脂组织两个部位铁缺乏。同时会激发低温诱导型米色脂肪细胞形成和棕色脂肪产热。综上所述,这些发现表明不管是在依赖铁离子或是不依赖铁离子的产热过程中Tfr1都起着重要的作用。








 京公网安备 11011302003368号
京公网安备 11011302003368号