研究背景
La相关蛋白(La-related proteins,LARP)是与癌症相关的RNA结合蛋白(由LARP 1、1B、3、4A、4B、6和7组成)的进化保守家族。LARP1具有致癌性,且肿瘤组织较高水平的LARP1蛋白与卵巢癌、大肠癌和前列腺癌的不良预后相关。LARP1 包含两个 RNA 结合域,一个保守的La module,由La domain 和一个临近的RNA 识别基序 (RNA recognition motif,RRM) 组成的RNA结合域,和一个C端“ DM15结构域”。LARP1与poly-A结合蛋白(poly-A binding protein,PABP)形成复合物,与超过3000个mRNA结合,包括5ʹTOP-motif转录本,已知此类转录本可编码核糖体机器。据估计,人类基因组仅包含19,000–21,000个蛋白质编码基因,但合成了70,000多种蛋白质,这可以通过pre-mRNA的选择性剪接/可变剪接加工产生多个成熟的mRNA转录产本来解释。因此,每个基因具有编码多种蛋白质同工型(isoform)的潜力,这种机制增加了蛋白质组的复杂性。然而,基因通常仅主要表达一种蛋白质,表明加工并释放到细胞质中的mRNA经过选择或“审查”过程。
使用LARP1各个区域的抗体进行的蛋白质印迹WB实验产生了大约150/130kDa的双链带,这被解释为代表了2种LARP1亚型。为了探索这一点,作者系统地进行了一系列计算机、转录组、生化和细胞分析,以阐明LARP1在癌症和正常细胞中的真实表达情况。
技术方法
1、公共polyA方式建库转录组数据集分析LARP1 isoform表达谱:测序数据特异比对到长LARP1同工型的外显子1,没有reads比对到SI-LARP1的外显子1;
2、Nanopore全长转录组测序(RNA-direct)绘制LARP家族基因isoform landscape:2种细胞系,人HEK-293 T和OVCAR-8;每个样本约1.7-2Mb 长reads,约2G数据量;LARP3表达最高,LI-LARP1被鉴定为主要表达的LARP1亚型;
3、特异性引物扩增及sanger测序验证SI-LARP1和LI-LARP1 isoform表达情况:501-MEL(黑色素瘤细胞系)和OVCAR-8细胞中只表达LI-LARP1;
4、NCI-60几种癌细胞系随机引物及oligo dT反转录qPCR验证SI-LARP1和LI-LARP1 isoform表达:长LARP1 isoform(LI-LARP1)在广泛的癌症和正常细胞中是主要表达的形式,而SI-LARP1 mRNA(如果表达的话)以低水平和不成熟的形式存在。
5、isoform特异性多肽检测:凝胶迁移实验观察2种isoform与内源性LARP1迁移模式;体外过表达及pull down实验鉴定2种isoform特异性多肽;免疫沉淀-质谱分析内源性LARP1中2种isoform特异性多肽占比;
6、短isoform表达抑制的调控机制分析:公共数据库中DNA甲基化数据以及H3K27ac chip-seq数据分析可能的表观调控机制;DNA甲基化酶抑制剂5-氮胞苷处理检测SI-LARP1 mRNA和蛋白表达;siRNA特异性敲除2种isoform分析各自表达改变对于细胞活性和凋亡的影响;pull down实验分析与PABP(poly A结合蛋白)的结合互作;TSS区保守性分析2种isoform可能的功能差异;
研究结果
1、LARP1在癌细胞中的isoform landscape
图1A为NCBI基因数据库中列出的9种不同的LARP1经验证的isoform。LARP1典型转录本为NM_015315.5,编码1019个氨基酸(NP_056130.2)的蛋白质,在此处称为“ SI-LARP1”。UniProtKB数据库引用了另一个比较长的转录本NM_033551.3作为LARP1的规范形式,它对应于1096个氨基酸蛋白(NP_291029.2),在此称为“LI-LARP1” 。SI-LARP1蛋白与LI-LARP1不同,它缺少前77个氨基酸,并且氨基酸M1至N67不同。
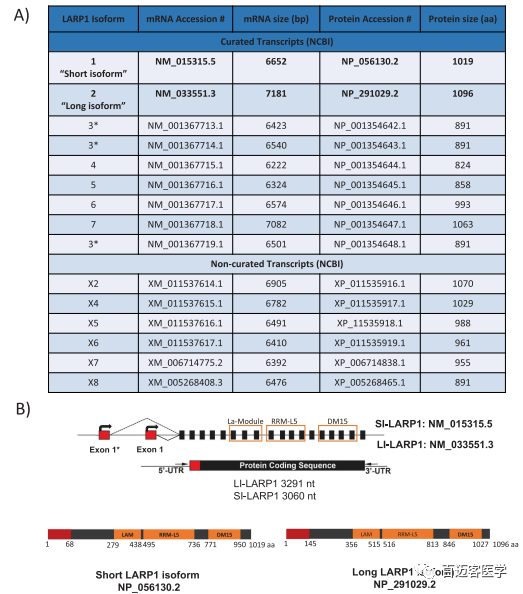
图1
二代短reads polyA转录组公共数据分析:为了研究LARP1在细胞中的表达谱,作者使用了可公开获得的RNA测序数据集。共计从198个组织、128个细胞系和54个原代细胞系中提取了371个包含poly-(A)的RNA测序数据集,并将其reads与包含所有预测的LARP1 isoform的hg38:Chr5 154700000至154850000染色体区域比对(图2A)。首先关注测序reads与第一个外显子的比对,两个LARP1亚型不同的区域。发现测序数据特异比对到长LARP1同工型的外显子1,没有reads比对到SI-LARP1的外显子1。2个isoform间共享的第2-19号外显子已完全被测序数据所覆盖。
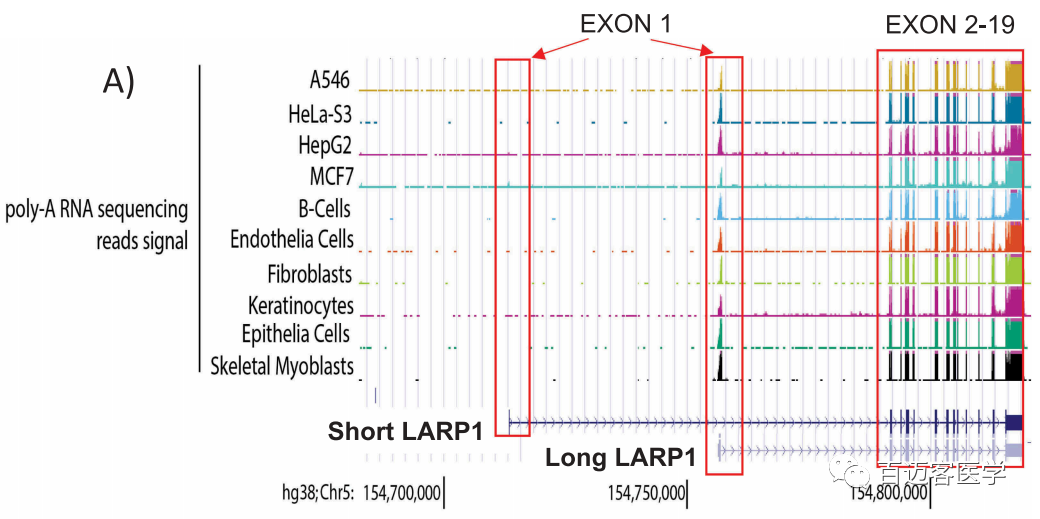
图2A
Nanopore全长转录组测序:为了进一步了解LARP1 isoform的表达,在HEK-293 T和OVCAR-8细胞(永生化的人类胚胎肾细胞和卵巢癌细胞系)中分别进行了牛津纳米孔测序技术(ONT全长转录组测序)(图2B-D)。这种RNA直接测序技术可以检测长读长转录本isoform,并可以无PCR偏倚地定量转录本丰度。与人类基因组(Hg38)比对,并使用IGV可视化。在HEK-293T细胞中,检测到总共2,038,842个转录本,而在OVCAR-8细胞的样品中仅检测到1,834,870个转录本。(根据百迈客的项目经验大概每个样本2G多的数据量)作者对所有比对到7个LARP家族成员的转录本进行表达定量,校正各样本数据量差异将其标准化为TPM(transcripts per million,每百万转录本)(图2B)。在LARP家族成员中,LARP3的转录本表达量最高(TPM=194)。相反,其他LARPs的表达值TPM远低于50,其中LARP1B和LARP4B的表达最低。且与前人研究一致,致癌性LARP1在OVCAR-8癌细胞(TPM 52)中的表达水平高于HEK-293 T细胞(TPM 38)中的表达水平。为了分析LARP1 sioform在这些细胞中的表达,作者使用Sashima图(图2C)可视化剪接位点。使用这种RNA直接测序的nanopore全长转录组方法,在2个测试的细胞系中均未检测到SI-LARP1。尽管LARPs的表达水平低于其他基因,例如GAPDH(在OVCAR-8细胞中TPM高达6396),因此LI-LARP1被鉴定为主要表达的LARP1亚型。作者还观察到5′截短的LARP1转录本积累,LARP1B的3种isoform共表达(NM-018078,NM_178043,NM-032239),LARP6的2种isoform共表达(NM_197958,NM_018357)(图2D)。对于其他LARP,能够确认ONT测序检测到的主要转录本与经典isoform相对应。
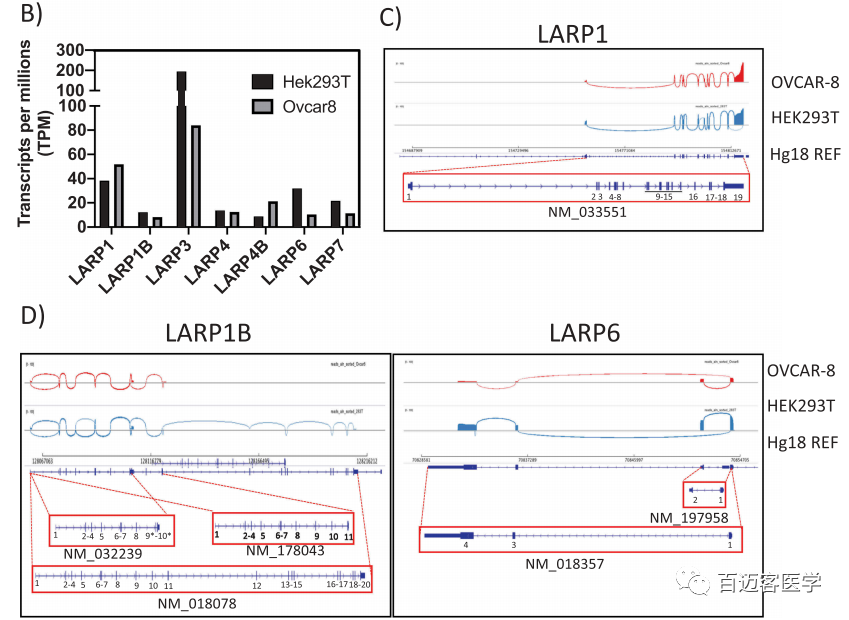
图2 B-D
特异性引物扩增及sanger测序验证实验:为了验证ONT全长转录组测序发现的LI-LARP1是主要isoform,作者设计了2对特异性引物,以通过PCR检测短或长LARP1 isoform或2种总和(使用保守的exon 7上的引物,此处称为“总LARP1”)(图3)。设计对应于每个LARP1 isoform外显子1的正向引物和下游外显子的外显子连接处的反向引物。这些引物有效性通过重组SI-LARP1或LI-LARP1表达后的成功扩增得到证实。设计用于检测总LARP1的引物,以在所有预测的isoform共有的第7外显子上退火。结果发现LI-LARP1在501-MEL(黑色素瘤细胞系)和OVCAR-8细胞中表达,但未检测到SI-LARP1的PCR扩增产物(图3A)。对所有PCR产物进行测序以验证所需的扩增子。接下来,设计了对长LARP1 isoform(LI-LARP1)的开放阅读框具有特异性的引物,并通过cDNA文库中的PCR进行了扩增,PCR产物的sanger测序结果揭示了LI-LARP1预测的完整核苷酸序列,包括其特定的外显子1(图3B)。值得注意的是,所有试图扩增SI LARP1 isoform编码序列的尝试均告以失败,表明该isoform在得到的cDNA文库中不存在。
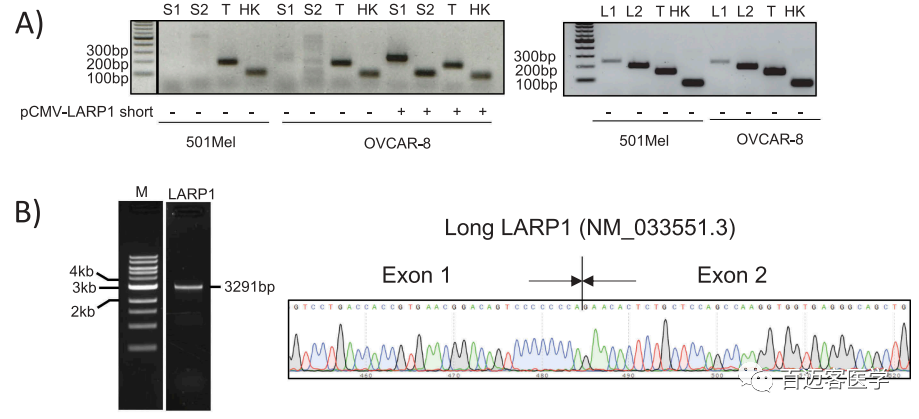
图3上 S1 / S2和L1 / L2分别代表检测SI-LARP1或LI-LARP1的引物对。T代表使用组成性表达的外显子7退火的引物对检测到的总RNA。HK代表管家基因OAZ1。
2、长LARP1 isoform在NCI-60癌症细胞系中占主导地位
为了确定LI-LARP1是否在更广泛的癌细胞系中表达,作者用qRT-PCR检测了NCI-60癌细胞系(美国国立癌症研究(NCI)规定的60种用于药物筛选的癌细胞系,包括黑素瘤、肾癌、卵巢癌、脑癌、白血球增多症、乳腺癌、非小细胞肺癌和前列腺癌细胞系)(图3C)。尽管样品之间LI-LARP1的表达差异高达37倍,但在所有细胞系中均可检测到。然而,所有系中SI-LARP1表达均低于检测阈值(cT值<35)。并测量NCI的5种癌细胞系(MCF-7、OVCAR-8、SK-OV-3、501-MEL和HEK-293T)中的SI和LI-LARP1表达验证了这些发现(图3D)。在所有五个细胞系中,LI LARP1的水平至少比SI-LARP1高1000倍。由于SI-LARP1的表达水平接近或低于检测极限,因此作者探讨了其余检测到的转录本是否为人工产物。成熟的mRNA的标志是存在3ʹpoly-(A)尾,这是其核输出所必需的。从OVCAR-8、SK-OV-3、501-MEL和HEK-293T中提取的总RNA使用随机或寡聚(dT)引物进行反转录(图3E)。随着随机引物与RNA库中任何类型的转录本退火,PCR扩增还将检测未加工完成的mRNA种类。相反,寡聚(dT)引物导致多聚腺苷酸化(带polyA)的mRNA发生特定的逆转录。使用基因特异性引物测量2个cDNA文库中SI-和LI-LARP1 isoform的水平。将表达水平使用管家基因OAZ1标准化,计算相对表达量。作者发现完全加工和多聚腺苷酸化的SI-LARP1 mRNA的水平低于检测极限,表明SI-LARP1 mRNA表达但未完全加工成成熟的聚腺苷酸化的mRNA。
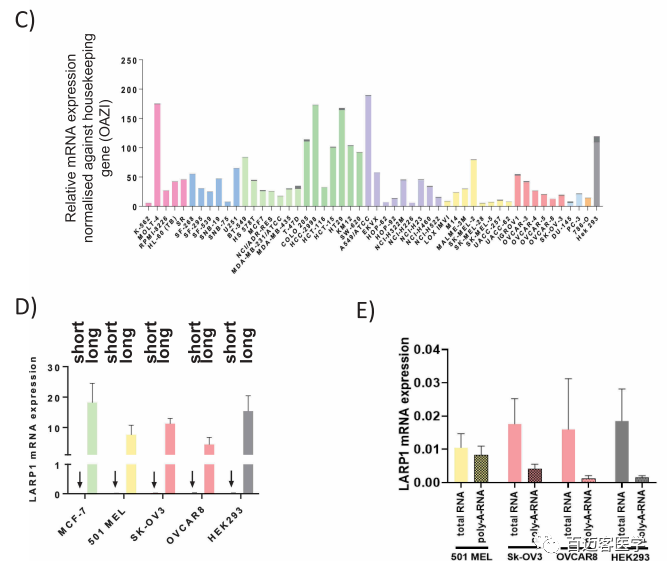
图3下 C中每根柱子上深灰色代表SI-LARP1,其他颜色代表LI-LARP1。
总之,长LARP1 isoform(LI-LARP1)在广泛的癌症和正常细胞中是主要表达的形式,而SI-LARP1 mRNA(如果表达的话)以低水平和不成熟的形式存在。
3、在4种不同的人类细胞系中鉴定长isoform特异性多肽
如前所述,SI-和LI-LARP1具有由不同外显子1序列编码的独特N末端(图4A)。2个外显子均在框内终止,因此外显子选择不影响LARP1的下游阅读框和氨基酸组成。较长的isoform多了77个氨基酸长的多肽链,并导致预测的蛋白质比短isoform大8.4 kDa。当2种形式都被外源表达时,在SDS凝胶电泳时仅观察到迁移模式的微小差异(图4B)。比较外源表达的SI-LARP1和LI-LARP1与内源性LARP1的凝胶迁移模式,发现内源性LARP1与LI-LARP1共迁移,表明LI-LARP1的蛋白质产物占主导地位。
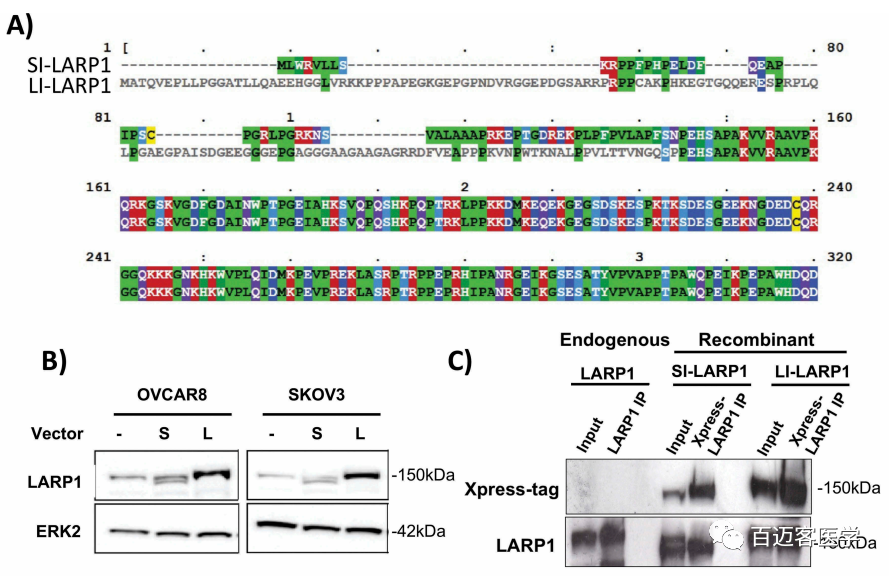
图4 A-B
为了验证这一点,首先,在OVCAR-8细胞中异位表达了2种LARP1 isoform,并使用针对共表达的Xpress标签的抗体从粗蛋白裂解物中免疫沉淀富集LARP1蛋白(图4C)–pull down实验。随后,使用胰蛋白酶或胰凝乳蛋白酶对样品进行溶液消化后,Shotgun LC MS/MS质谱分析以鉴定对应于SI-或LI-LARP1 isoform的N端特异性肽段。鉴定了从序列位置45和46产生的3种肽(质量为N46SVALAAAPR:485.2773 Th(m/z); K45NpSVALAAAPR:549.3257 Th(m/z); K45NSAVALAAAPR:589,3085 Th(m/z ))作为SI-LARP1的唯一特征(图4D)。相反,对于LI-LARP1,鉴定了由与外显子1对应的蛋白质序列产生的152个肽。第二步,免疫沉淀富集OVCAR-8、501-MEL、SK-OV-3和HEK-293T细胞的内源LARP1,并进行质谱分析,使用监督自动算法检测预先指定的isofrom特异性肽(图4E-F)。LARP1的肽覆盖率范围为内源性免疫沉淀蛋白的24-44%。尽管在所有4个细胞系中都鉴定出了与LI-LARP1 N端相对应的独特肽,但我们无法在任何样品中鉴定出对SI-LARP1亚型具有特异性的任何肽。这些结果与观察到的不存在对应于SI-LARP1的mRNA相一致。
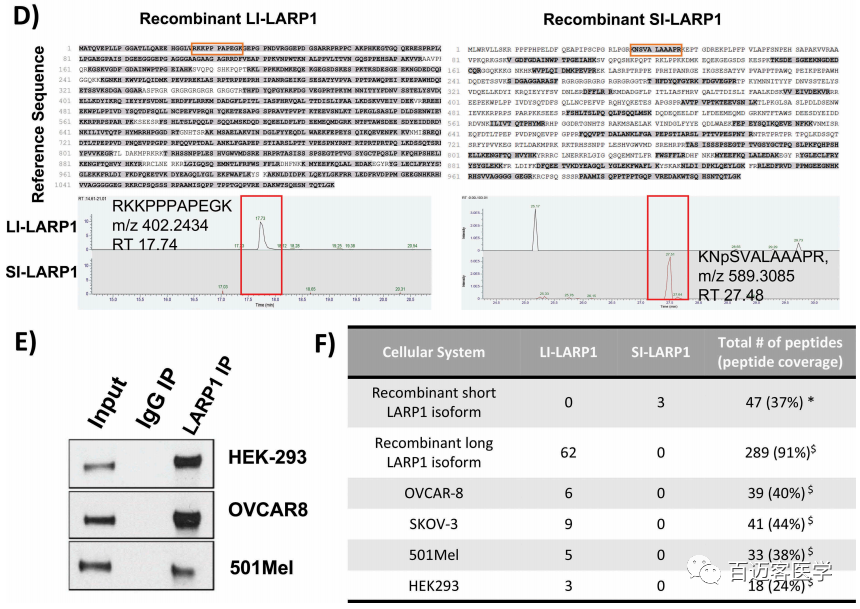
图4 C-F
4、短isoform启动子区被高甲基化而启动子活性被抑制
接下来,作者研究了调节SI-LARP1表达的机制。转录活性与染色质状态相关,其特征在于组蛋白修饰、开放染色质和特异性转录因子结合。因此,作者使用了3个公开可用的数据集来预测短和长LARP1 isoform的启动子活性(图5A)。SI-LARP1的预测转录起始位点TSS位于GRCh38.p13:154,712,843,而LI-LARP1的TSS处于SI-LARP1的第一个内含子内,位置为GRCh38.p13:154,755,377。基于3个参数来判断转录活性:首先,使用ChIP-seq数据来识别H3K27ac标记,该标记代表H3组蛋白的赖氨酸27的乙酰化,从而导致转录增强;其次,使用来自人类甲基化芯片的数据来鉴定CpG甲基化,其与基因沉默相关,反之,它们的去甲基化激活基因表达;第三,使用多变量隐马尔可夫模型(HMM)整合ChIP-seq数据,预测了9种人类细胞系的区段化染色质状态。所有数据均与GRCh37/hg19进行比对,并使用UCSC基因组浏览器进行分析(图5A)。作者发现SI LARP1 TSS区的CpG甲基化水平较高,但H3K27AC标记较低,表明启动子活性降低。相反,LI-LARP1 TSS区的CpG甲基化水平较低,而H3K27AC标记较高,表明存在一个活跃的启动子位点。对于SI-LARP1而言,在人类胚胎干细胞中观察到启动子活性的唯一显著增加。总体而言,LI-LARP1的启动子区域处于开放的染色质状态,这表明该区域具有较高的启动子活性,而SI-LARP的启动子受到表观遗传抑制。
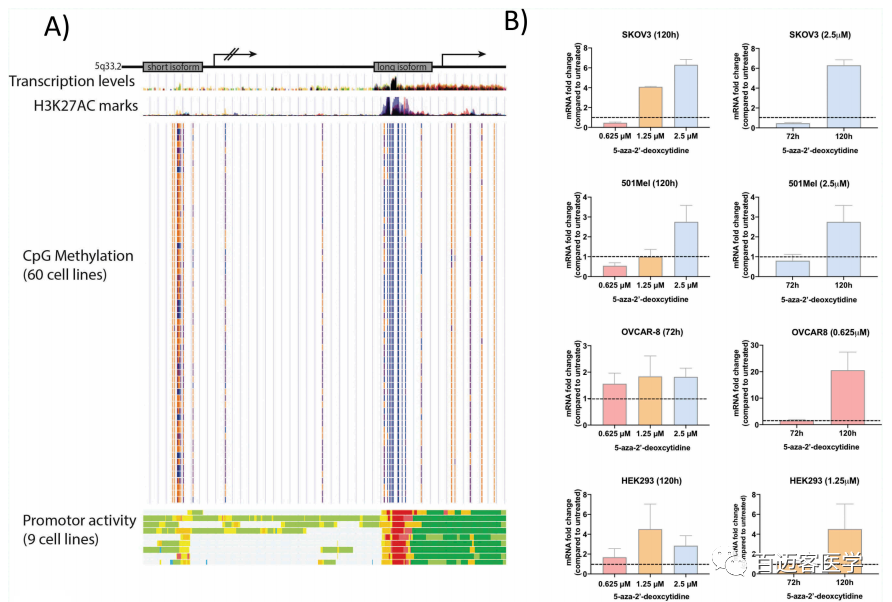
图5 A-B
为证实CpG甲基化对SI-LARP1启动子的抑制作用,使用5-氮胞苷(5-Aza,胞苷的化学类似物,DNA甲基转移酶抑制剂)通过去甲基化来重新激活其表达(图5B)。为此,将SK-OV-3、OVCAR-8、501-MEL和HEK-293T细胞用浓度递增的5-Aza处理3天或5天。为了确认SI-LARP1表达的重新激活,定量PCR测量了处理过的细胞和对照细胞中SI-LARP1 mRNA的水平(图5B),并观察到3天后SI-LARP1的浓度依赖性增加了5倍。使用最佳浓度并延长孵育时间至5天时,发现OVCAR-8中的SI-LARP1 mRNA增加了20倍。但是,蛋白质印迹法没有检测到任何与SI-LARP1相对应的蛋白质。值得注意的是,没有观察到LI-LARP1 mRNA和蛋白质表达的显著增加。这些数据表明,SI-LARP1的表达在某种程度上受到表观遗传调控。但是,即使在表观遗传学上解除抑制,SI-LARP1也不会通过细胞质翻译机制合成为蛋白质。
接下来,作者探讨了LI-LARP1的表达模式是否与SI-LARP1和内源性LARP1的表达模式相似。Hopkins等人的先前工作表明,在OVCAR-8和SK-OV-3细胞中使用能够同时靶向SI-LARP1和LI-LARP1的siRNA瞬时敲低LARP1与细胞活力降低和凋亡增加有关。为了验证该观察结果可归因于LI-LARP1,设计了2种siRNA:靶向LI-LARP1 mRNA独特的外显子1或2种isoform普遍存在的外显子13。与对照scramble siRNA处理的OVCAR-8细胞相比,2种siRNA均导致细胞活力降低。使用针对外显子13的siRNA可以成功消除了LARP1蛋白质印迹双链体中较低的蛋白带(其大小约为130 kDa),这表明该条带对应于LARP1的未知的N端截短的变体。
此外,已充分确定的是,LARP1与PABP(poly A结合蛋白)相互作用,使靶mRNA的5’和3’UTR紧密相邻。为了证明LI-LARP1可与PABP互作,作者对内源性和异位表达的LARP1进行pull down实验,发现SI-LARP1和LI-LARP1都能够结合PABP。
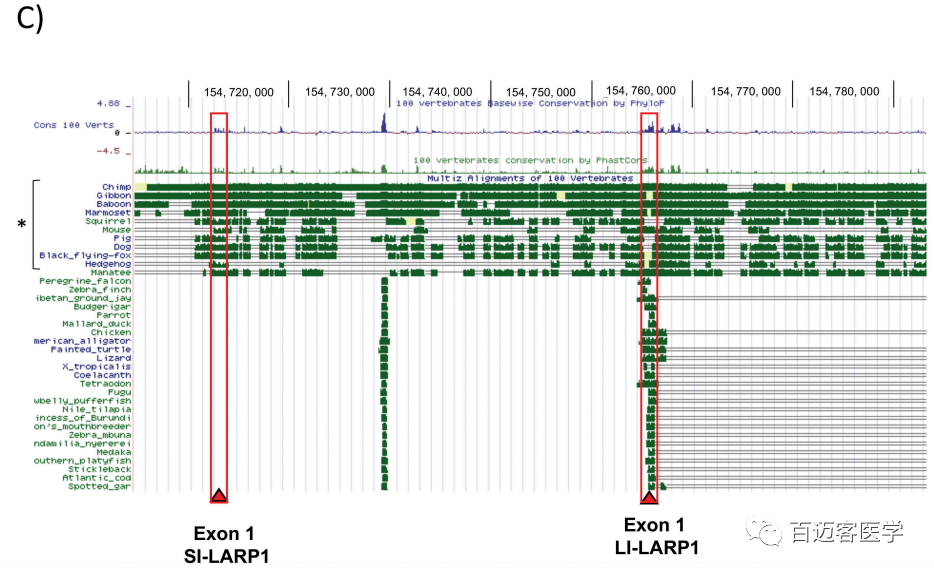
图5 C
接下来,作者对SI-LARP1是否可以发挥独特的功能作用感兴趣。为此分析了2种LARP1亚型的TSS区保守水平(图5C)。作者假设,进化保守将暗示选择性压力,因此每种亚型的作用不同。为了解释LARP1亚型的进化保守性,使用UCSC基因组浏览器在脊椎动物(鸟类、鱼类、两栖动物、爬行动物、哺乳动物)亚门上生成了100个可用LARP1序列的多序列比对。出乎意料的是,LI-LARP1外显子1在整个亚科中都具有很强的保守性,但SI-LARP1外显子1的保守性仅存在于胎盘动物分支中,其中包括人类和其他灵长类动物。这表明它可能在胎盘哺乳动物的进化晚期获得了功能性作用。相比之下,LI-LARP1的保守性跨多个进化分支表明作用更为古老。
小结
作者先前发表的研究预测了LARP1的10个潜在替代启动子,并且与大多数编码基因具有多种isoform但只有一种表达的蛋白的证据相符。尽管表达的isoform的进化保守表明其具有保守的生物学功能,但未表达的isoform的作用仍存在争议。尽管有些人假设它们是转录噪声,但另一些人则认为需要它们调节蛋白质功能、相互作用或定位或生成进化试验场允许功能和结构域进化的。确实,本研究表明SI-LARP1的外显子1在胎盘哺乳动物小分支中是高度保守的,这表明它提供了不同于LI-LARP1的功能性和进化优势。此外,仅在人类胚胎干细胞中检测到SI-LARP1 mRNA可能表明在胚胎发育中起作用。SI-LARP1和亚细胞定位的确切作用需要在未来的研究中解决。
参考文献
Schwenzer H, Abdel Mouti M, Neubert P, et al. LARP1 isoform expression in human cancer cell lines [published online ahead of print, 2020 Apr 14]. RNA Biol. 2020;1‐11. doi:10.1080/15476286.2020.1744320







 京公网安备 11011302003368号
京公网安备 11011302003368号