2019年12月5日,国际知名期刊Nature Communications (《自然·通讯》)在线发表了由华中师范大学与北京百迈客生物科技有限公司共同合作文章“Genomic and transcriptomic insights into molecular basis of sexually dimorphic nuptial spines in Leptobrachium leishanense”。华中师范大学生科院吴华教授为本文通讯作者,华中师范大学生科院李军博士为论文的第一作者,百迈客生物科技作为第二单位共同参与研究。本研究借助二代、三代PacBio和HiC技术组装了我国特有物种雷山髭蟾(Leptobrachium Leishanense)高质量基因组,通过比较基因组学分析及雌雄个体不同发育时期的有参转录组分析鉴定了一系列与角质刺性二态发育相关的生物学通路和关键基因。研究成果首次较全面地解析了两栖动物性二态形成相关的重要生物学通路以及关键基因,弥补了相关研究的不足。该成果不仅为两栖动物基因组数据库提供了高质量的参考基因组,而且对于深入理解脊椎动物性二态形成及调控的分子机制具有重要意义。

![]()
研究背景
在雌雄异体的有性生物中,两性之间在体型大小、形态结构和功能等方面存在明显差异的现象称为性二态(Sexual dimorphism)。自然界普遍存在的性二态(如剑尾鱼的剑状尾和狮子的鬃毛等)一直是进化生物学家关注的热点问题。两栖动物具有丰富的性二态特征,繁殖期的雄性雷山髭蟾在上颌的皮肤形成角质刺,类似于人类的“胡子”,因此又被称为“胡子蟾”,繁殖期过后,角质刺外壳会脱落,而雌性则没有这种特征。由于除了性染色体上的基因外,大多数的基因组在雄性和雌性之间是共享的,所以性二态往往是由基因在性别间差异性表达引起的。由于缺乏参考基因组,很少有研究能够将性别差异表达模式与特定的性二态特征联系起来,与性二态性状相关的重要生物学过程和关键基因也一直难以破解。本文成功的建立了一个具有代表性的锄足蟾亚目基因组,并对其皮肤来源的性二态性状进行了分子基础的研究。
研究材料
基因组(Illumina、PacBio测序):成熟雄性雷山髭蟾肌肉组织
HiC:成熟雄性雷山髭蟾全血
转录组基因预测:脑、精巢、肝、心、肾、脾、肌肉、上颌皮肤(MS)、背部皮肤(DS)
转录组学分析:亚成年期、繁殖期、繁殖后期雌性及雄性的上颌皮肤、背部皮肤、脑、性腺组织(图1)
qPCR验证:雌性及雄性繁殖期上颌皮肤、背部皮肤。

图1 雷山髭蟾雌雄外形特征及取样示例
分析内容
主要结果
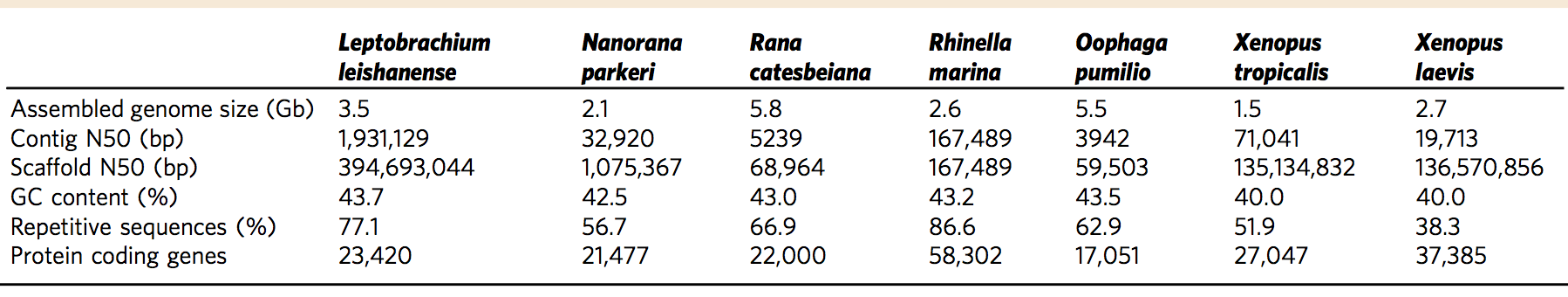
k-mer分布估计基因组大小为3.56 Gb(k=21,图2)。通过PacBio(~80×)+Illumina(~50X)+Hi-C(~44X)技术组装出3.54 Gb基因组,并将3.31 Gb(92.9%)基因序列定位到13条染色体上,contig N50为1.93 Mb,scaffold N50为395 Mb(表1,图3)。CEGMA评估显示组装基因组中包含的保守基因占97.2%,BUSCO评估显示组装基因组中完整基因数占97.2%,表明组装的基因组具有较高的完整性。雷山髭蟾具有77.1%(2.73Gb)的重复序列,高于大多数已完成测序的无尾目物种(表1)。本次研究获得了锄足蟾亚目代表性物种染色体水平基因组的组装。
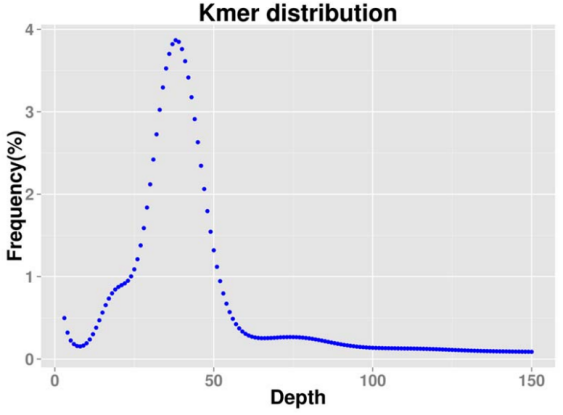
图2 k-mer分布图
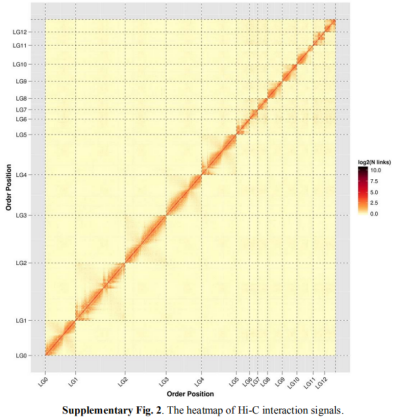
图3 Hi-C交互信号
表1 雷山髭蟾与其它无尾目物种基因组比较
通过基因组共线性研究雷山髭蟾L. leishanense和热带爪蟾 X. tropicalis的基因组结构特征。结果表明,两个物种之间存在着大量的染色体共线性(图4 b)。L. leishanense染色体数目是13,而 X. tropicalis的染色体数目是10,这种差异是源于L. leishanense的染色体分裂。X. tropicalis染色体(Xtr)4、7和8上的同源共线性区段分布在L. leishanense基因组中的两个独立染色体上(分别为Lle8+10、6+11和9+13)。在L. leishanense的基因组中,346个共线性区段中有179个倒位。经PacBio reads验证,X. tropicalis的Xtr2、3、6、9、10等7个区域(502 Kb-5.9 Mb)易位到与相应同源染色体不同的L. leishanense染色体上(图5)。
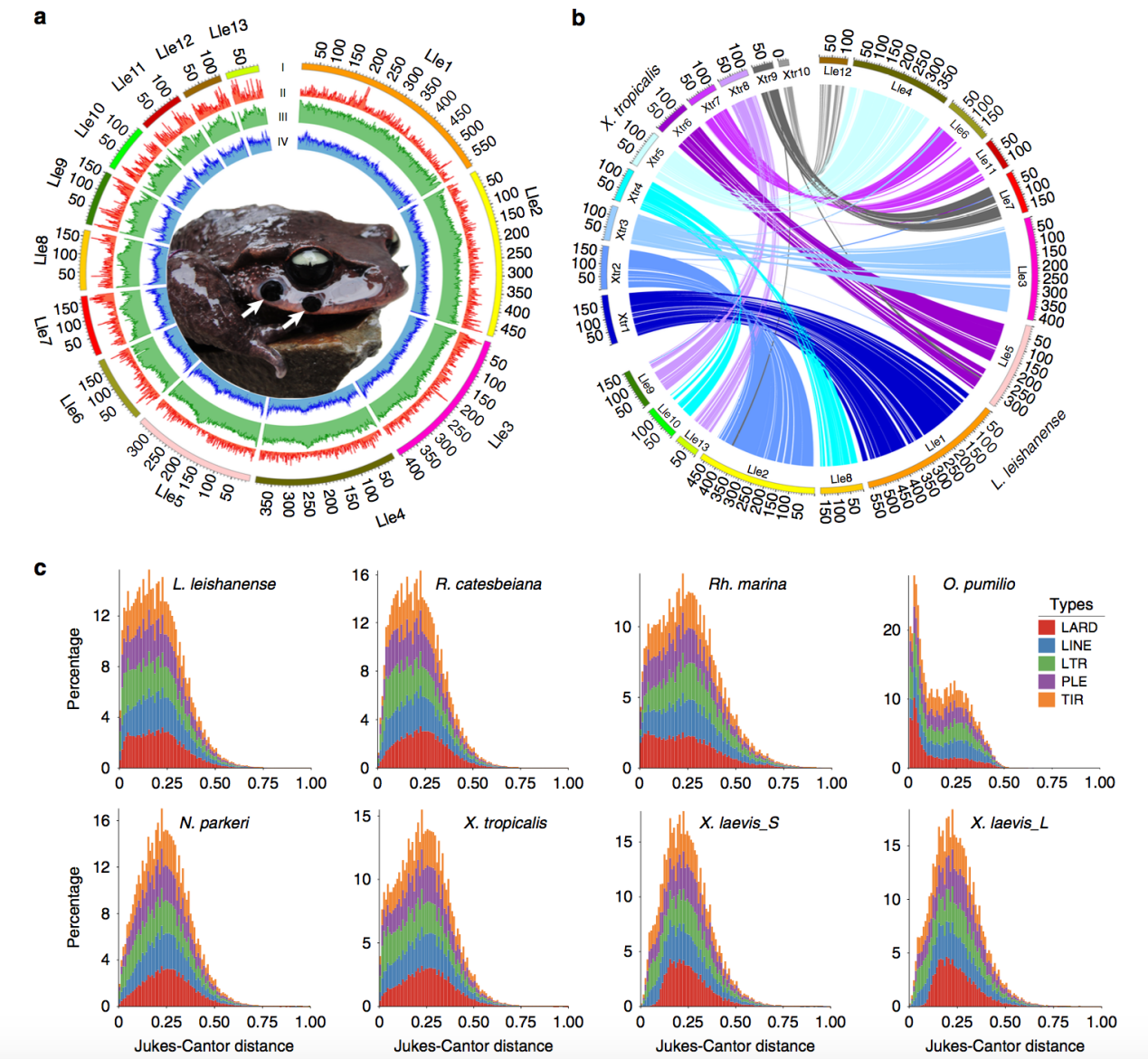
图4 雷山髭蟾与其它无尾目物种基因组比较
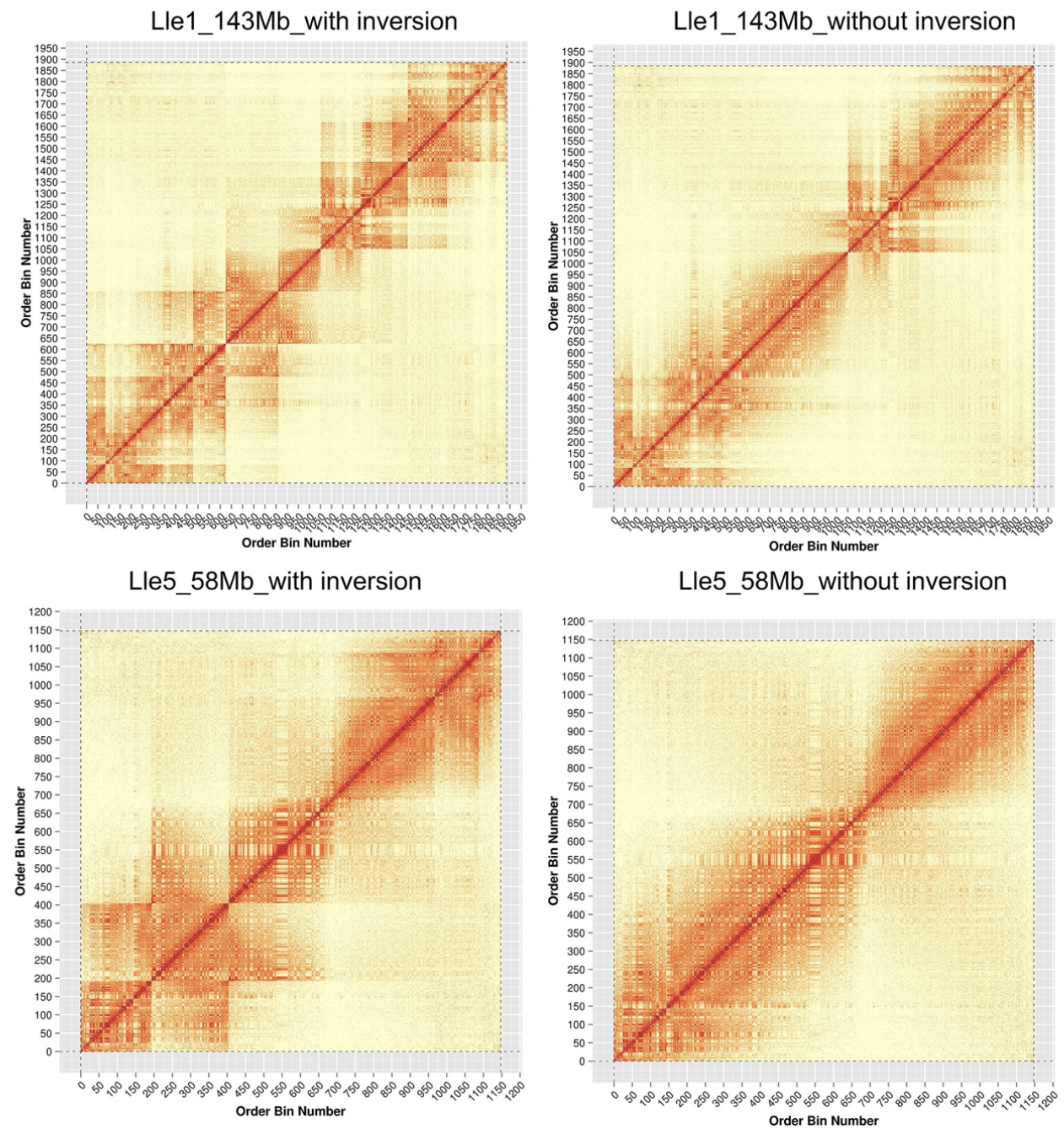
图5 HiC互作信号鉴定雷山髭蟾染色体倒位
通过单拷贝直系同源基因进行进化树的构建,七个无尾目物种最近的共同祖先(MRCA)估计发生在2.101亿年前(176.2-248.8 Ma),L. leishanense与新蛙亚目的物种在约185.9 Ma发生分化(图6)。与MRCA相比,L. leishanense共有107个基因家族显著扩张(图6),扩张家族的基因主要富集于信号反应类型,包括嗅觉、刺激反应和信号转导。与细胞增殖、凋亡和存活等多种细胞功能的调节和对细胞外刺激的反应中起重要作用的PI3K-Akt信号通路在L. leishanense中显著扩张。与免疫反应相关生物过程相关基因发生显著且特异性的扩张。还需要进一步的分析和实验数据来探讨其生境适应与免疫应答相关基因扩张的关系。
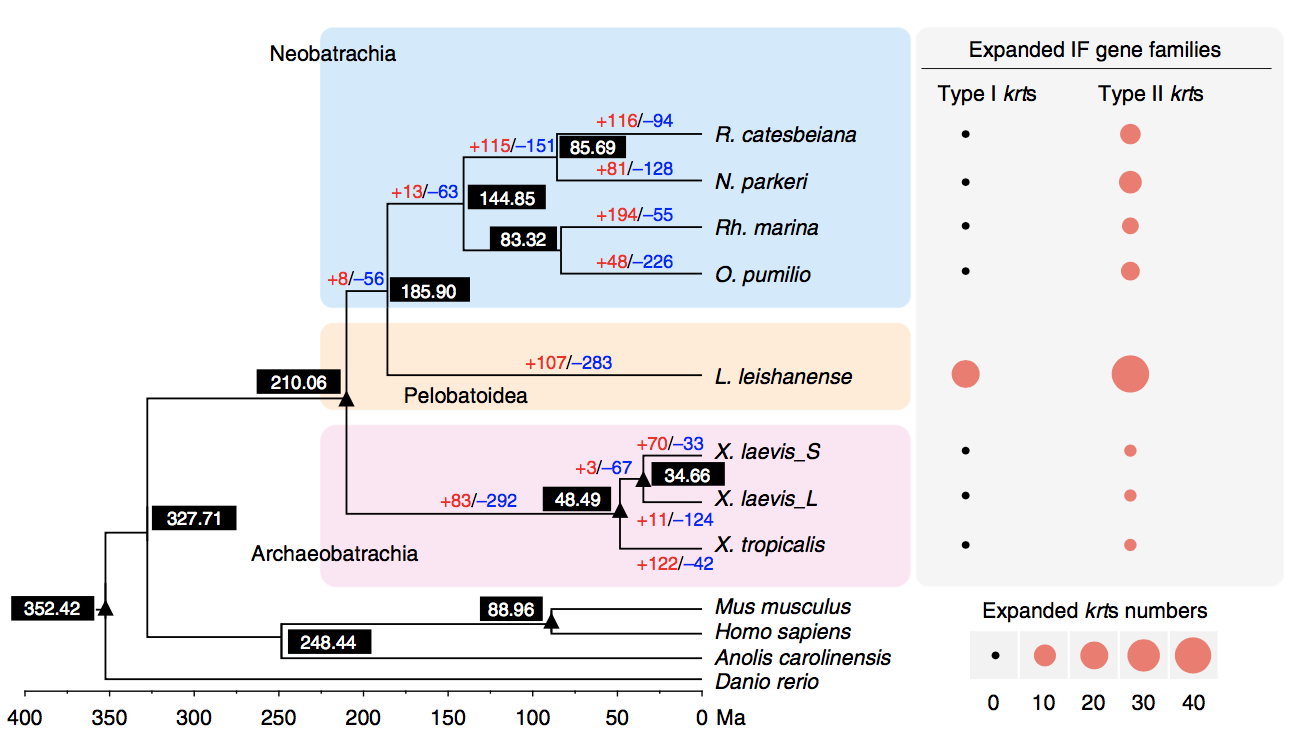
图6 无尾目动物比较基因组分析
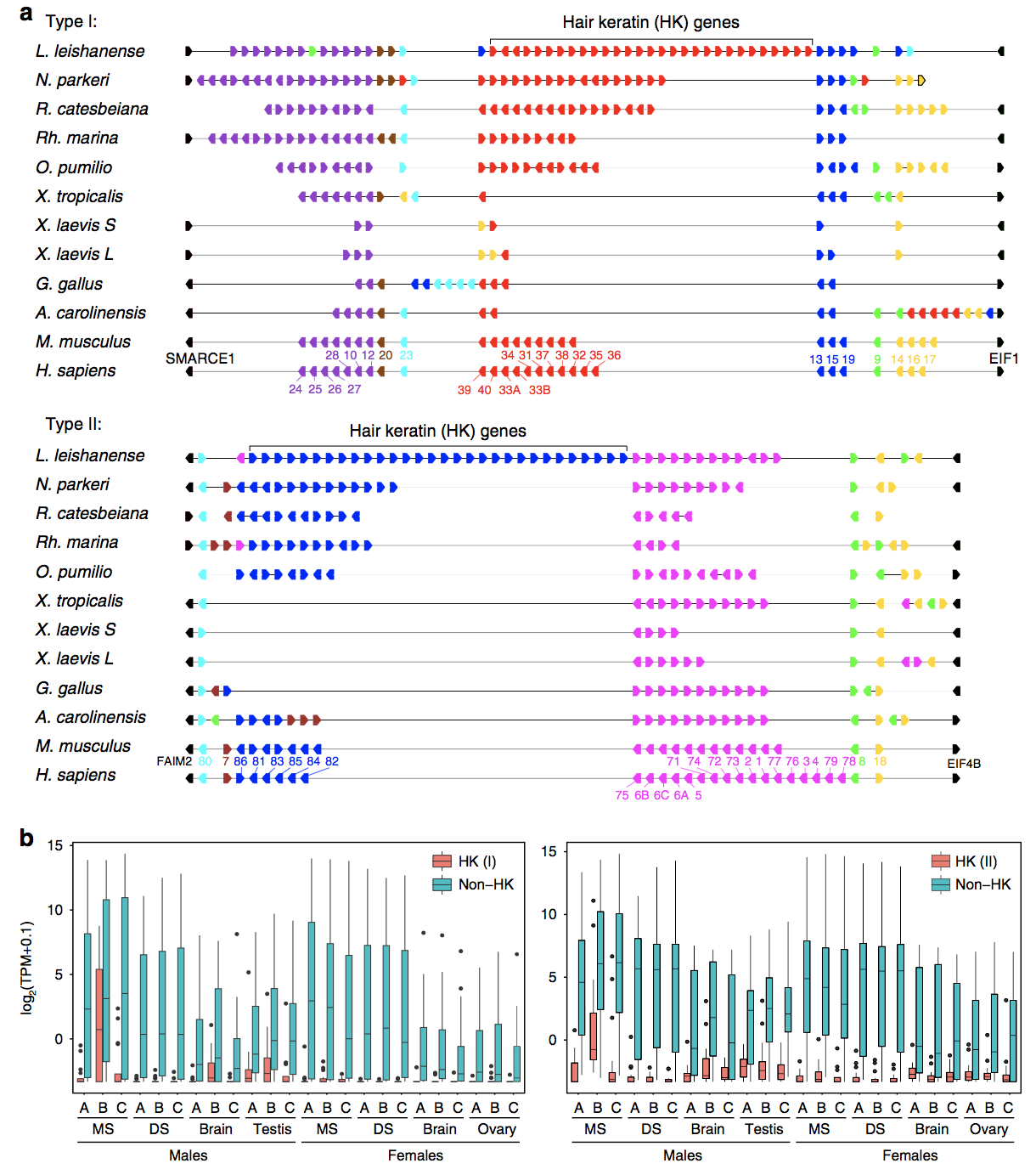
图7 角蛋白基因家族的基因组分布和表达模式
为了研究L.leishanense中与角质刺性二态相关的生物学过程,研究人员对MS的转录组进行了两种性别和三个发育阶段的测序(表2)。同时对两种性别和三个阶段的DS转录本作为对照。对于每个发育阶段,进行了三组独立比较(图1):(1)雄性和雌性MS的比较;(2)雄性MS与DS的比较;(3)雌性MS与DS的比较。确定差异表达基因(DEGs),并进行了GO和KEGG的富集,以检查基本的生物学过程和途径。
表2 转录组分析组织代号
 亚成年期(A),雄性MS和DS之间的差异表达基因(DEGs)主要参与转录调控过程和骨骼发育相关过程,而在雌性中类似的生物学过程没有发生富集繁殖期(B),两性MS中差异表达基因大多富集在激素活性和上皮细胞分化过程,雄性MS和DS之间的DEGs也有类似的生物过程富集,但在相同的雌性比较中却没有;繁殖后期(C),雄性MS和DS的DEGs在含有多个编码胰蛋白酶和组织蛋白酶基因的蛋白水解过程中显著富集,可能是通过蛋白水解过程来引起角质刺脱落。
亚成年期(A),雄性MS和DS之间的差异表达基因(DEGs)主要参与转录调控过程和骨骼发育相关过程,而在雌性中类似的生物学过程没有发生富集繁殖期(B),两性MS中差异表达基因大多富集在激素活性和上皮细胞分化过程,雄性MS和DS之间的DEGs也有类似的生物过程富集,但在相同的雌性比较中却没有;繁殖后期(C),雄性MS和DS的DEGs在含有多个编码胰蛋白酶和组织蛋白酶基因的蛋白水解过程中显著富集,可能是通过蛋白水解过程来引起角质刺脱落。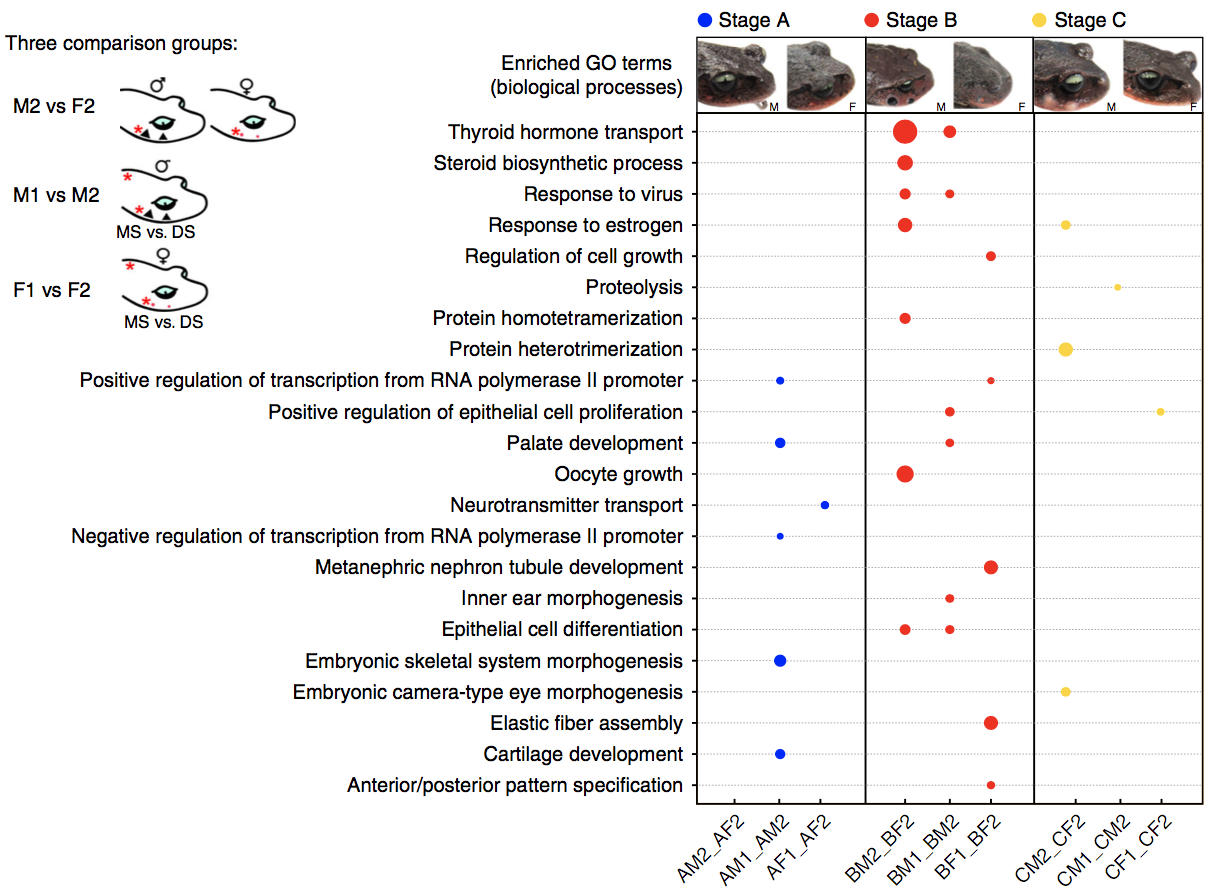
图8 雷山髭蟾中与角质刺产生相关显著富集的生物过程
为了探讨L. leishanense中角质刺的激素调节,研究者对来自大脑和性腺的转录组数据进行了测序(表2)。研究发现B期雄性和雌性之间的DEGs(BM3-BF3)和A期和B期雄性之间的DEGs(AM3-BM3)中的神经活性配体-受体相互作用途径显著富集,在这些基因中,LH(黄体生成素)和FSH(卵泡刺激素)编码肽激素,通过血液进入性腺刺激类固醇激素的合成(图9)。相关基因的表达表明雄性在繁殖季节中下丘脑-垂体-性腺轴的激活。雄性精巢在不同时期的类固醇激素生物合成途径显著丰富。在这条途径中,编码参与性类固醇生物合成的酶的基因在B期雄性精巢中高度表达(图9),表明B期雄性精巢中雄激素(睾酮和5α-DHT)生物合成水平较高。
除了性腺外,皮肤是主要的非经典组织,通过功能性活性酶的表达促进类固醇生成。在L. leishanense中,雄性和雌性MS之间的DEG也在类固醇生物合成过程中显著富集。这些酶的高表达表明雄性MS中雄激素C19类固醇的积累。然而,单靠雄激素不足以支持雄性的性二态特征,其他激素也起着关键作用。研究发现,甲状腺激素(TH),催乳素(PRL)和松弛素(RLN)可能参与调节过程。“甲状腺激素转运(thyroid hormone transport)”在BM2–BF2和BM1-BM2的DEGs中高度富集(图8)。
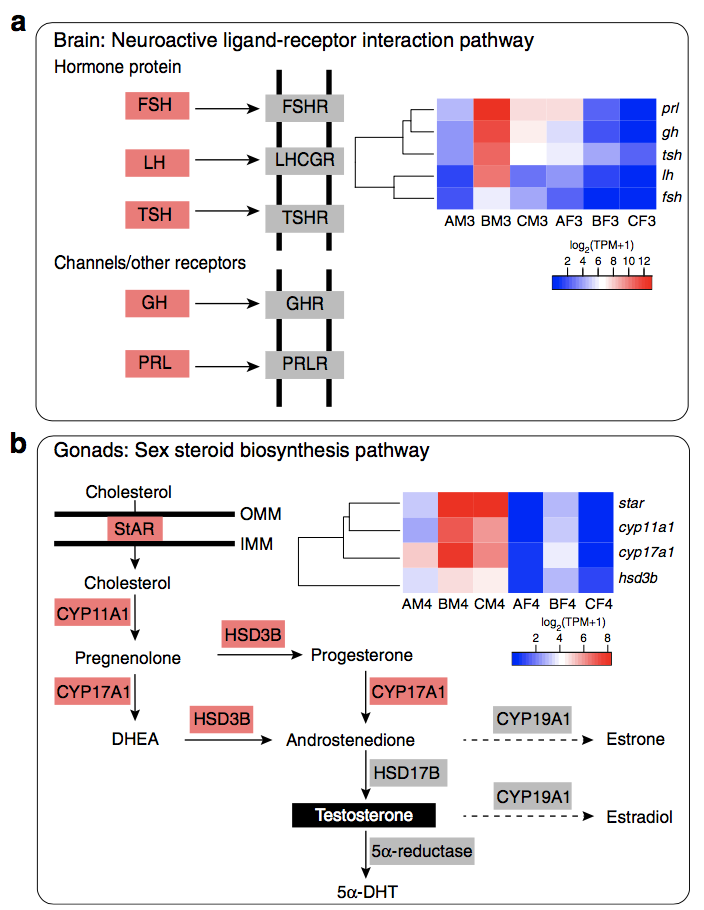
图9 脑和性腺成对比较中显著富集的激素相关途通路
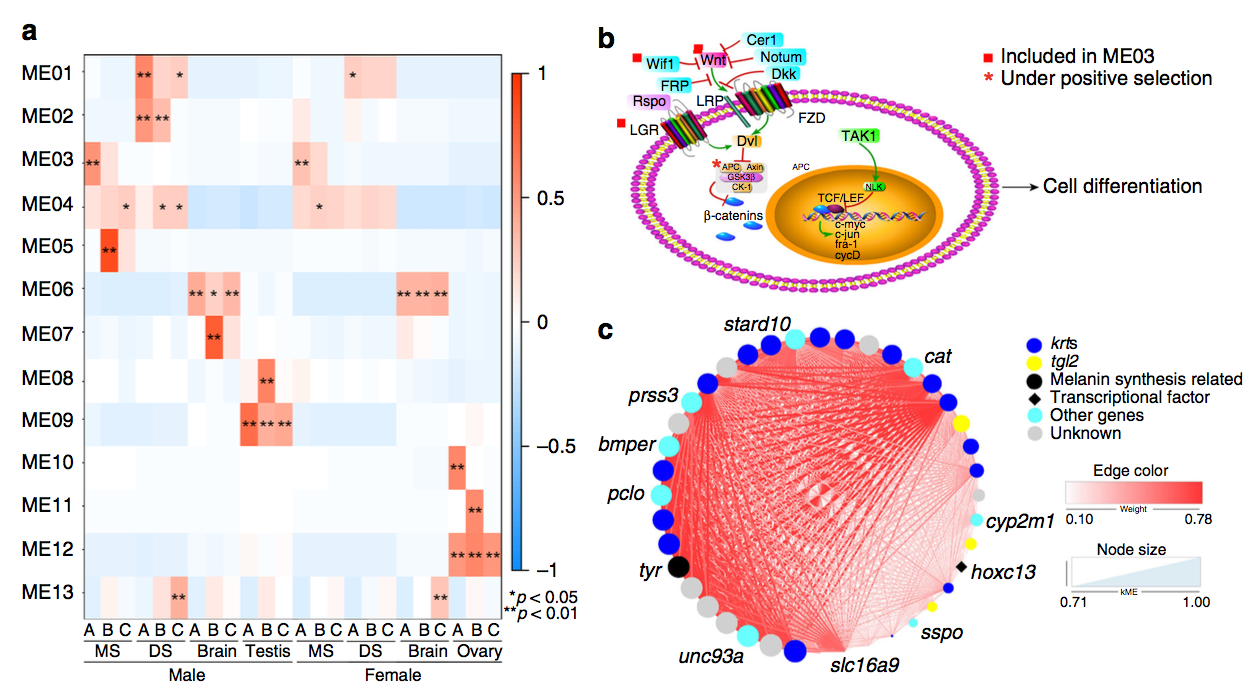
图10 WGCNA分析基因共表达模块和网络
小结
本文以雷山髭蟾为研究对象,建立了一个具有代表性的锄足蟾亚目基因组。这项研究不仅提供了一个高质量的两栖动物基因组,并揭示了雷山髭蟾角质刺产生的分子基础。对于深入理解脊椎动物性二态形成及调控的分子机制具有重要意义,类似的分子调控模式也为今后两栖动物皮肤起源的性二态研究提供指导。
如果您的项目遇到科研问题,欢迎点击下方按钮联系我们,我们将免费为您设计文章思路方案。









 京公网安备 11011302003368号
京公网安备 11011302003368号