
研究背景【细胞分化研究进展】
1型糖尿病(T1D)是由胰岛中产生胰岛素的β细胞的自身免疫性破坏引起的。供体胰岛移植有望治疗T1D,但供体短缺和费用昂贵限制了其可行性。将多能细胞体外分化为β细胞是有希望替代胰岛移植的治疗1型糖尿病的方案。
研究方式【细胞分化研究进展】
hESC(人胚胎干细胞)体外定向分化成β细胞采用6阶段,取10个连续时间点未分化的细胞进行scRNA-seq(如下图所示),包括每个分化阶段结束点及中间点。采用 Smart-seq流程进行单细胞转录组研究。最终选择了773个单细胞数据进行分析,平均每个细胞测序reads数945,907。
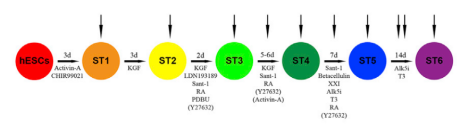
结果概述【细胞分化研究进展】
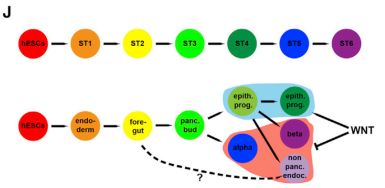
结合SIMLR分析(single-cell interpretation via multikernel learning)与主题建模(topic modeling ,TM)进行细胞之间关系的分析,鉴定出在相同细胞中协同高频表达基因(expression profiles,EPs),具有相同EP的细胞可以分类到一起。用于将hESC体外定向分化成β细胞的方法,通常被描述为从一步到下一步均匀驱动细胞的线性过程。使用scRNA-seq,发现分化仅在方法的前三个阶段是同质的,之后上皮祖细胞和内分泌细胞并排存在。第4阶段的内分泌分化趋向于产生α细胞,第5阶段的第二波趋于产生β细胞和非胰腺内分泌细胞(图J)。
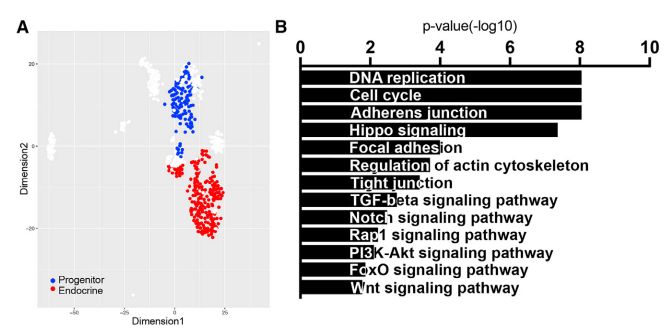
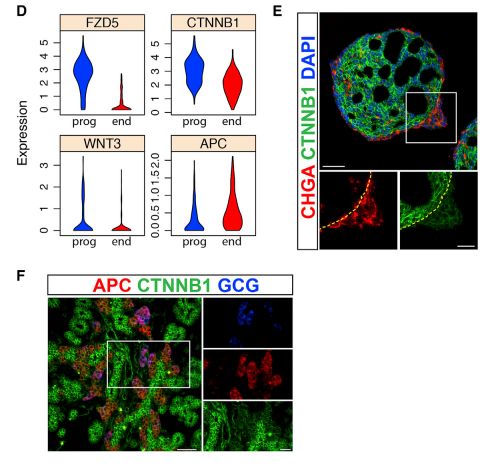
为了研究调节未分化祖细胞与内分泌细胞之间整体平衡的遗传途径,基于上皮祖细胞及内分泌细胞差异表达的基因,发现祖细胞中上调表达的转录本富集于Wnt活化相关的因子,包括配体WNT3和通路主要传感器β-catenin,蛋白水平也类似(图BDE);相反,APC作为WNT活性抑制分子,在内分泌细胞中是上调的(图D)。在小鼠胚胎中,APC蛋白在内分泌半岛区域唯一检出,在上皮索中β-catenin 水平升高(图 F)。
小结【细胞分化研究进展】
体外hESC分化为β细胞的单细胞转录组水平研究;
祖细胞与内分泌室表达不同的WNT通路组分;
小鼠内分泌前体细胞APC敲除抑制内分泌细胞分化;
体外WNT通路小分子抑制剂增加了内分泌产生。
体外分化方法的最终目标是为糖尿病患者提供源自多能干细胞的β细胞而不是移植胰岛。然而,应该注意到,目前实施的医疗方案涉及全胰岛移植,而不是单独的β细胞。事实上,移植单细胞类型无法确定是否能够重新获得整个胰岛的功能。因此,致力于在体外产生完整的胰岛比纯粹的β细胞群更有意义。文章尝试在体外单细胞水平产生胰腺内分泌细胞的方法。作者通过scRNA-seq产生了一个无偏的大数据集,这使得能够表征所产生的各种细胞类型,它们的分化时间以及鉴定影响细胞命运的分子途径。长远来看,精细调整祖细胞与内分泌命运的时间和平衡的能力可用于控制α和β细胞之间的比例,并促进具有适当细胞组成的胰岛的体外形成。
参考文献:
Wnt Signaling Separates the Progenitor and Endocrine Compartments during Pancreas Development.Cell Rep,2019.
文献及原文链接:
https://international.biocloud.net/zh/article/detail/31116975







 京公网安备 11011302003368号
京公网安备 11011302003368号