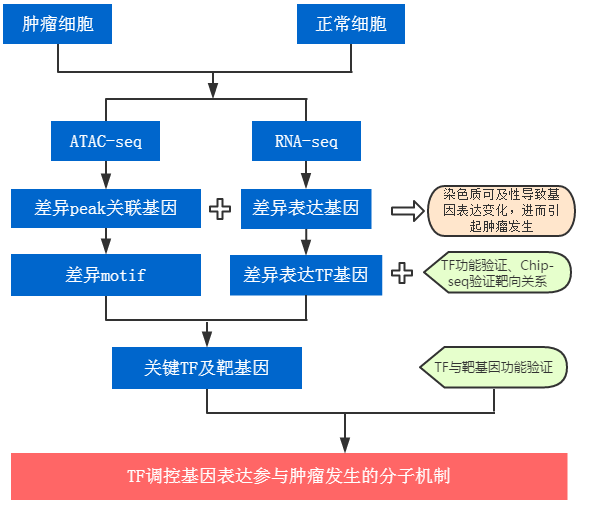
众所周知,ATAC-seq作为可以获得全基因组染色质可及性图谱、转录调控因子作用机制的高通量技术,是从表观水平上研究疾病发生发展中转录水平调控机制的利器,那具体如何借助这一利器发现疾病发生发展中的关键转录因子,并揭示其调控机制呢?今天我们就通过这篇NC文献get其中的经典套路。

研究背景
胶质母细胞瘤(GBM)是成人最常见的原发性脑肿瘤,由于不可避免地会出现浸润细胞超出切除范围,所以预后仍不理想。此外,肿瘤边缘区的胶质瘤细胞的化疗效果较差,并与肿瘤复发有关。考虑到浸润边缘肿瘤细胞相比于中心区细胞具有独特的微环境和转录特征,这两种细胞群可能受不同的分子通路调控。
表观遗传学对于正常干细胞发育和分化过程中的可塑性、维持异常癌症干细胞状态至关重要。在GBM中,染色质重构支持胶质瘤干细胞(GSC)发育过程的重现,促进肿瘤生长。研究已发现了在培养的GSC或患者来源的异种移植老鼠神经胶质瘤模型中与迁移和浸润相关的转录因子(TF),如ZEB1、STAT324等。然而,由于浸润性肿瘤细胞在其微环境中对运动性、黏附性、缺氧、代谢和免疫反应的复杂适应,这些TF在多大程度上调节肿瘤细胞迁移一直较难分辨。对直接从肿瘤灶分离的人类GSC群的TF进行分析,可以发现在培养细胞和混合正常脑实质的中没有的调控迁移的内在调节因子。
在此,作者从人GBM和生发层(GM)组织中直接分离出GSC和神经干细胞/祖细胞(NSPC),基于ATAC-seq研究在相似的发育背景下肿瘤发生的内在转录调控因子及其调控机制。
研究方法
- ATAC-seq
通过荧光激活细胞分选术(FACS)从GM和GBM组织中分离的细胞GSC(EGF+/-)、NSPC(EGF+/-),分别进行ATAC-seq。
- 功能验证实验
CRISPR-Cas9基因敲除与过表达(TEAD1、TEAD4、EGFR等);RNA-seq;体外–细胞增殖与迁移实验;体内–异种移植实验;染色质免疫沉淀实验等。
研究结果
GSC的全基因组染色质可及性特征
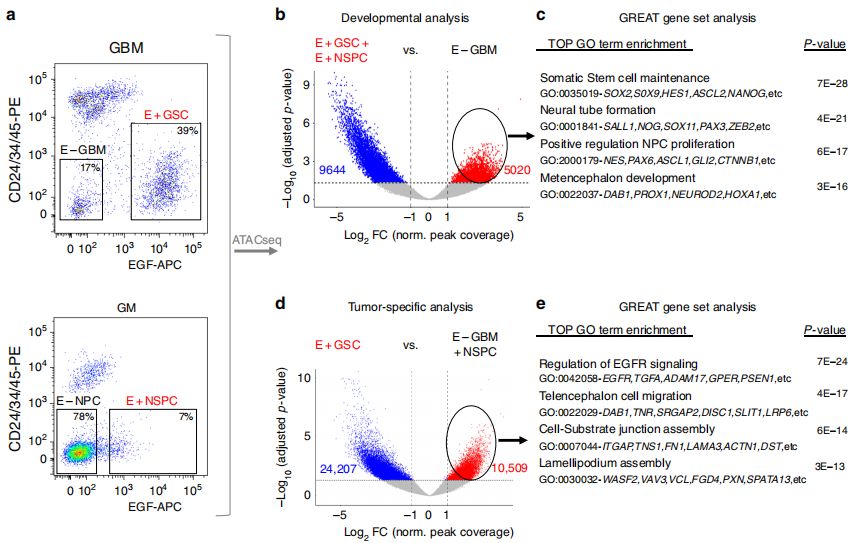
E – GBM在体外缺乏干细胞特性,在体内缺乏肿瘤发生机制,为了明确评估GSC中染色质可及性在发育方面的作用,将E+GSC和E+NSPC干细胞中富集peak与E- GBM相比较,发现了5020个差异peak,这些peak关联基因进行功能注释与富集分析表明这些基因与干细胞维持和增殖的生物学过程相关。作者对E+GSC与所有其他细胞群(NSPC与E-GBM)进行了差异可及性分析,以鉴定肿瘤干细胞表型特有的调控因子,发现了在肿瘤GSC中特异性富集的10509个peak,对应4015个蛋白编码基因,它们与细胞迁移、运动和ECM过程具有显著的相关性。在比较E+GSC和NSPC转录组时也发现了类似的功能基因集关联。
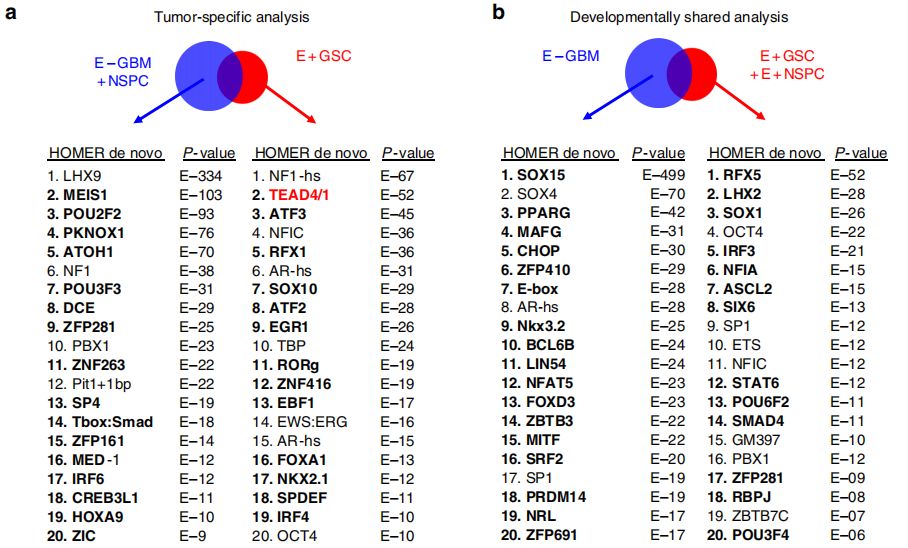
基于ATAC-seq鉴定GSC中的关键转录因子
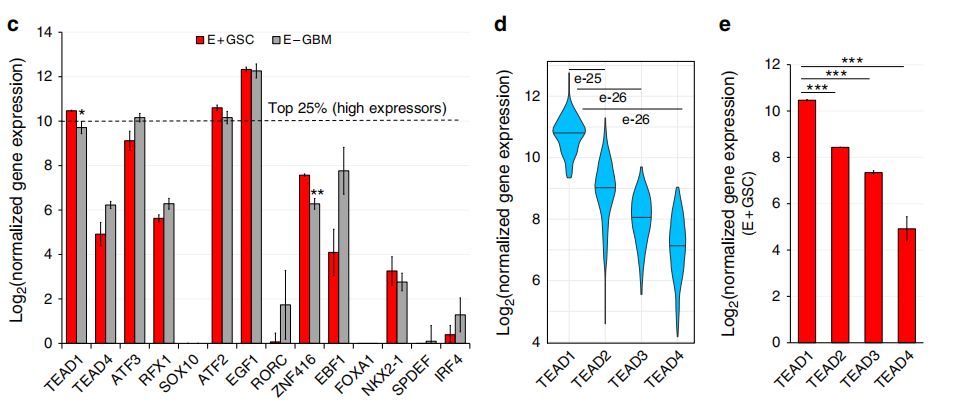
通过ATAC-seq分析染色质的可及性,不仅可以识别转录的调控区域,还可以推断出其中的TF活性。在此,作者鉴定了27个GSC肿瘤特异性的TF motif,26个在E+GSC和E+NSPC中共有的发育相关TF motif。其中,TEAD1/4是具有很高活性的TF( motif是GSC特有peak中显著富集,且基因表达水平高),其它候选TF包括ATF3、RFX1、FOXA1等。而E+GSC和E+NSPC中共有的发育相关TF包括SOX1、IRF3、NFIA等。然后,作者利用以前的类似的E+/E-GBM的RNA-seq数据,考虑到肿瘤特异性TF的基因表达水平,其中只有TEAD1在E+GSC中差异过表达。
此外,作者分析了所有TEAD家族成员(1-4)在TCGA数据库RNA-seq数据中的表达水平,发现TEAD1是150个GBM样本中表达最高的TEAD家族成员,且在蛋白水平上,TEAD1在PDX胶质瘤中表达。因此,TEAD1是GBM肿瘤中表达最高、表达最广泛的TEAD家族成员。
TEAD1的功能性作用
在体外实验中,利用CRISPR-Cas9基因编辑技术敲除TEAD1/4,发现KO肿瘤细胞系的增殖与迁移受到抑制,而过表达TEAD1/4后则可增强其调控作用,促进肿瘤细胞系的增殖与迁移。在体内实验中,选择体外抗迁移效果最强的TEAD1KO细胞系进行异种移植,发现肿瘤浸润的面积和体积均显著降低。总之,TEAD1是在GBM迁移中发挥重要作用的转录因子。
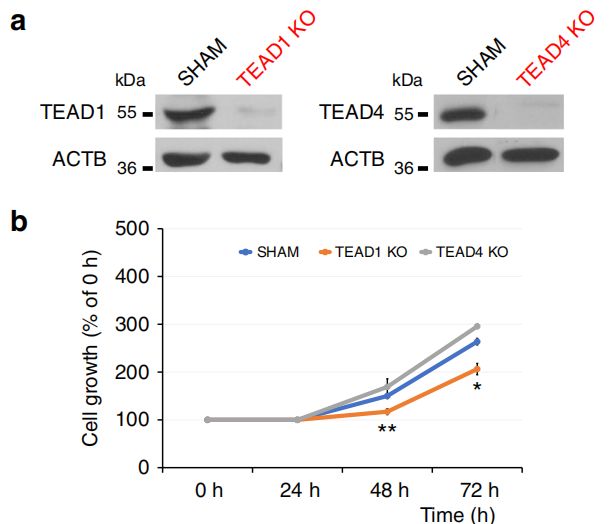
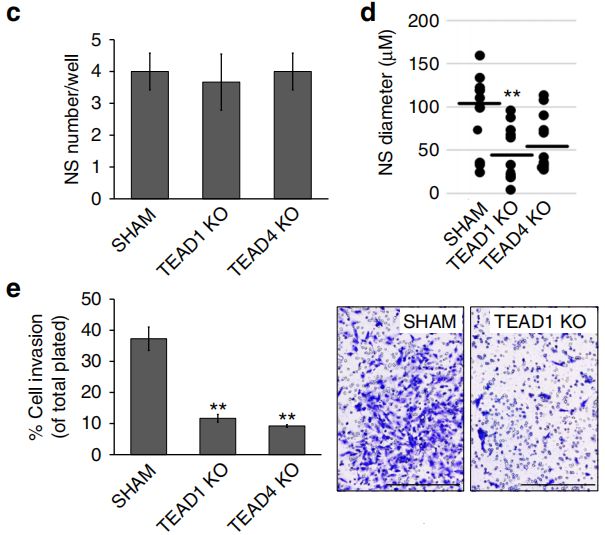
体外功能验证
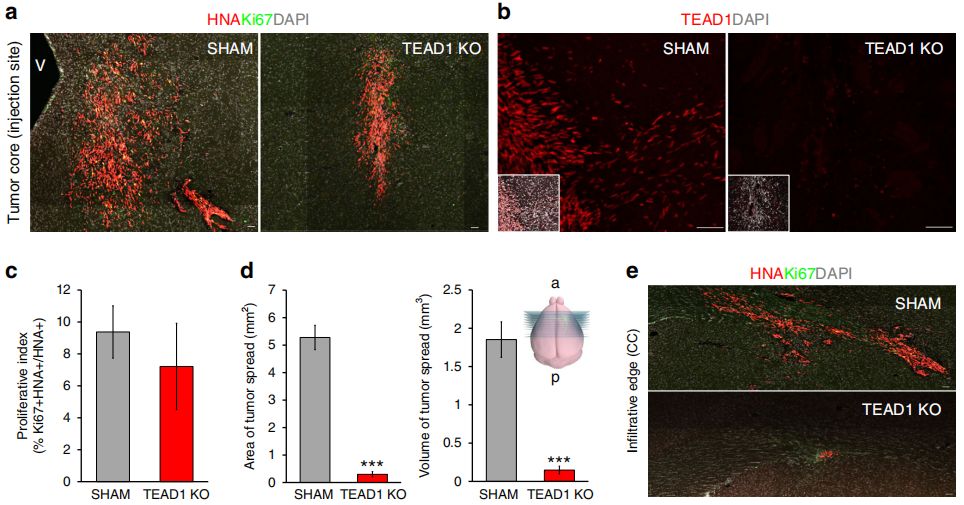
体内功能验证
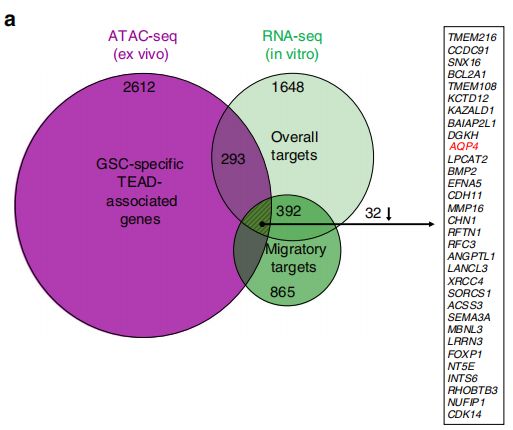
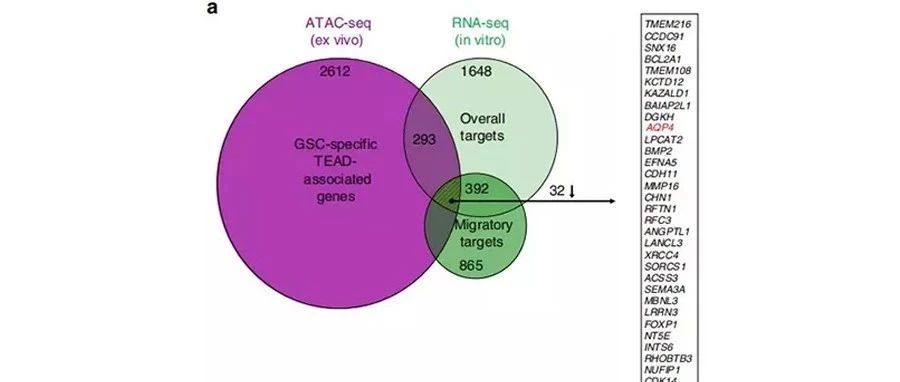
TEAD1调控的靶基因筛选
GSC中TEAD1可接近区域peak(ATAC-seq)和基因表达水平(RNA-seq)的一致性分析,结合GBM中TEAD1与基因共表达(TCGA中的GBM RNA-seq数据)分析,发现TEAD1的靶基因包括EGFR、AQP4、CDH4、TNC等多个候选靶基因。
作者利用不同亚型人GBM肿瘤样本,通过ChIP-PCR对TEAD1的候选靶基因进行验证。进一步结合TEAD1KO相比于对照的异种移植样本中靶基因表达水平,EGFR、AQP4、CDH4在TEAD1KO样本中表达下调,因此,TEAD1可能是通过结合靶基因EGFR、AQP4、CDH4调控其表达进而参与GBM迁移。
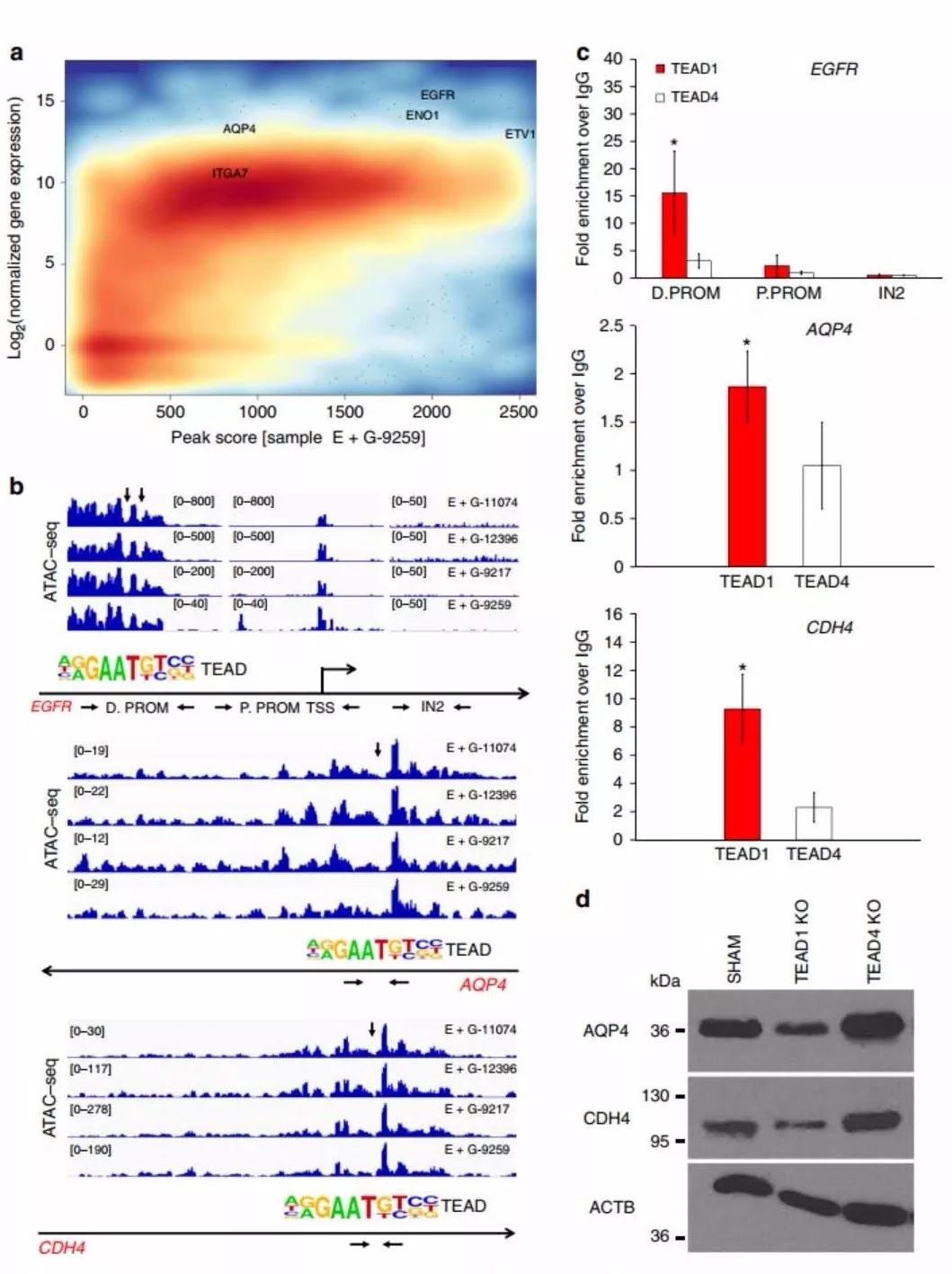
TEAD1调控靶基因参与迁移的机制
TEAD1KO异种移植样本中EGFR的表达水平低于对照样本,且TEAD1KO细胞系中EGFR表达相比于正常对照细胞系显著下调,TEAD1过表达后EGFR表达有回升。对EGFR下游信号元件的表达水平的检测发现,pERK在TEAD1KO细胞中下调,而pAKT则不同。TEAD1KO细胞经过较长时间的培养后,EGFR表达恢复,而迁移仍受影响。因此,TEAD1直接且短暂地调控EGFR。
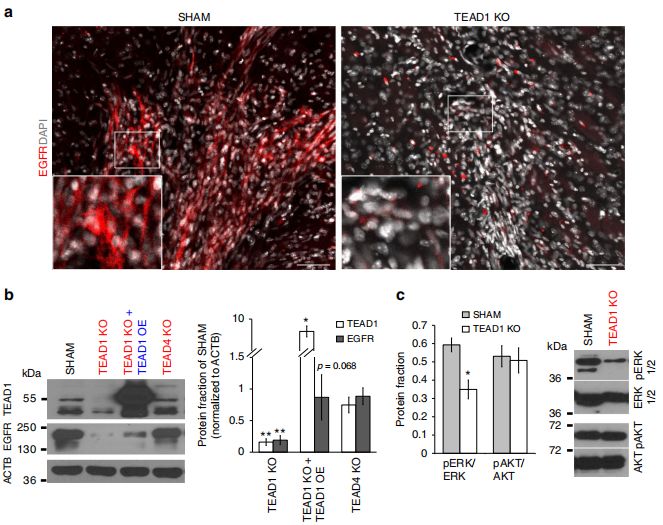
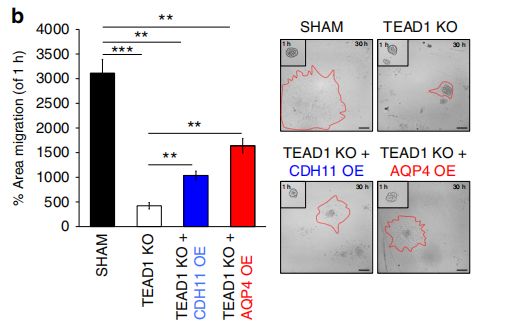
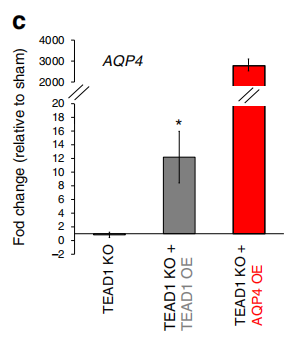
在对照和TEAD1KO细胞中过表达AQP4后,细胞的迁移能力提高了~ 50%,说明AQP4在GBM迁移中发挥了一定作用。且过表达TEAD1后不仅促进细胞的迁移,同时也上调了AQP4的内源性表达。因此,TEAD1和其下游靶基因AQP4的表达在促进原发性GBM细胞的迁移中存在直接的机制联系。
小结
作者通过ATAC-seq绘制了胶质母细胞瘤干细胞(GSC)和神经干细胞(NSPC)的全基因组染色质开放区域图谱,并结合转录组测序数据发现了在肿瘤细胞迁移中起关键作用的转录因子TEAD1,并通过细胞和异种移植模型水平上的TEAD1的敲除与过表达的体内外功能验证实验,验证了TEAD1促进迁移的功能性作用。
作者通过ATAC-seq和转录组测序数据筛选出来TEAD1的候选靶基因,并进一步利用ChIP-PCR,验证了与TEAD1结合的靶基因–AQP4、EGFR和CDH4。TEAD1敲除使AQP4下调,TEAD1过表达可恢复AQP4的表达,而TEAD1和AQP4过表达均可修复TEAD1KO细胞的迁移缺陷,说明TEAD1作用于靶基因AQP4,调控其表达,进而参与GBM迁移的直接调控机制。
![]()
【文献】
Tome-Garcia J, Erfani P, Nudelman G, et al. Analysis of chromatin accessibility uncovers TEAD1 as a regulator of migration in human glioblastoma[J]. Nature Communications, 2018, 9(1).
下载方式:(复制链接到浏览器或点击阅读原文获取,如果没有云平台账号需要先注册一下)
https://international.biocloud.net/zh/article/detail/30275445








 京公网安备 11011302003368号
京公网安备 11011302003368号