RNA-seq揭示反义lncRNA COMET 在 BRAF 与 RET 驱动的乳头状甲状腺癌中的致癌作用
英文标题:Oncogenic properties of the antisense lncRNA COMET in BRAF- and RET-driven papillary thyroid carcinomas
发表杂志:Cancer Research
影响因子:9.13
发表时间:2019年3月
研究背景
NATs(Natural Antisense Transcripts,天然反义转录本),已报道可以顺式调控正义链基因的表达水平,增强或抑制局部水平的转录,或调节mRNA的稳定性,招募mRNA活化多核糖体翻译,也可以远距离反式调节其他基因的表达。
许多lncRNA作用被陆续报道,尤其是在癌症进展方面。例如反义转录本ZEB2-AS( zinc finger Ebox binding homeobox 2),调节正义链基因ZEB2的可变剪接。ZEB2-AS与ZEB mRNA的5’UTR的结合阻止了正确的剪接发生,导致内含子保留。该事件增加了ZEB mRNA的翻译效率,导致癌细胞的增殖,侵袭和转移增强。在其他情况下,作为黑素瘤中的SAMMSON,lncRNA的敲低显示出有效的抗肿瘤发生活性,表明这类ncRNA在癌症治疗中是有希望的候选药物靶标。因此,鉴定癌症相关的lncRNA增强了对癌症生物学以及随后的肿瘤诊断和治疗的认知。
甲状腺癌是最常见的内分泌相关癌症,约占所有肿瘤的4%。其发病率在过去三十年中增加了3倍。大多数甲状腺肿瘤是分化形式,即乳突状(PTC,75-80%)。PTC共有的遗传变异,其中包括相互排斥的激活BRAF和RAS(H-,K-和NRAS)突变 – 分别占40-60%和10-15%的病例 – 和RET重排(RET / PTC癌基因)在约20%的病例(Atlas of Genetics and Cytogenetics in Oncology and Haematology)中描述。癌症基因组图谱( The Cancer Genome Atlas Consortium)的大规模研究和作者的独立分析发现,携有BRAF基因(特别是V600E)的体细胞突变或RET癌基因(RET / PTC)重排的PTC具有高度重叠表达模式,这种同质亚组患者(定义为BRAF样)与RAS突变或高度相似(RAS样)的肿瘤样本相比具有明显不同的特征。
作者基于PTC的RNA-Seq数据,使用从头发现方法来定义BRAF和RAS样特异性lncRNA的表达特征,并鉴定能够调节和/或干扰甲状腺肿瘤中已知癌症驱动基因表达的新候选lncRNA。鉴定了一种新的天然反义COMET(COrrelated-to-MET)lncRNA,其在BRAF样癌中显著上调,并且在相同肿瘤中与MET癌基因表达显著正相关。该lncRNA被转录为MET基因座的反义并具有细胞质定位。COMET特异性siRNA敲低减少了MET致癌基因以及其他MAPK相关基因的表达,损害BRAF样甲状腺癌细胞系的细胞增殖、迁移和侵袭性。因此,作者用数据证实了lncRNA在肿瘤中的致癌性,提供了新的lncRNA-COMET的新证据,其可维持肿瘤细胞的存活和增殖,并有助于甲状腺乳头状癌的MET驱动的侵袭。
材料和方法
RNA-seq数据分析,鉴定新的lncRNA。
Fish、RT-PCR、qPCR、RNAi、存活率及凋亡检测、克隆形成及增殖检测、细胞侵袭检测、Western Blot。
研究结果
1、基于RNA-seq数据鉴定乳突状甲状腺癌(PTC)中的新lncRNA
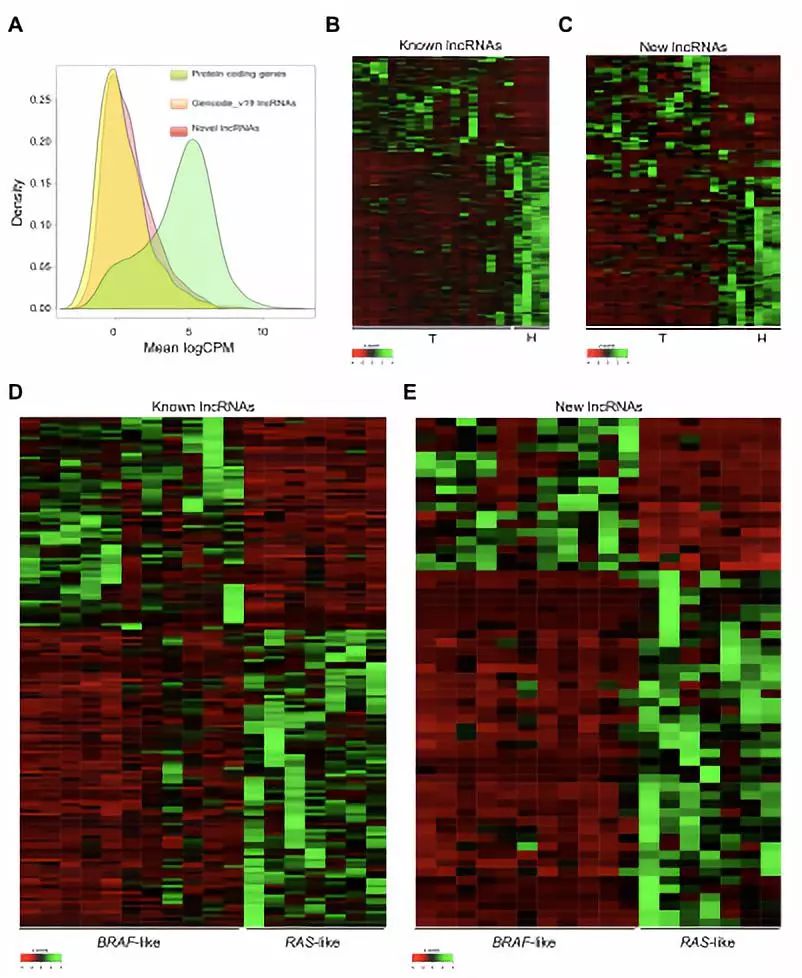
为了探索PTC中BRAF和RAS样特异性lncRNA模式,首先在最近发表的来自22个甲状腺活组织的RNA-Seq数据集中建立了从头转录组装的计算工作流程,定义一个新的PTC模型转录组。大于200nt低编码潜能且与已注释基因位点无重叠的转录本鉴定出454个新的lncRNA。与蛋白质编码基因类似,已知和新发现的lncRNA在患者和对照之间具有显著差异的表达水平(FDR <0.05)。202个lncRNAs的表达在BRAF和RAS样PTC之间存在显著差异(其中77个在BRAF样PTC中过表达,125个低表达),其中60个未在公共数据库中注释(图1D和1E;FDR <0.05)。因此,为鉴定尚未注释的lncRNAs :i)在PTC中异常表达,ii)在BRAF-和RAS样亚组之间差异表达,iii)在附近定位和iv)与已知癌症驱动基因高度相关,作者使用“最近转录起始位点”(TSS)方法选择mRNAs / lncRNAs对。有趣的是,基于这些标准,将COMET(COrrelated-to-MET)鉴定为新的lncRNA,与MET癌基因正相关(r = 0.7)。
2、COMET:一种新反义lncRNA,在BRAF样肿瘤中高表达,且由MAPK诱导的细胞质lncRNA
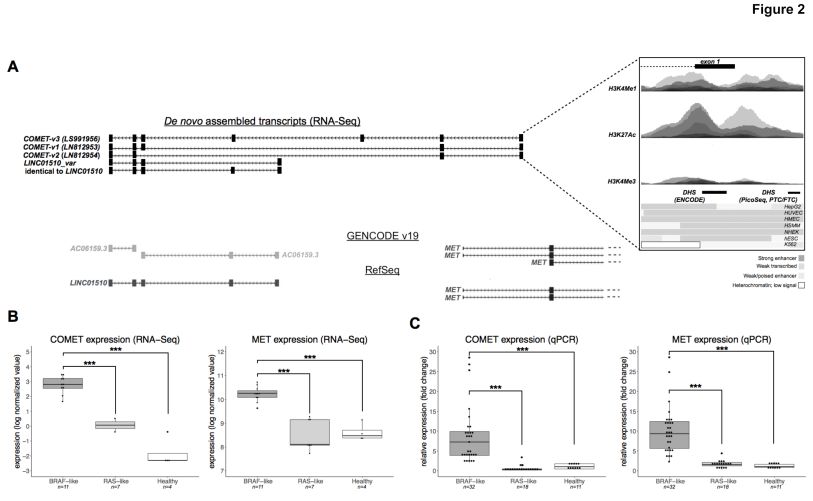
COMET lncRNA比对到染色体7q31.2,且由MET致癌基因的反义链转录而来(图2A),一般认知lncRNA具有低表达,RNA-Seq数据显示COMET表达显著低于邻近的MET癌基因。此外,RNA-Seq还显示它们都在PTC的BRAF样亚组中过表达(图2B),表明Ret和B-Raf蛋白的病理性过度激活有助于它们增加的表达水平。为了证实这一发现,根据常见的体细胞突变(BRAFV600E,H-,K-和N-RAS在密码子12,13和61的突变)和RET基因重排对以前工作中的一组更大的独立样本(肿瘤n = 50;健康n = 11)分类成BRAF样(n = 32)和RAS样(n = 18)亚组。在该独立队列中,通过qPCR确认NAT lncRNA COMET及其邻近癌基因MET在BRAF-与RAS样PTC和对照样品中过表达(图2C)。同样,分析了甲状腺癌的公共TCGA外显子组数据(THCA; n = 507),并根据驱动基因改变对患者进行了分类。然后分析了这些患者的RNASeq数据,甚至在这个独立且更大的PTC队列中证实了作者的发现。
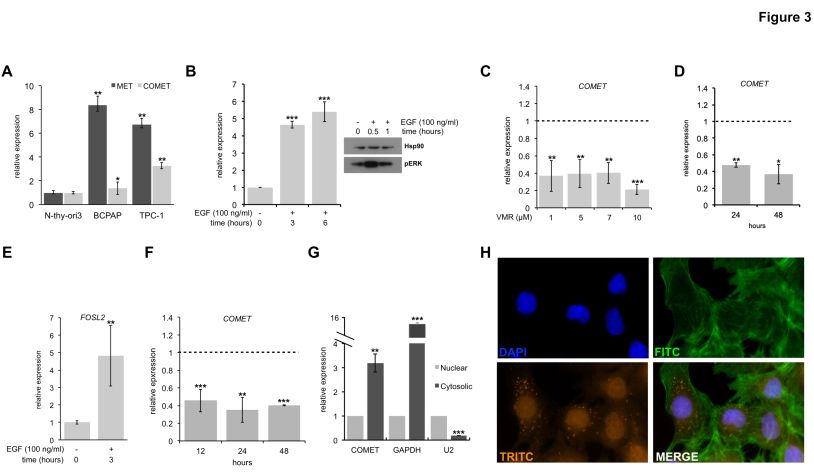
为了验证COMET表达作为Ret和B-Raf蛋白组成型激活的下游转录事件,检测了携带BRAFV600E突变(BCPAP)或RET基因重排(TPC-1)的PTC细胞系中的COMET水平与永生化正常甲状腺细胞系(Nthy-ori 3-1)的比较 。正如所料,COMET以及MET在BRAF样细胞系中的表达显著高于正常细胞(图3A); 显示最高COMET表达水平的TPC-1细胞系用作下一步大多数表型测定的体外模型。
BRAF样PTC的特征在于ERK介导的转录程序的过度激活。这一点促使研究COMET表达是否在MAPK激活下游被诱导。因此,用表皮生长因子(EGF)刺激Nthy-ori 3-1细胞中的RAS-RAF-MEK-ERK途径。MAPK途径的诱导 – 通过早期p-Erk增加证实(图3B,右图) – 随后COMET水平显著增加(图3B,左图)。相反,使用化学和遗传方法抑制BRAF突变的BCPAP细胞系中的组成型活性途径,通过用vemurafenib阻断过度活化的B-Raf蛋白(图3C)或BRAF基因KD(图3D),显著降低COMET水平。之后评估了COMET细胞定位,与qPCR偶联的RNA分级分析显示,与内参蛋白质编码基因(GAPDH)类似,COMET在细胞质RNA部分中具有明显富集(图3G)。此外,RNA FISH进一步证实了这种新的NAT lncRNA的细胞质定位(图3H)。
3、COMET lncRNA敲低可以削弱癌基因的表达
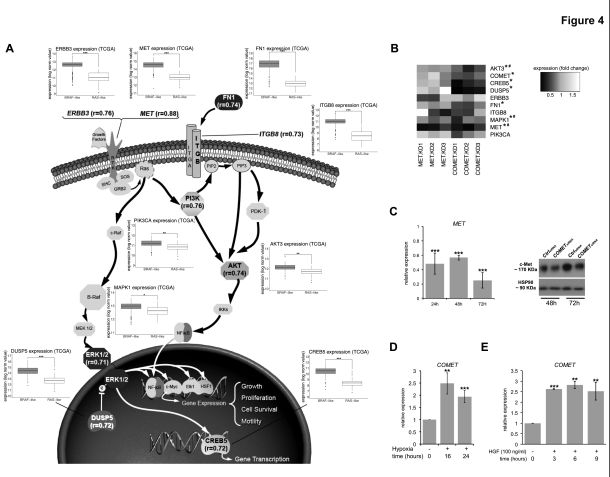
为了预测COMET的功能并确定其在乳头状甲状腺癌中的潜在生物学意义,基于共犯原则进行分析。利用基于TCGA的lncRNA图谱TANRIC,使用Pearson相关性评估甲状腺癌样本中的COMET表达是否与其他基因的表达相关。与初步发现一致,用邻近癌基因MET检测出最高相关值(r = 0.88)。此外,对与COMET显著相关(FDR <0.05;r≥0.7)的基因进行的通路分析显示MAPK通路的富集,并且有趣的是,其中一些在来自TCGA的PTC样品的BRAF样群中过表达( 图4A)。
为进一步阐述新的lncRNA与共表达网络内的其他基因之间的功能关系,在BRAF样肿瘤细胞中敲低了COMET,并检测表达水平。如图4B所示,COMET KD显著损害网络中大多数基因的表达水平,尤其是AKT3,CREB5和DUSP5。检测出COMET KD后MET mRNA和蛋白质水平的显著下降(图4C)。为了避免由于siRNA对MET表达的脱靶活性引起的任何潜在的混杂效应,用相同的COMET特异性siRNA库评估了转染HEK293细胞系的沉默特异性,其表达MET但不表达COMET 。在COMET KD后没有检测出该细胞系中MET癌基因水平的变化,表明COMET特异性siRNA不影响MET癌基因水平。进一步测试了是否可能发生相互调节,即MET KD是否会影响COMET和属于COMET共表达网络的其他基因的水平。值得注意的是,在TPC-1细胞中敲低MET(高达80%),没有检测出COMET水平以及COMET相关基因的任何显著变化(图4B),表明COMET 敲低后观察到的基因表达水平降低与MET无关。
此外,为了探索COMET lncRNA及其邻近癌基因MET的共调控,评估了MET诱导刺激是否也能触发COMET lncRNA表达。因此,关注了已知诱导MET表达的两种刺激,即缺氧和肝细胞生长因子(HGF)治疗。与在常氧条件下生长的细胞相比,在低氧条件下生长的TPC-1显示COMET水平增加2倍(图4D),揭示缺氧介导的转录反应也影响COMET表达。同样,用膜c-Met受体配体HGF急性刺激Nthy-ori 3-1也诱导COMET lncRNA水平的增加(图4E)。值得注意的是,用HGF处理也诱导FOSL2表达,进一步表明其在COMET调节中的作用。
4、COMET 敲低抑制细胞增殖和诱导凋亡,且COMET沉默影响甲状腺癌细胞的侵袭迁移。并在体外评估了COMET靶向治疗的潜力
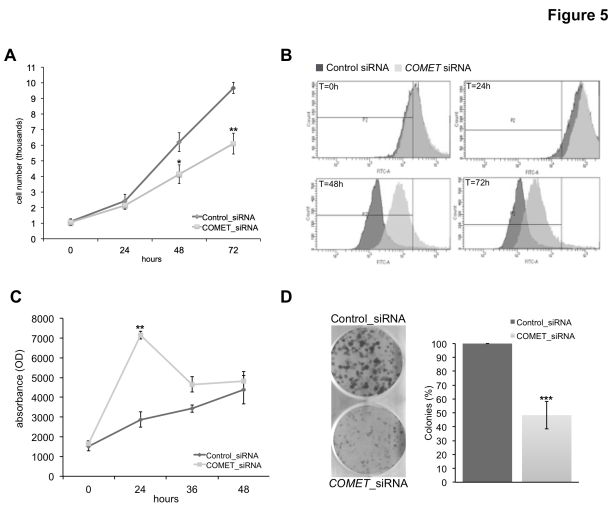
由于COMET KD引起c-Met水平的相关下降,以及甲状腺癌细胞中其他MAPK相关癌基因表达水平的显著降低,进一步研究了COMET KD对肿瘤细胞的表型效应。为此在不同时间点测量了COMET KD后TPC-1细胞系的细胞活力和增殖能力。有趣的是,与对照无关转染的细胞相比,COMET-KD活细胞的百分比显著降低至~40%(在72小时)(图5A)。通过细胞增殖测定检测COMET-KD显著降低细胞增殖(图5B)。此外,为了进一步了解COMET如何调节甲状腺癌细胞的细胞生长,通过测量半胱天冬酶3和7的活性验证了COMET KD是否能够诱导细胞凋亡。如图5C所示,沉默24小时后COMET KD显著增加凋亡TPC的数量 。最后,为了验证COMET KD是否在体外影响甲状腺肿瘤细胞的致瘤潜力,检测了COMET-KD TPC-1和对照细胞的克隆形成能力。如图5D所示,在菌落的数量和大小方面,COMET沉默显著影响甲状腺癌细胞的致癌能力。
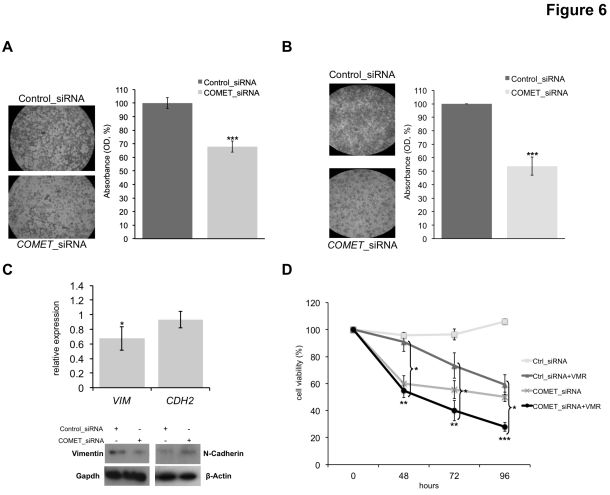
考虑到COMET沉默对c-Met蛋白的影响以及在肿瘤侵袭性生长过程中的主要作用,进一步探讨了COMET KD对甲状腺癌细胞迁移和侵袭性的影响。如图6A和6B所示,COMET敲低(高达40%)显著降低TPC-1细胞的迁移和侵袭能力。因此,在COMET KD肿瘤细胞中显示出上皮 – 间充质转换(EMT)标记波形蛋白(mRNA和蛋白质)的显著较低表达,而没有任何N-钙粘蛋白表达的变化(图6C)。总之,这些数据支持甲状腺中新鉴定的COMET lncRNA的体外致癌作用,极具表明这种性质至少部分地依赖于其对MET和MAPK相关癌基因表达水平的调节活性。
据报道,受体酪氨酸激酶(RTK),特别是c-Met受体的激活是肿瘤细胞逃避vemurafenib(VMR,维莫非尼)介导的突变体B-Raf蛋白抑制的机制。由于作者数据支持COMET可作为MET新的调节剂,猜测它是否也可能作用于BRAF突变的肿瘤细胞中的vemurafenib反应机制。首先,与TPC-1细胞类似,评估COMET沉默对BRAFV600E突变的BCPAP细胞系的生存力(高达50%)具有强烈影响(图6D),伴随MET水平的下降。当用VMR处理BCPAP时,也表现出了类似的效果(高达60%的细胞存活率降低)。因此,将敲低COMET的BCPAP细胞暴露于VMR,以评估组合治疗是否可发挥累加效应。有趣的是,图6D中数据表明,与对照细胞(即仅用VMR处理和/或用对照siRNA转染的细胞,图6D)相比,COMET敲低的 BCPAP细胞具有显著增强的VMR敏感性,表明在BRAFV600E突变肿瘤中COMET是提高化疗的新靶标。
小结
文章使用de novo发现方法分析RNA测序数据,鉴定lncRNA并定义注释的lncRNA在肿瘤亚型中的特异性。其中,鉴定了COMET(COrrelated-to-MET),一种天然反义转录物,在含有BRAFV600E突变或RET基因重排(即BRAF样肿瘤)的癌症中高表达,并诱导下游丝裂原活化蛋白激酶(MAPK)途径。在乳头状甲状腺癌中,COMET表达与MET表达高度相关,且与MAPK途径的不同致癌基因共表达。COMET的降低导致该网络内基因的表达降低,包括MET癌基因。COMET沉默抑制了携带BRAFV600E体细胞突变或RET癌基因重排的肿瘤细胞的活力和增殖,并显著降低了肿瘤细胞的运动性和侵袭性。此外,COMET的沉默显著增加了对vemurafenib(一种突变的B-raf的常见抑制剂)的敏感性。总的来说,研究结果表明COMET特别是在BRAF突变和MET诱导的乳头状甲状腺癌中可作为一种基于药物改善癌症治疗的新靶点。
参考文献
Esposito R, Esposito D, et al. Oncogenic properties of the antisense lncRNA COMET in BRAF- and RET-driven papillary thyroid carcinomas.Cancer Research,2019.
如果您的项目有任何问题,请点击下方按钮联系我们,我们将免费为您设计文章方案。








 京公网安备 11011302003368号
京公网安备 11011302003368号