2018年7月20日,中山大学中山眼科中心眼科学国家重点实验室、中山大学中山医学院广东省脑功能与疾病重点实验室和第三军医大学西南眼科医院与北京百迈客生物科技有限公司合作的多组学研究文章发表在Nature Communications上,该研究从体细胞重编程出发,探究成纤维细胞转化为诱导性神经干细胞的分子机制,为神经退行性疾病的治疗提供了强有力的策略支持。以下是对该文章的详细解读。
摘要
由体细胞重编程的诱导性神经干细胞(induced neural stem cells,iNSC)在神经疾病的细胞替代疗法和体外建模中具有巨大的潜力。已有研究证明将成纤维细胞直接转化成iNSC的方法依赖于几个关键的神经前体细胞转录因子(TF),这就提出了一个问题:这种直接的重编程是否可以由非神经前体细胞调控TF来实现。作者发现,非神经前体细胞调控TFPtf1a可以将小鼠和人的成纤维细胞直接重编程为具有分化出神经元、星形胶质细胞和少突胶质细胞的潜能和自我更新能力的iNSC,并在移植后可以改善阿尔茨海默病小鼠模型的认知功能障碍。Ptf1a的重编程活性通过与Rbpj结合的非Notch信号依赖途径,来维持NSC特化、自我更新和体内稳态。同时作者的数据确定了这是一种用于研究和治疗的更安全的非典型iNSC。
研究背景
包括阿尔茨海默病(AD)、亨廷顿舞蹈症和青光眼在内的神经退行性疾病已经成为威胁人类健康的全球性疾病。传统的治疗方法可以减缓疾病的恶化,但总体上是无效的,因为在病变部位丢失的细胞得不到补充。但内源性神经发生效率低,不足以修复损伤或疾病所导致的缺陷。再生医学目前关注的重点是如何产生大量的神经元、胶质细胞或它们的前体细胞,这些细胞能够在受累组织中整合并发挥作用,从而为损伤修复提供一个有希望的途径。目前,人类胚胎干细胞(ESC)或诱导性多能干细胞(iPSC)的临床应用受到其致瘤风险的影响。相比之下,神经干细胞(NSC)被证明是一种不容易发生肿瘤的安全细胞来源,因此为患者特异性细胞替代疗法提供了强有力的策略,并为药物发现和体外疾病建模提供了有用的工具。
体细胞重编程是一种获得患者特异性NSC的有效方法。最近的研究表明,小鼠和人类体细胞可以通过特定的组织特异性转录因子(TF)和/或化学物质实现重编程,转化为诱导性NSC(iNSC)/神经前体细胞。TF诱导iNSC的大多数情况中,重编程是通过单独的Sox2或Sox2结合其它TF实现的。最近研究证明,一个锌指结构TF-Zfp521可以直接将人类成纤维细胞重编程为iNSC。因此,由TF诱导的体细胞重编程产生iNSC似乎严重依赖于Sox2或Zfp521,而这两种TF通常在具有增殖能力的神经前体细胞中表达,是体内神经发生的关键调控因子。事实上,Sox2已被推测为iNSC直接重编程的主调节因子。这就引出了一个问题:神经前体细胞TF是否是这种直接重编程所必须的,以及非神经前体细胞TF是否能够实现这种重编程。
在此之前,作者和其他研究者已经发现了大量的TF,它们在视网膜发育过程中的有丝分裂期前体细胞和/或有丝分裂后细胞中表达,在控制视网膜细胞特化和分化方面起着关键作用。作者感兴趣的是这些前体细胞TF和非前体细胞TF是否有能力将成纤维细胞转化成iNSC或功能神经元。Ptf1a(pancreas TF-1α)是一个碱性螺旋-环-螺旋(bHLH)TF,是视网膜、小脑、脊髓和胰腺发育中不可或缺的角色。作者发现,与其它典型的iNSC重编程TF不同,Ptf1a在中枢神经系统(CNS)的有丝分裂后前体细胞中选择性表达。此外,与作者检测的其它视网膜TF不同的是,Ptf1a的异位表达可直接将小鼠和人类成纤维细胞转化为可自我更新的、高效的三能性iNSC。这种重编程需要Ptf1a和Rbpj之间的Notch非依赖性互作,以及随后的参与NSC稳态的TF基因表达和Notch信号的激活。此外,ptf1a重编程的iNSC移植后可以改善AD小鼠模型的认知功能。
材料与方法
1、RNA-seq
材料:miNSC(第10代小鼠诱导性神经干细胞)、小鼠皮质神经干细胞(SCR029)和小鼠胚胎成纤维细胞(MEF)。测序平台:Illumina HiSeq 4000。
2、ATAC-seq
材料:35000个MEF细胞,50,000个miNSC10细胞,50,000个SCR029细胞。测序平台:Illumina HiSeq X Ten。
3、体内外分化试验
4、行为学试验
筑巢试验,旷场试验,新物体识别试验,Y迷宫试验,morris水迷宫实验。
研究结果
1.Ptf1a在CNS非神经前体细胞中的表达
在E12.5时,Ptf1a的抗体免疫标记表明,在视网膜、脊髓、小脑和后脑中几乎没有细胞共同表达Ptf1a和细胞增殖标志物Ki67,表明Ptf1a在CNS分裂前体细胞中几乎不表达。RNA-seq得到的结果与此一致,E14.5鼠的视网膜中Ptf1a低表达,神经前体细胞标志物TF Sox2和Pax6高表达;与MEF相比,小鼠SCR029 NSC中Ptf1a未表达,而Sox2和Pax6高表达。同样,E11.5-E18小鼠CNS中Ptf1a显著低于神经前体细胞标志物TF Pax6、Olig2、Zfp521。这些结果表明,Ptf1a是一种非神经前体细胞TF,不太可能参与体内NSC生成。
2.Ptf1a将MEF重编程为自我更新性iNSC
作者研究了Ptf1a是否有能力将MEF直接重编程为iNSC,发现当MEF感染了强力霉素(Dox)可诱导的Ptf1a的慢病毒,并在含表皮生长因子(EGF)、碱性纤维母细胞生长因子(bFGF)和Dox的N3培养基中培养后,它们开始发生形态变化,在第6天形成群落,从第9天出现大量神经球(图1 a,b,d)。对照MEF感染Dox可诱导的GFP的慢病毒,几乎没有形成任何正常形状的神经球(图1 b,d)。当将多个ptf1a诱导的神经球作为混合物收集、分离和再培养后,它们从第3天开始迅速形成新的次代神经球(图1c),表明它们具有自我更新能力。
作者分别选取了初代神经球,以克隆的方式获得了多个重编程的小鼠iNSC (miNSC)细胞系。将它们分别单独植入到有Dox的平板孔中,发现NSC形态的细胞逐渐从粘附的神经球生长。在含有或不含Dox的情况下,它们被进一步扩增和传递了30代。在约第10代时,所有miNSC细胞系不再生成神经球,开始变得均匀,并形成一个典型的NSC单层。与前期试验发现的每个克隆形成的miNSC具有自我更新能力一致,作者发现~ 32.6%的miNSC10细胞被EdU 脉冲标记,高于野生型鼠NSC细胞系SCR029(18.9%)(图1 e,f)。因此,通过Ptf1a重编程MEF得到的miNSC具有增殖能力和自我更新能力。相比之下,被GFP慢病毒感染的MEF并不能产生典型的NSC标记物免疫性的神经球,形成的少数球状体看起来异常,并且在培养时没有任何扩增能力。
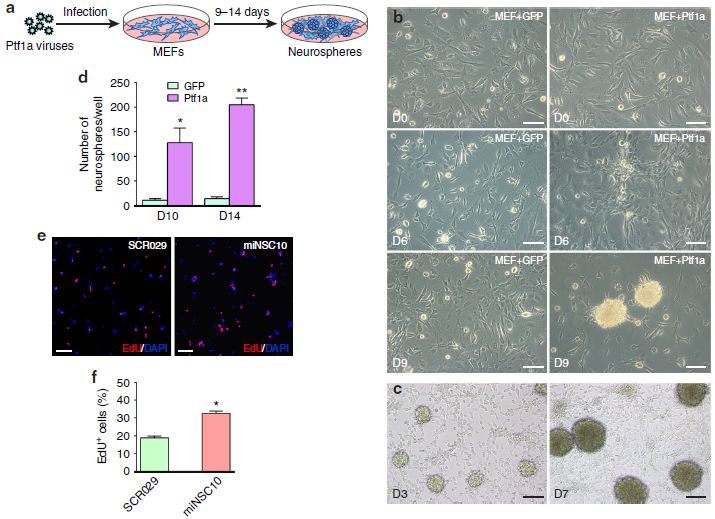
图1 ptf1a直接将MEF转化为神经球
为了证实Ptf1a确实直接将MEF诱导为miNSC,作者使用针对多个NSC标志物的抗体进行了免疫荧光染色。结果表明外源性Ptf1a在神经球中高表达,进而诱导NSC标志蛋白Sox2、Pax6、Olig2和Nestin的显著表达(图2a)。在单层miNSC中,Sox2、Pax6和Nestin的表达量仍然很高(图2a)。qRT-PCR结果与蛋白表达水平相一致(图2b)。相比之下,与小鼠ESC相比,miNSC细胞系中多能性基因Oct4、Nanog和Klf4的表达量很少,甚至没有表达(图2c)。此外,由于细胞命运的改变,miNSC细胞系中MEF标志基因Snai1、Twist2和Col1a1的表达显著减少(图2d)。与miNSC中Nestin基因的转录活性一致,其启动子在miNSC和对照SCR029细胞中低甲基化,但在MEF中高甲基化(图2e)。然而,Oct4和Nanog的启动子在这三种细胞类型中都是高甲基化的(图2e),这与这些细胞中多能性基因表达量很少的结果是一致的。
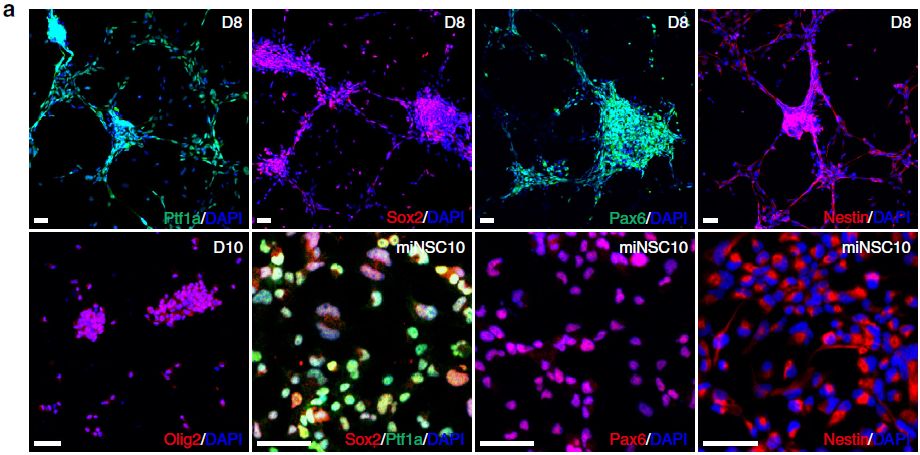
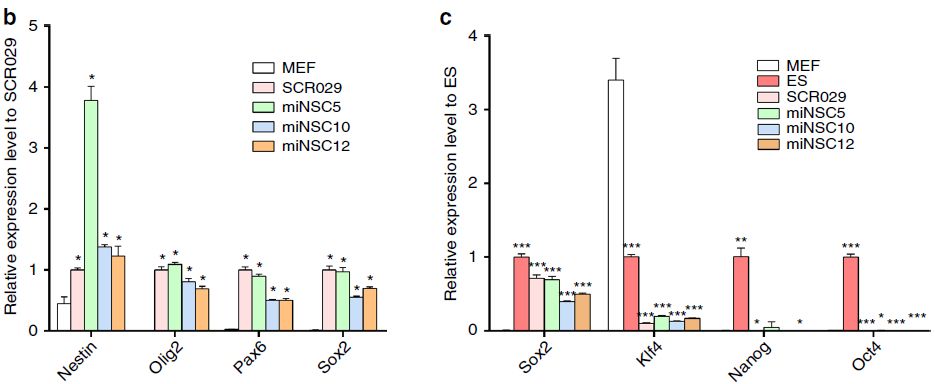
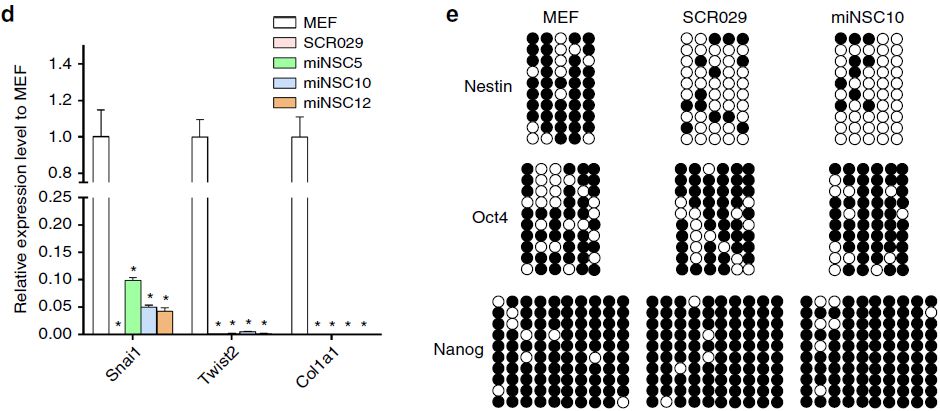
图2 ptf1a重编程的NSC特征分析
Six3是一个前脑腹侧和视网膜前体细胞的标志性TF。作者通过semi-qRT-PCR和qRT-PCR发现,与MEF相比,ptf1a重编程的miNSC中Six3表达明显增加。Six3-Cre转基因小鼠与R26R-YFP报告小鼠杂交胚胎分离培养的MEF被Ptf1a慢病毒感染后,它形成了含有许多黄色荧光蛋白(YFP)和Nestin都呈阳性的神经球,这表明Ptf1a可能诱发前脑和视网膜前体细胞的一些干细胞特征。
为了进一步确认这些miNSC的NSC身份,作者对miNSC10、SCR029和MEF细胞进行了RNA-seq分析。miNSC10、SCR029和MEF细胞中基因表达水平的散点图显示,miNSC10和SCR209细胞的基因表达水平相似,但均与MEF存在显著差异(图3a-c)。与这些结果一致的是,聚类分析也显示出miNSC10和SCR029细胞之间有很高的相似性,但它们与MEF之间有很大的差异(图3d)。与MEF相比,miNSC中有许多基因表达水平下调或上调(图3e)。作者对上调基因进行基因集富集分析(GSEA),发现了两组主要的富集基因GO term(图3f)。其中一组在与神经发育相关的GO term中富集,如神经发生、神经元分化、神经系统发育、神经发生调节、大脑发育和轴突发生。另一组富集在细胞分裂GO term,包括细胞分裂、有丝分裂细胞周期、核分裂、姐妹染色单体分离、细胞周期调控。这些数据与miNSC作为NSC及其增殖和自我更新能力是一致的。与此一致的是,进一步的分析显示,尽管有一定的差异,但miNSC10、SCR029、NS528(小鼠ES细胞来源的NSC)和ciNSC10 (化学诱导MEF形成的NSC)细胞之间的相似性比MEF更大。
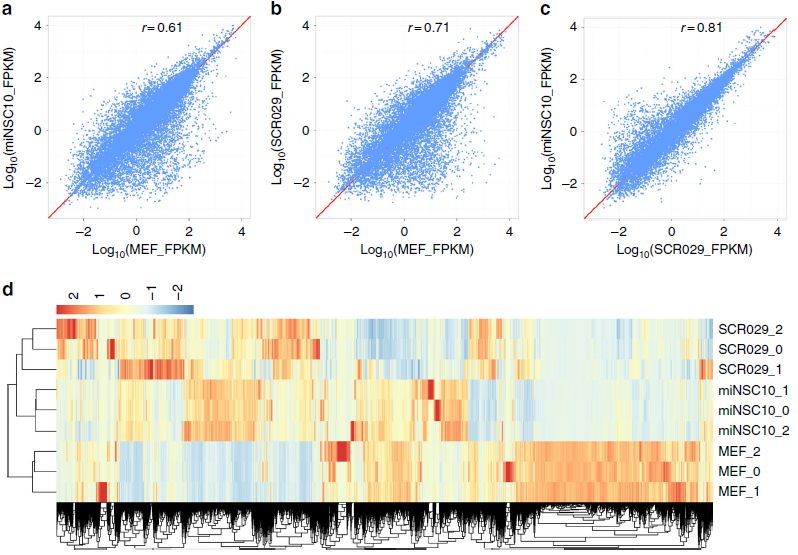
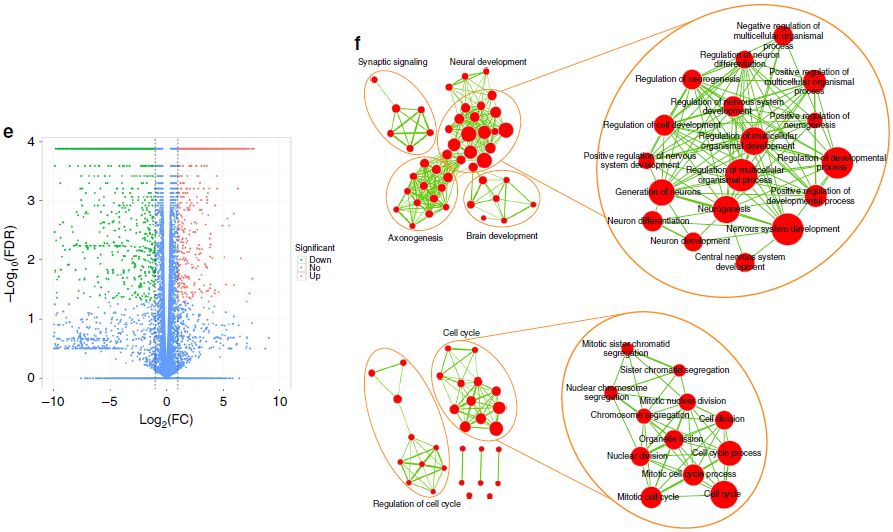
图3 iNSC、对照NSC和MEF的基因表达图谱
Ptf1a在分裂的胰腺原基中表达,在产生多潜能胰腺前体细胞中起重要作用。此外,胰腺干细胞和NSC均特征性表达Nestin。因此,ptf1a重编程的miNSC也可能可以代表胰腺干细胞。作者通过semi-qRT-PCR检测胰腺前体细胞和分化细胞的一系列标志物,发现均未在miNSC中表达,排除了ptf1a重编程miNSC可以作为胰腺干细胞的可能性。
3.Ptf1a重编程miNSC的三能性
作者想要解决的问题是由非神经前体细胞TF Ptf1a重编程的miNSC是否可以与NSC 一样,具有分化成神经元、星形胶质细胞和少突胶质细胞的潜力(图4a)。当在神经分化培养基中培养时,短短几天内,miNSC就发生了稳健的形态学变化,细胞体积变小、普遍的神经突扩张(图4b)。在培养的2-3周,许多细胞分化为Tuj1、Map2、Dcx、NeuN、Tau、peripherin或GABA免疫的神经元(图4c)。3周时的定量显示,83.3%的细胞呈Tuj1阳性(图4e)。此外,不同miNSC细胞系(miNSC5、10、12)显示类似的分化成Tuj1或Map2免疫的神经元的能力(补充图8)。在星形胶质细胞分化条件下,87.2%的分化细胞形成神经胶质原纤维酸性蛋白(GFAP)免疫的星形胶质细胞(图4 c,e),少突胶质细胞分化培养基中,miNSC能够分化为O1、CNP或MBP免疫的少突胶质细胞,而26.6%的分化细胞为O1阳性(图4 c,e)。因此,ptf1a重编程的miNSC具有三能性,能够分化为神经元、星形胶质细胞和少突胶质细胞。
通过突触素染色标记试验、电生理特性分析表明了miNSC分化的神经元具有活性膜特性(图4d、f-j)。因此,ptf1a重编程的miNSC能够分化为功能神经元。
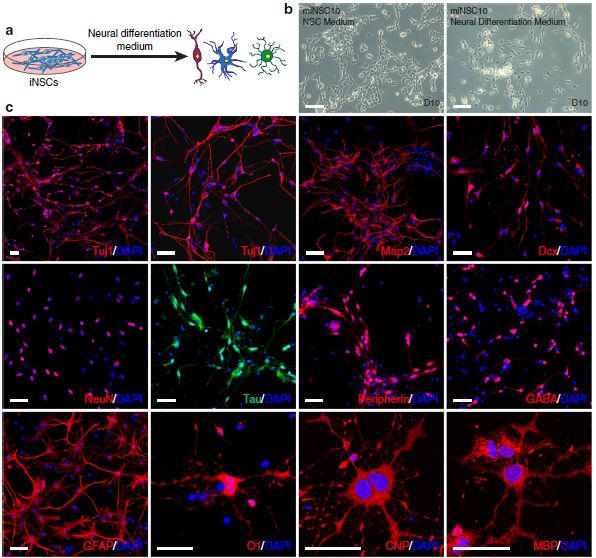
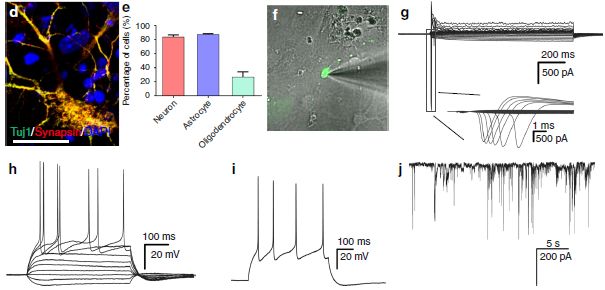
图4 ptf1a重编程的NSC的体外分化潜能
作者评估了ptf1a重编程的miNSC在体内分化成三种细胞系的潜能。将GFP标记的miNSC慢病毒注射入成年小鼠海马区,通过一系列免疫标记试验表明,ptf1a重编程的miNSC具有在体内分化为三种神经细胞和胶质细胞的多能性(图5)。另外,作者观察到分化的神经元形成具有典型的头-颈结构的成熟树突棘,它们的树突可以直接接触周围宿主细胞的多个突出蛋白阳性的突触前端(图5),这表明miNSC分化的神经元可以形成突触连接和功能性集成到现有的神经元回路。
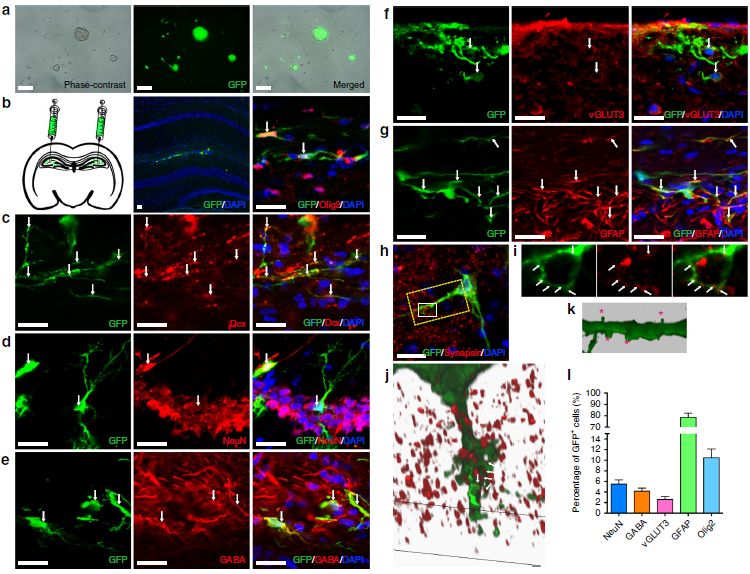
图5 ptf1a重编程的NSC的体内分化潜能
4.miNSC对AD模型的治疗效果
鉴于ptf1a诱导的miNSC在体内具有活性和三种分化潜能,作者检测了移植的miNSC是否对治疗小鼠神经退行性疾病模型有疗效。将GFP标记的miNSC移植到APP/PS1 AD小鼠模型的海马区中。移植一个月后,作者进行了一系列行为学试验来评估移植动物的认知功能(图6a)。在筑巢试验中,注射生理盐水和miNSC的小鼠的巢质量没有差异(图6b)。在旷场试验中,两组小鼠的运动总距离或中央区域停留时间也没有差异(图6c)。
为了研究学习记忆行为,进行了新物体识别试验、Y迷宫试验和Morris水迷宫试验。结果表明,对照和miNSC注射小鼠在新物体识别试验中花费在新物体上的时间没有差异,在Y迷宫试验中正确自发性交替(SAP)的总百分比没有差异(图6 d,e)。然而,Morris水迷宫试验表明,在试验第6天,miNSC移植小鼠相比于对照组平均逃避潜伏期明显降低(图6),并且这些移植小鼠在目标象限的逗留时间更长(图6f)。此外,移植小鼠似乎对目标平台位置有偏好,但这一偏好没有达到统计学意义(图6f)。综上所述,这些结果表明移植的miNSC可以显著提高APP/PS1 AD小鼠模型的空间学习和记忆能力。
作者也评估了miNSC对β-淀粉样蛋白1-40(Aβ1-40)损伤AD小鼠模型的治疗潜力。首先确定了Aβ1-40损伤小鼠的学习和记忆障碍小鼠与AD类似。将GFP标记的miNSC在注射Aβ1-40 2周后移植到相同位置。两个月后,作者进行了同样的行为学试验,发现移植miNSC可以显著提高APP / PS1和Aβ1-40损伤AD小鼠模型的空间学习和记忆能力,疗效与ESC来源的NSC相似(图6g-k)。
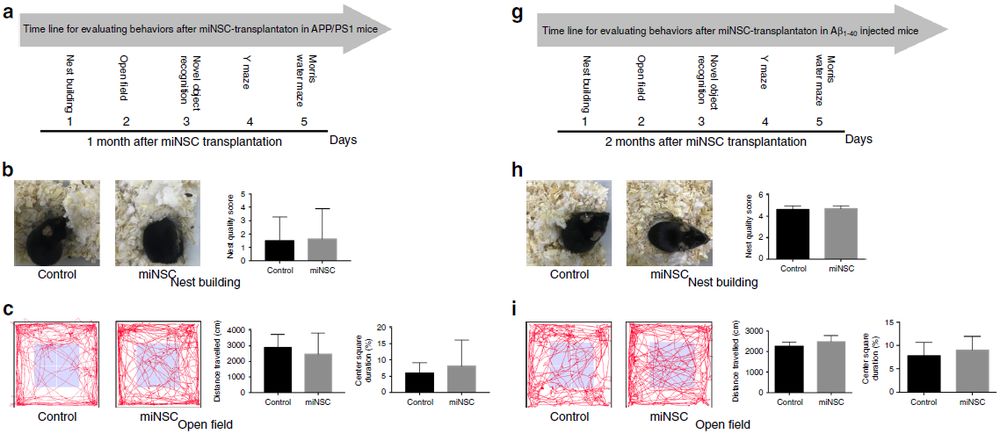
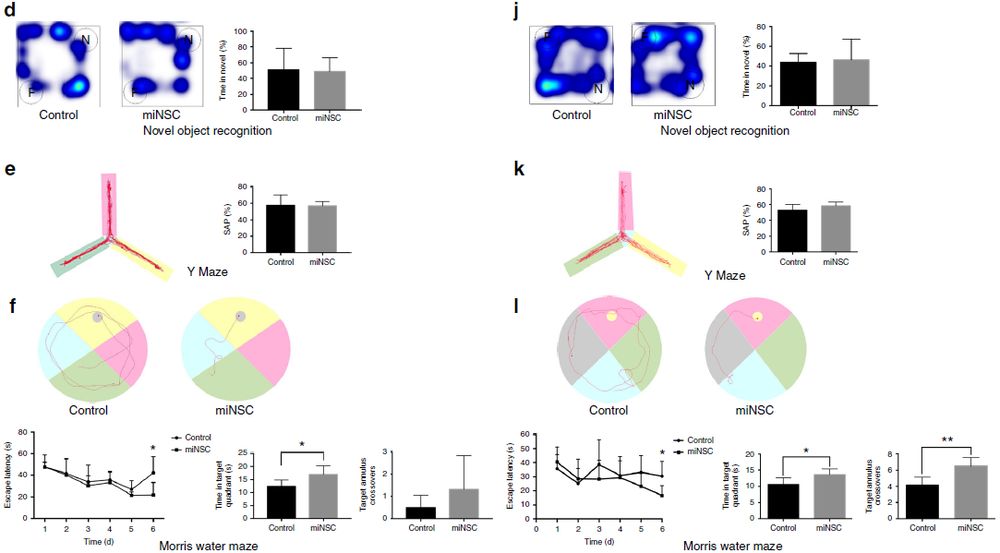
图6 移植miNSC对APP / PS1和Aβ1-40损伤AD小鼠模型的疗效
5.Ptf1a重编程对Rbpj互作的依赖性
先前有研究表明,Ptf1a与Rbpj、E-蛋白以非Notch信号依赖性方式形成DNA结合三聚体,以特化胰腺细胞系和GABA能神经元。作者研究了Ptf1a和Rbpj之间非Notch信号依赖性的互作是否也是Ptf1a重编程所需要的。在MEF中,WB和免疫共沉淀结果显示,Rbpj蛋白是内源性表达,外源性表达的Ptf1a可以免疫共沉淀Rbpj。将Dox可诱导的 Ptf1aW298A(此突变体中Ptf1a与Rbpj的互作被破坏,但仍可与E-蛋白结合)慢病毒注射到MEF中,在注射6天后,没有发生典型形态变化以形成细胞群落,只在9—14天产生了少数类似正常形态神经球的群落,而注射了野生型Ptf1a病毒的MEF则在在9—14天,在12孔板中每板产生了数以百计的神经球(图7 b,c)。类似地,MEF感染Ptf1aW298A慢病毒后未能表达NSC标志蛋白质Sox2、Pax6或Nestin(图7 d)。因此,与Rbpj的互作是Ptf1a重编程的先决条件。与此一致的是,敲除MEF中Rbpj的表达后,ptf1a诱导的神经球的数量减少了两倍多(图7e-g)。
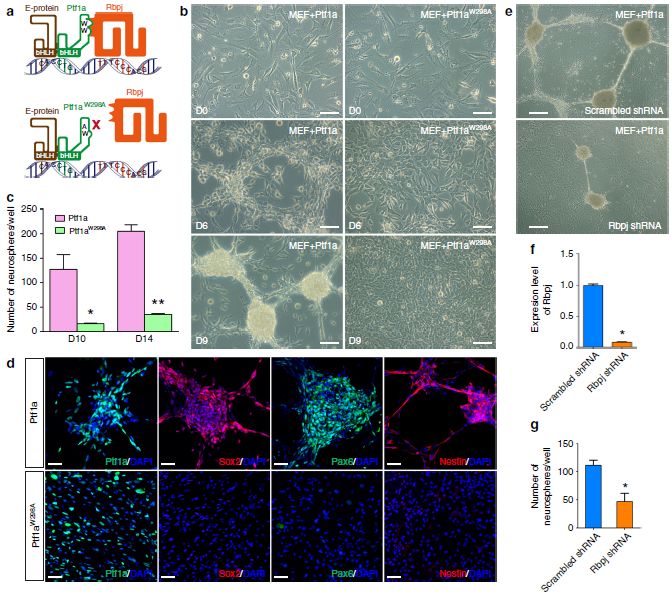
图7 Ptf1a重编程依赖于与Rbpj的Notch信号非依赖性互作
6.TF和Notch信号调节iNSC内稳态
miNSC10 iNSC和SCR029 NSC的ATAC-seq结果表明,peak关联基因富集在神经发生、神经元发育、大脑发育、胶质细胞发育(图8a, b),与NSC特征一致。在peak峰值中心300 bp窗口中鉴定新motif,说明miNSC10和SCR029细胞都富集了类似的属于多个TF家族的TF结合motif,TF家族包括Sox、bHLH (Ebox)、Pou3f、homeobox、Nfi和Rfx(图8c)。相应地,RNA-seq数据显示,与MEF相比,这些TF基因家族的多个成员在miNSC10和SCR029细胞中上调或高表达。qRT-PCR证明,除了Sox2之外,Sox5、6、8、21在miNSC10和SCR029细胞中均表达上调。一般来说,miNSC10细胞的ATAC-seq图谱与SCR029细胞相似,但与MEF完全不同;而对于上调的TF基因,如Olig2(bHLH)、Sox2、Pou3f2/Brn2、Pax6 (homeobox),与MEF相比,miNSC10和SCR029细胞中这些位点具有更多的峰和/或差异峰(图8d-g),说明更开放的染色质结构增加了基因表达。
与最富集的基序相对应的6个TF家族都有助于维持NSC稳态,如NSC状态特化、自我更新、预防静止和神经分化(图8h)。NSC的特化和维持需要Sox2。它通过与第3类POU域TF的互作远端增强子结合,特别是p3f2,它也涉及到ESC特化为神经细胞系。Olig2通过激活促增殖基因来促进NSC自我更新,同时通过抑制参与神经元过早分化和干细胞静止这些过程的基因来抑制这些过程。Pax6是一种众所周知的同源盒TF,对于NSC的特化、自我更新、多能性和神经发生至关重要。Lhx2同源盒TF通过激活Pax6的表达,同时减弱骨形态发生蛋白(BMP)和Wnt信号,从而在NSC特化中发挥作用。Nfi和Rfx家族成员已被证明与Sox2和Pou3f2共同占据基因组位点,对中枢神经系统发育和静止状态至关重要。
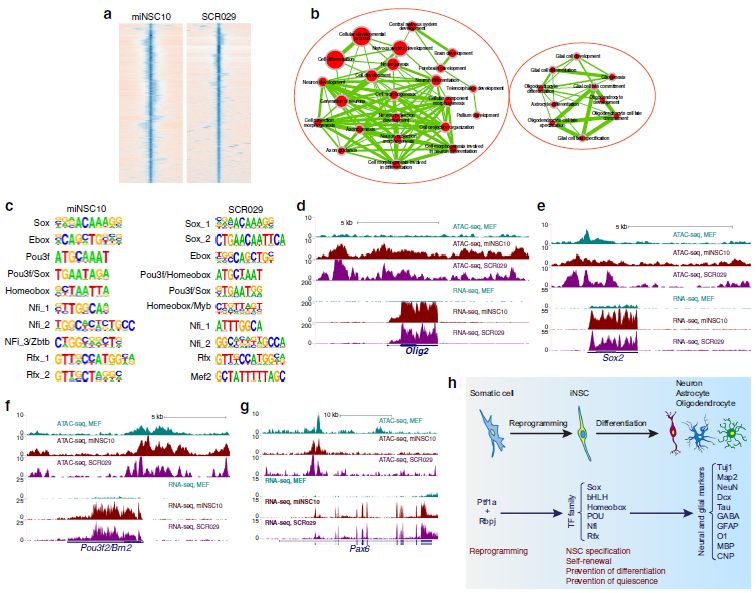
图8 iNSC和NSC的染色质可接近性和基因表达
Notch信号是一种典型的细胞接触依赖性信号通路,是NSC增殖和自我更新所需的信号通路,也是防止NSC不及时的神经分化所必需的信号通路。RNA-seq数据表明,相比于MEF,miNSC10和SCR029细胞中Notch信号相关基因Notch1、Dll1、Hes1和Hey1均显著上调,并且这些位点也显示出差异的ATAC-seq图谱,说明miNSC和NSC中的Notch信号均被激活以促进其更新和维持。与Notch1、Dll1和Hes1基因的上调一致,它们的启动子与MEF相比,在miNSC10和SCR029细胞中被低甲基化。qRT-PCR实验还表明,Ptf1a诱导的MEF中Notch1、Dll1和Hes1的表达具有时间依赖性,但对Rbpj表达无影响。为了确定Notch信号是否参与Ptf1a重编程MEF形成的神经球的自我更新和维持,作者在重编程过程中应用了Notch信号抑制剂DAPT。作者发现DAPT不仅减少了神经球的数量,而且对Notch信号效应基因Hes1和Hes5的下调作用具有剂量依赖性,说明Ptf1a可以激活Notch信号通路,而Notch信号通路又是Ptf1a重编程的miNSC自我更新和维持所需要的。
7.Ptf1a将人成纤维细胞重编程为iNSC
使用类似于MEF重编程的方法,作者通过Dox可诱导的Ptf1a慢病毒的感染,从人包皮成纤维细胞(HFF)中生成神经球(图9a, b)。只有在没有Dox的条件下扩增和传代时,才能获得完整的单层hiNSC(图9c,d)。无Dox传代到20代时,开始停止形成任何神经球,而Dox的存在时,传代到32代时仍可产生许多神经球,这表明Dox可诱导的外源Ptf1a对典型的单层iNSC生成有抑制作用。qRT-PCR试验表明,在缺乏Dox的hiNSC中NSC标志物SOX2、PAX6、OLIG2、NESTIN的表达水平比含有Dox的高几倍,解释了为什么缺乏Dox的hiNSC表现得更像典型的NSC。值得注意的是,在没有Dox的情况下,hiNSC中内源性PTF1a的表达水平比Dox存在时更高。
根据qRT-PCR结果,ptf1a重编程的hiNSC几乎不表达多能性基因OCT4和NANOG。相反,它们高表达NSC标志蛋白,包括SOX2、PAX6、NESTIN、OLIG2和FABP7(图9 e-i)。体外分化试验表明hiNSC具有三能性(图9p,j-n)因此,Ptf1a具有类似的活性,可将人类成纤维细胞重编程形成三能性NSC。作者通过突触素染色标记试验、电生理特性分析表明,ptf1a重编程的miNSC能够分化为功能神经元(图9q,r-u)。
作者进一步研究了ptf1a重编程hiNSC在体内分化成神经和胶质细胞系的潜力。将带GFP标记的hiNSC移植到成年小鼠海马区,发现ptf1a重编程的hiNSC在体外和体内都具有分化成神经和胶质细胞系的多能性。
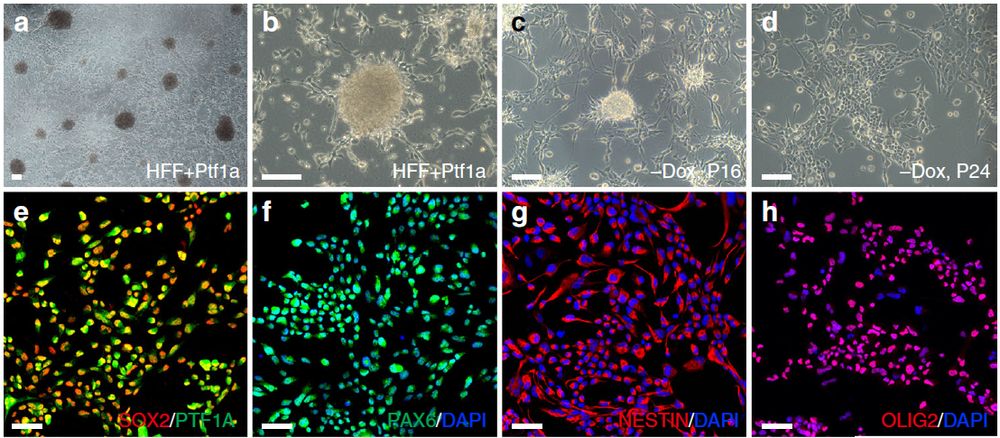
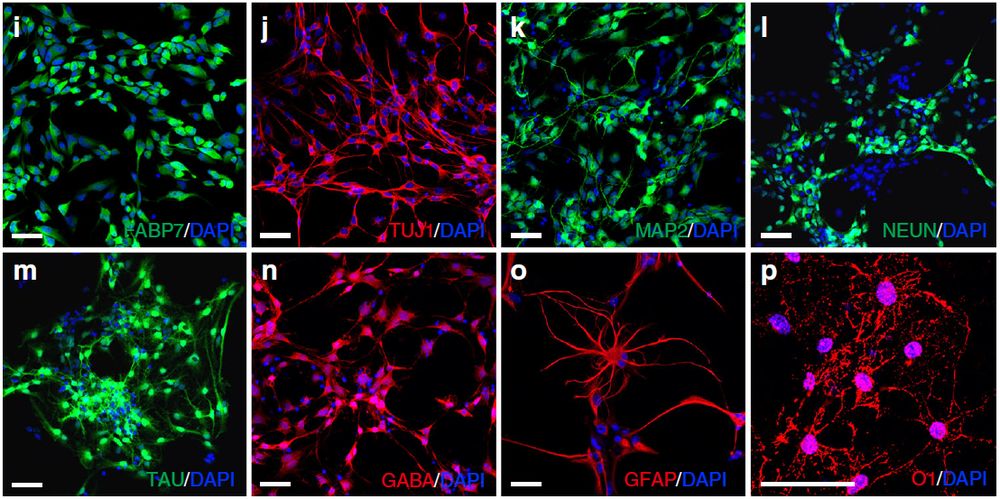
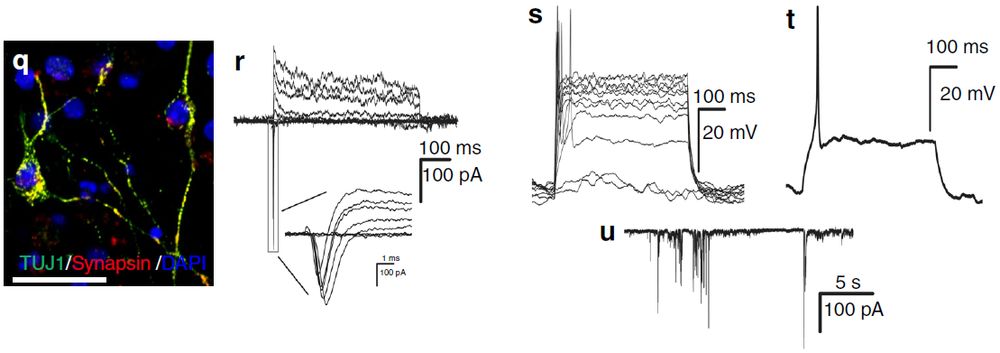
图9 Ptf1a将人成纤维细胞重编程为iNSC
目前,人类胚胎干细胞或诱导性多能干细胞的临床应用受到其致瘤风险的影响。相比之下,神经干细胞(NSC)被证明是一种不容易发生肿瘤的安全细胞来源,因此为患者特异性细胞替代疗法提供了强有力的策略,并为药物发现和体外疾病建模提供了有用的工具。
在这项研究中,通过miNSC10、SCR029和MEF的RNA-seq基因的表达水平和功能确认了miNSC的NSC身份。且相比于MEF,miNSC10和SCR029细胞中Notch信号相关基因均显著上调,并且这些位点也显示出差异的ATAC-seq图谱,说明miNSC和NSC中的Notch信号均被激活以促进其更新和维持。并且采用抑制剂DAPT抑制Notch信号后Hes1和Hes5表达下调,说明Ptf1a可以激活Notch信号通路,且Notch信号也作用于Ptf1a重编程的miNSC自我更新和维持。
总而言之,文章数据表明非神经前体细胞TF Ptf1a可独立将小鼠和人类成纤维细胞成功地重编程为iNSC,其具有三能性,能够高效分化为功能性神经元、星形胶质细胞和少突胶质细胞,并可在移植后改善AD小鼠模型的认知障碍。
作者简介
向孟清
中山大学中山眼科中心眼科学国家重点实验室课题组长,博士,教授,博士生导师。研究方向:视网膜发育、再生和发病的分子机理和基因调控网络研究、视网膜和神经干细胞的研究。领导课题组获得了多项重大原创性和系统性的成果以及多项荣誉和奖励,其中包括Basil O’Connor起步学者研究奖,Sinsheimer学者奖,Wolf, Block, Schorr and Solis-Cohen, LLP听觉科学奖等。现已在Neuron、PNAS、J Neurosci、Development等杂志上发表学术论文60余篇。
肖冬长(第一作者)
2013-2018年就读于中山大学中山眼科中心分子医学专业,期间参与多项课题,并已发表或者接收4篇SCI,包括Nature communications, Molecular brain,Frontiers in neuroscience和Developmental Neurobiology。
参考文献
Dongchang Xiao, Mengqing Xiang, et al. Direct reprogramming of fibroblasts into neural stem cells by single non-neural progenitor transcription factor Ptf1a. Nature Communications. 2018,9:2865.
欢迎与我们的生物信息工程师沟通,我们将免费为您设计文章思路方案。








 京公网安备 11011302003368号
京公网安备 11011302003368号